(biologický pohled na tkáně a jejich dynamiku za normálních a patologických okolností)
autor: prof. MUDr. Milan Elleder, DrSc. (ÚDMP 1.LF UK, Praha)
verze duben 2009
Seznam zkratek: AKB - adultní kmenové buňky; CFC - colony forming cells; EKB - embryonální kmenové buňky; EPU - epidermal proliferation unit; FDC - follicular dendritic cells; GVHD - graft versus host disease; GVHR - graft versus host response; HUMARA - human androgen receptor assay; KB - kmenové buňky; MALT - mucosal associated lymphoid tissue; mtDNA - mitochondriální DNA; NK - natural killer cells; OXFOS -oxidative phosphorylation; STR -short tandem repeat; TGF - transforming growth factor; VEGFR - vascular endothelial cell growth factor receptor
Zvýšený zájem o klonální charakter procesů, jejichž společným jmenovatelem je buněčná proliferace, je snaha zjistit, zda je expandující buněčná populace derivátem jedné buňky (proces monoklonální), buněčné skupiny (proces oligoklonální) nebo zda jde o polyklonální, nebo až systémovou reakci určité buněčné populace. Klonální charakter určité buněčné populace tedy naznačuje její selektivnost, t.j. že v jejich počátku stála jediná buňka nebo jen omezený počet buněk z určité buněčné populace. Krom toho lze pomocí klonů lépe chápat biologii tkání, jejich složení, dynamiku a diferenciaci. V patologii pak lze interpretovat řadu procesů, doposud presentovaných klasicky, jako výraz narušené biologie klonů.
V nejobecnějším pojetí je klonování vytváření identických kopií molekul, buněk, nebo celých organismů z nich samotných. Laické představy jsou omezeny na vytváření identických biologických organismů.
Etymologicky je termín klon odvozen z latinského clonus i. m. ( záškub, škubavá křeč). Etymologický základ slova zjevně vyjadřuje identitu opakovaných pohybů.V řečtině znamená klonos proutek, potomek, zmatený pohyb.
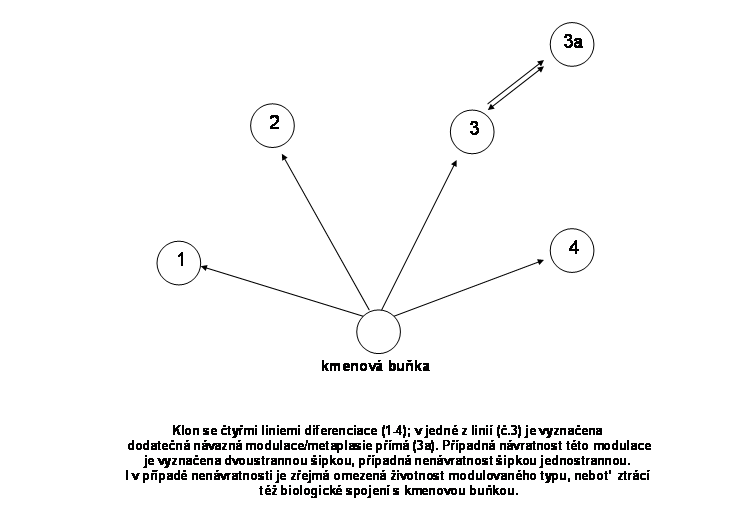
Všeobecně přijímaná biologická definice klonu je zaměřena zejména na buněčnou úroveň. Podle ní jde o populaci buněk vznikající mitotickou expansí jediné buňky. Klonu může dát vznik jakákoliv buňka schopná mitosy. Klony se liší životností a komplexností. V řadě případů může dojít k dodatečnému rozrůznění buněk v klonu a výsledná populace se pak skládá z několika buněčných typů (různých linií). Dochází k tomu např. asymetrickými mitosami, při kterých se každá z obou dceřiných buněk dále diferencuje odlišným způsobem. Některé klony jsou obzvláště komplexní a mohou obsahovat i další (nižší) samostatné klonogenní etáže.
Biotechnologickou analogii buněčného klonu je klon molekulární, definovatelný jako vytváření kopií určité molekuly, která slouží jako předloha (templát). Klasickým příkladem je klonování genu. Skutečnost, že byl gen klonován znamená, že byl dokonale poznán - tedy isolován, vpraven do vektoru a replikován (sloužil jako templát pro traskripci) v určitém buněčném systému pro veškeré další následné studie. Klonování je tedy odlišné od produkce určité látky, i pokud půjde o buněčný klon - např. produkce monoklonální protilátky monoklonální populací B lymfocytu znamená de novo produkci (molekula proteinu neslouží jako templát). V tomto smyslu je poněkud kontroversní tvrzení, že podstatou prionových onemocnění je replikace prionů, neboť k jejich množení dochází tím, že patologický prion (viz. Skripta díl 2) indukuje patologickou konformaci u preexistujících prionů, které se takto transformují.
Současná úroveň znalostí nám dovoluje pohlížet na klony jako na buněčné soustavy, odlišné mechanismem, okolnostmi vzniku a stupněm heterogenity výsledných populací.
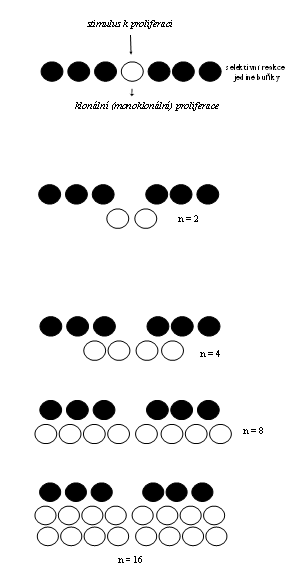
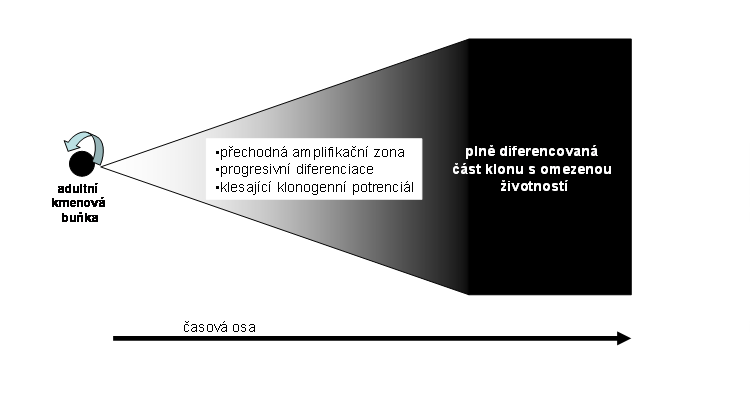
Sem lze zařadit jednoduché reaktivní klony, vznikající v diferencovaných systémech - tedy ve zralých tkáních za určitých situací, kdy na stimulus, působící na určitou populaci diferencovaných buněk, reagovala sérií mitos jediná buňka (odlišná od buňky kmenové), změněná určitým inzultem nebo predisponována selektivní reaktivitou (viz. dále). Tato buňka se zcela přemění v dceřiné populace, aniž by byla asymetrickou mitosou zajištěna její trvalá existence. Veškerý klonogenní potenciál je tedy pouze jednorázový a velikost klonu je dána výlučně proliferační aktivitou dceřiných buněk Úroveň diferenciace se v reaktivním klonu nemění (na rozdíl od níže uvedených klonů trvalých a embryonálních), i když některé jeho buňky mohou být funkčně modulovány. Životnost klonu je omezena na životnost vzniklé buněčné populace (obr 1). Klon má tedy trvání dočasné.
Jednotlivé případy reaktivních klonů jsou uvedeny dále v textu. Existence reaktivních klonů svědčí pro to, že ve zdánlivě zcela homogenní populaci buněk mohou být selektivně pozměněné elementy, které jsou predisponované k proliferaci. Může to být též projevem získané genetické heterogenity buněčné populace (somatické mutace), která může být již prvou známkou přítomnosti patologického procesu (viz. klonální poruchy).
Obr. 1 Rozvoj jednoduchého reaktivního klonu nezávislého na kmenové buňce. Klonální proliferace jedné selektivně predisponované buňky. Vzniklý klon je na stejné úrovni diferenciace

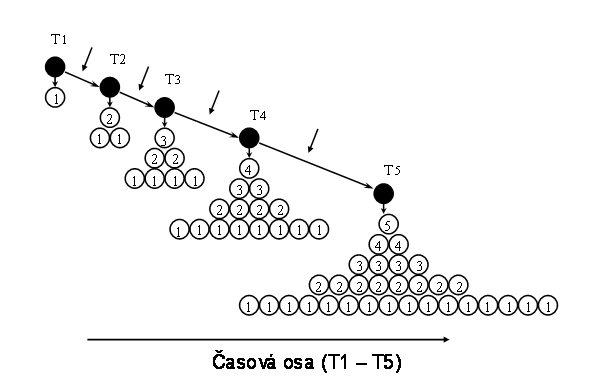
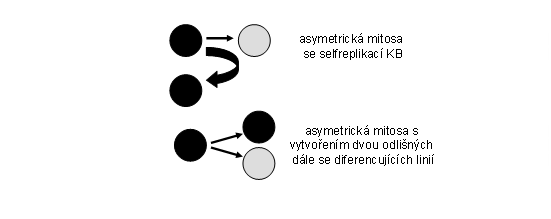
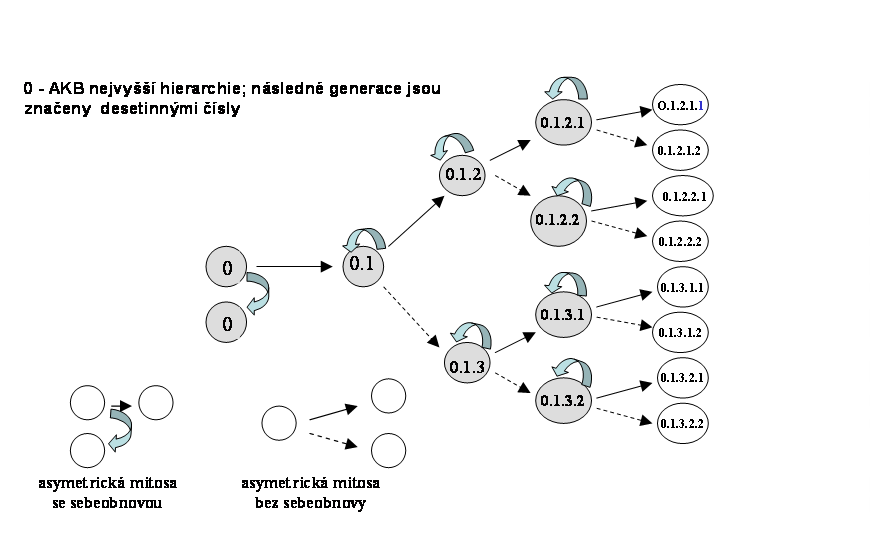
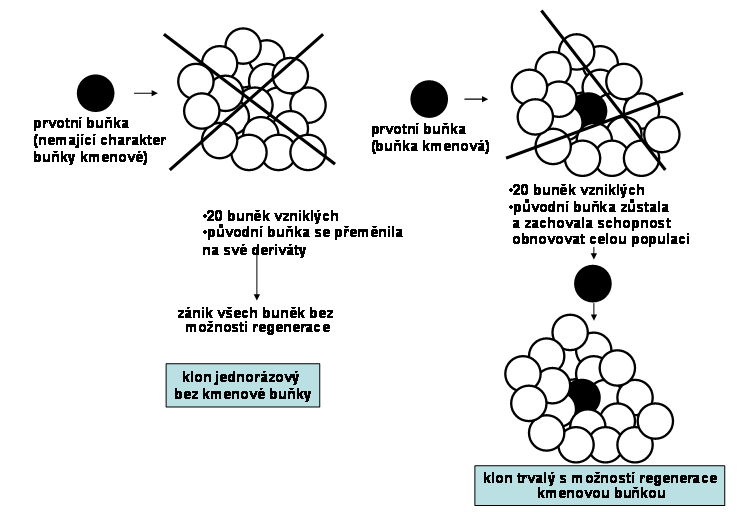
Tento typ klonu zajišuje postnatálně trvalou obměnu tkání a tím jejich optimální kvantitativní a kvalitativní složení (příslušné spektrum buněčných typů a jejich početné zastoupení). Buněčná populace klonu vychází z multipotentních tzv. adultních kmenových buněk, tedy z buněk s trvalým klonogenním potenciálem (viz. níže), vzniklých v rámci embryonálního klonu (viz. níže). Trvalý klonogenní potenciál je dán možností jednoho typu asymetrické mitosy, při které se dále diferencuje pouze jedna ze dvou dceřinných buněk, zatímco druhá zůstává na původní "kmenové" úrovni a udržuje počet kmenových buněk na trvalé úrovni (sebeobnova, selfreplikace) (obr.2). Asymetrické mitosy jsou dominantní vlastností těchto adultních kmenových buněk. Diferenciační potenciál se může různit v jednotlivých tkáních. Každá kmenová buňka tak dává vznik jednomu klonu v sukcesivních vlnách. V rámci permanentního klonu dochází běžně k diferenciaci do dvou a více buněčných linií. Vedle asymetrických mitos nezbytných pro sebeobnovu existují tedy i asymetrické mitosy, které dávají vznik přímo dvěma odlišným liniím, ke kterým dochází na "bifurkačních" místech klonu (obr. 3). Některé klony jsou v tomto smyslu velmi komplexní a skládají se z kmenových buněk různé hierarchie, každá z etáží s různým stupněm regulace (obr.4)
Obr. 2 Základní schéma permanentního klonu: permanentní produkce buněk (bílé kroužky), při zachování klonogenního potenciálu adultní kmenové buňky (označena černým kroužkem). T1-T5 representují jednotlivé fáze vývoje klonu
Obr. 3 Dva typy asymetrických mitos
Množství buněk klonu závisí jednak na mitotické aktivitě počátečních generací buněk (obr.4). Mitotická aktivita KB je velmi malá. Existují doklady, že část adultních kmenových buněk slouží jako reserva pouze pro stavy zvláště vystupňovaných nároků na regeneraci (např. tzv. oválné buňky jater). Pokud by došlo k zániku kmenové buňky, životnost klonu by byla omezena životností dceřinných buněk.
Permanentní klonální systémy jsou dnes velmi dobře definované (viz. níže). V případě asymetrické mitosy vznikne z jedné buňky buňka identická, dále se nediferencující a buňka, která je progenitorem následných populací. V úvahu přichází i následnost obou procesů. Po fázi symetrických mitos, vedoucí k zmnožení kmenové buňky by nastala fáze diferenciace. Proces by však musel být striktně regulován tak, aby byla udrženo stále množství výchozích kmenových buněk.
Obr. 4 víceliniový komplexní permanentní klon s několikastupňovou hierarchii kmenových buněk (vyznačeny šedě), každá se samostatně regulovatelným klonogenním potenciálem
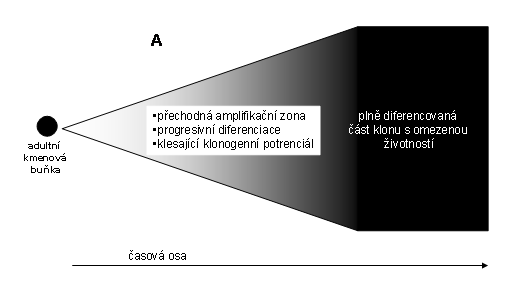
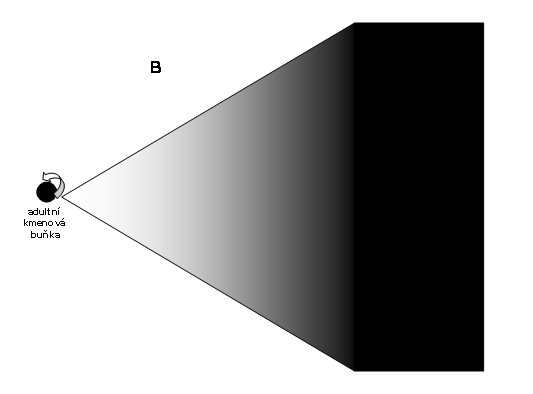
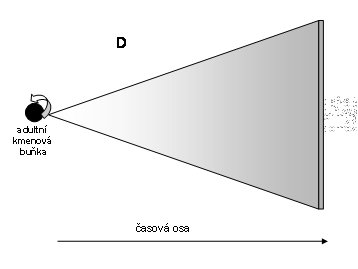
Obr. 5 Schéma permanentního klonu s důrazem na progresivní diferenciaci (znázorněná tmavnutím) a numerickou expansi (znázorněná rozpětím úhlu). Rozlišení na různé diferenciační linie není znázorněno
Na rozdíl od embryonálních kmenových buněk (viz. níže) jsou adultní KB schopny trvalé sebeudržovací funkce. Jsou orgánově specifické v diferencovaných tkáních. Jejich diferenciační potenciál je většinou proti embryonálním kmenovým buňkám omezen na spektrum buněk příslušného orgánu - jsou tedy tkáňově determinované (determinované kmenové buňky), i když vše ukazuje, že jejich diferenciační potenciál je udržován lokálními faktory a může být po jejich přenosu do jiného tkáňově odlišného prostředí výrazně změněn.
Zásadní rozdíl mezi jednorázovým a trvalým klonem je znázorněn na obr. 5a.
Obr. 5a. srovnání jednorázového a permanentního klonu
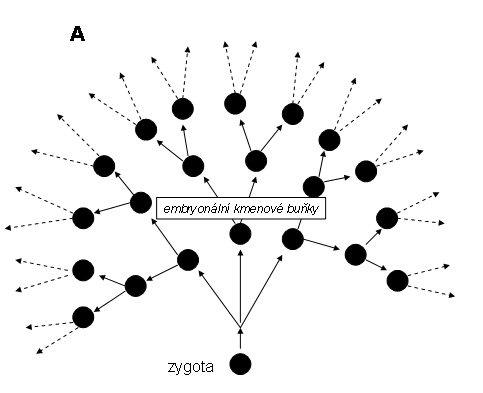
Tyto klony jsou časově omezené na embryonální vývoj a vyznačují se neobyčejnou složitostí. Mají rysy jak klonu jednorázového, tak klonu trvalého. Jsou produktem embryonálních kmenových buněk, které mají společný základ v jediné buňce - zygotě. Lidský organismus (obecně mnohobuněčný organismus) lze považovat za obrovský jednorázový fysiologický megaklon (jednovaječná dvojčata jsou výjimkou), výjimečný svým rozsahem a komplexností. Iniciální uniformní embryonální buněčná populace totipotentních buněk (tzv. embryonálních kmenových buněk, viz. shora) se velmi rychle zvětšuje a rozrůzňuje, dává vznik dalším subsystémům s embryonálními kmenovými buňkami se zužujícím se diferenciačním potenciálem (multi- a pluripotentní EKB), takže v průběhu devíti měsíců gestační doby vznikne z jediné buňky komplexní megaklon ve formě celého organismu o celkové průměrné hmotnosti okolo 3500 g, jehož počet buněk se odhaduje řádově na desítky bilionů (x13), rozrůzněný do cca. 200 buněčných typů. Celý stav předčí růst nejzhoubnějšího nádoru. Jde však o vysoce organisovaný a striktně regulovaný proces. Konečným stadiem toho komplexního megaklonu je systém diferencovaných tkání, většina z nich s omezenou životností, udržovaný systémem adultních kmenových buněk.
Pozn. Pokud by byla zajištěna možnost asymetrické mitosy na úrovni zygoty, nastala by situace analogická jako v trvale udržovaných klonálních systémech. Produkovaly by se zárodky na základě udržovaného klonogenního potenciálu trvale. Je to zároveň názorný příklad rozdílu mezi klonem reaktivním a trvalým
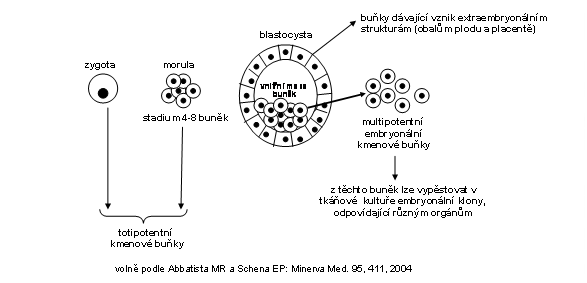
Embryonální kmenové buňky (EKB). V průběhu vývoje vzniká celá hierarchie EKB, jejichž diferenciační potenciál se postupně snižuje. Za totipotentní EKB lze pokládat zygotu a buňky moruly, které jsou schopny dát vznik kompletnímu embryu a extraembryonálním tkáním (plodovým obalům a placentů). Multipotentní EKB jsou buňky vnitřní masy v morule, které mohou dát vznik pouze embryu (Obr 6). Jsou v současnosti používány pro přípravu tkání v umělých, specielně upravených podmínkách tkáňové kultury.
EKB se liší od orgánových kmenových buněk v adultních diferencovaných tkáních (viz. níže) tím, že mají mnohonásobně větší diferenciační rádius. Jejich sebeudržovací schopnost v průběhu embryonálního vývoje je pouze dočasná, neboť rychle a progresivně dávají vznik dalším buněčným generacím podle vývojového programu. Podobně jako AKB mají schopnost symetrických (a údajně i asymetrických) mitos, ale jejich dominantní vlastností je jednorázový progresivní proces diferenciace.
Každé embryonální kmenové buňce z arbitrárně stanoveného raného stadia vývoje lze přiřadit množinu následných buněčných populací, tvořících jeden samostatný komplexní ontogenetický subklon zahrnující všechny vývojové mezistupně a končící terminálně diferencovanými tkáněmi. Klonální příslušnost se může teoreticky vztahovat k jakékoliv jednotlivé buňce v průběhu embryonálního vývoje.
Obr. 6. Schéma toti- a multipotentních embryonálních kmenových buněk
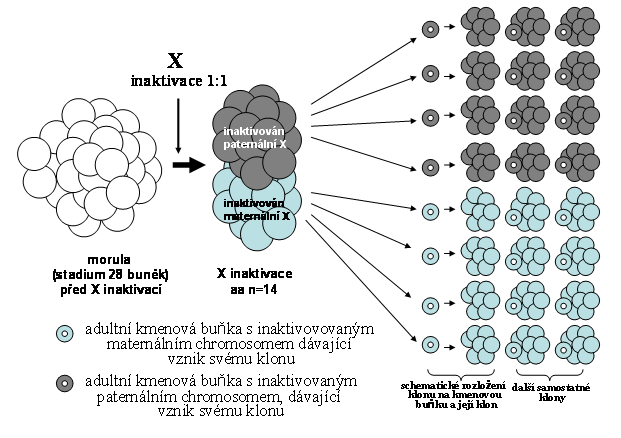
Jedinou, v současnosti prakticky použitelnou analytickou sondou do tohoto systému však představuje analysa inaktivace X chromosomu v ženském organismu, umožňující stanovit příslušnost k dvěma základním megaklonům, z nichž jeden je charakterizován inaktivací paternálního, druhý inaktivací maternálního chromosomu (techniku viz. níže). Jejich teoretický poměr je 1:1, ale je velmi často různě pozměněn (skewing, viz. obr. 7,8,9). Základní proces inaktivace X chromosomu se odehrává v době preimplantační (cca. na úrovni blastuly - tedy řádově desítek buněk). Samotný proces X inaktivace je ireversibilní (viz. též dále). Poměr obou následně vznikajících populací buněk se však může dále měnit v průběhu embryogenese klonálním zvýhodněním buněčné populace s jedním typem X inaktivace. Velikost příslušných tkáňových okrsků může tedy být značně individuálně variabilní. Pokud vytváří kompaktní formu, používá se pro ni často termín "patch" (skvrna)
Existence těchto okrsků a jejich variabilita je též významným faktorem pro pochopení odchylnosti fenotypu X-vázaných genetických poruch u žen (konvenčně "nosiček", biologicky/biochemicky analogických mosaikovým hemizygotům), kde charakter fenotypu, resp. tíži a charakter postižení určuje poměr mezi inaktivovaným X chomosomem a nesoucím mutaci v určitém genu a inaktivovaným X chromosomem normálním (viz. níže).
Typ inaktivace tedy naznačuje ontogenetickou příslušnost k jedné z malé skupiny buněk na úrovni blastuly, kdy k inaktivaci X chromosomu došlo, nebo jinak řečeno k jednomu z výsledných megaklonů (s inaktivovaným paternálním nebo maternálním chromosomem) dospělého organismu, definovaného typem X inaktivace. Tento průkaz není sensu stricto průkazem monoklonality, nýbrž zcela zákonitě průkazem oligoklonaliy vzhledem k tomu, že nemůžeme rozeznat běžně dostupnými technikami mezi primární skupinou embryonálních buněk na úrovni blastuly, kdy k inaktivaci došlo (minimální počet buněk cca. 16 ).
Obr.7. V tomto hypotetickém případě kdy dochází k inaktivaci na nejčasnější úrovni dvou buněk. Lze tedy rozdělit všechny buňky podle X inaktivace na dva stejně velké vývojové klony. Poměr je tedy primárně 1:1; následně se může poměr změnit pouze růstovým zvýhodněním jednoho z klonů
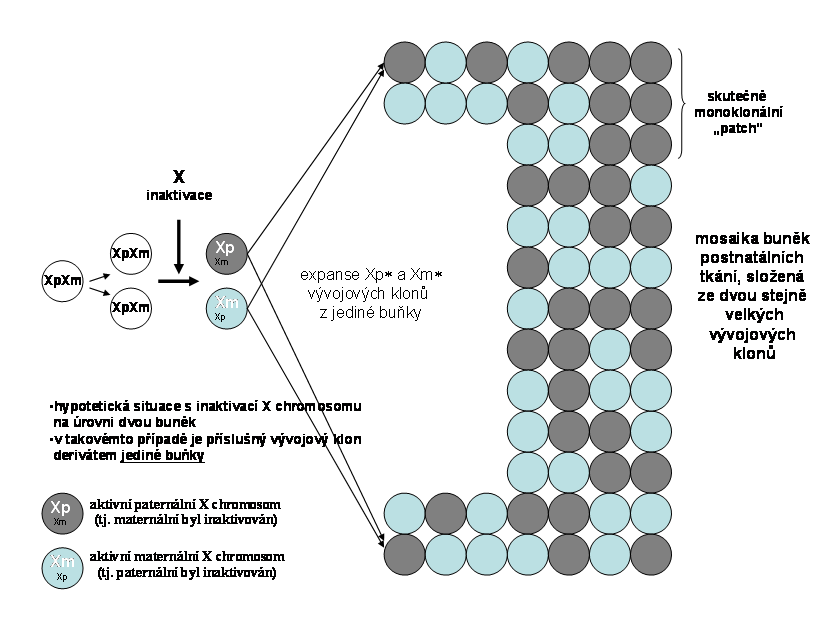
Obr. 8. X inaktivace, probíhající na úrovni většího počtu buněk (zde 28 buněk) v poměru 1:1; buňky v organismu nelze tedy podle typu X inaktivace přiřadit k jediné buňce (viz. předchozí schéma), ale k některé ze dvou skupin 14 embryonálních kmenových buněk podle inaktivace X chromosomu
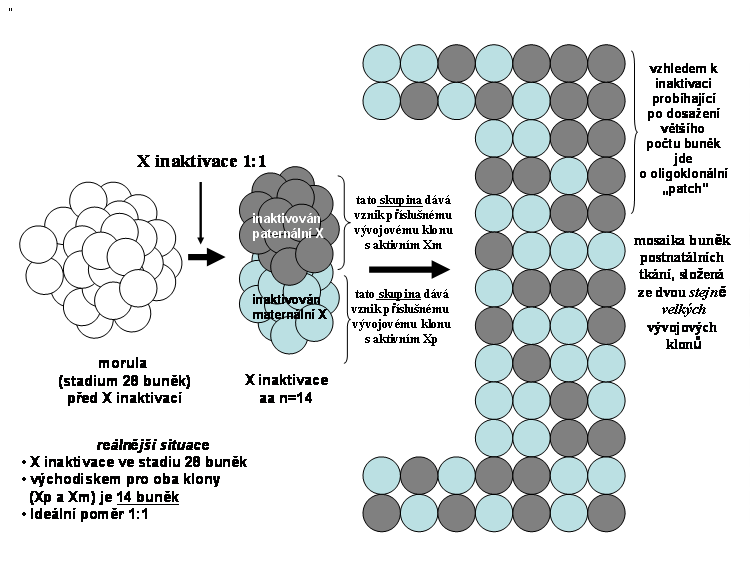
Obr. 9. Inaktivace X chromosomu na úrovni 28 buněk v poměru 5:2 ve prospěch inaktivace paternálního chromosomu. Jejich následný poměr se může, jak zmíněno shora, následně změnit zvýhodněním jednoho z klonů

Chimerismus. Experimentálně lze sledovat klonalitu použitím buněčných chimér, generovaných vstřiknutím a fusí allogenních kmenových embryonálních buněk, vykazujících specifitu sledovatelnou v jejich následných generacích, do blastocysty. Jde tedy o fusi dvou embryonálních subklonů v různém poměru. Nově se ukázalo, že organismus matky mohou kolonizovat kmenové buňky plodu, jako jeden z projevů možnosti transplacentární migrace buněk do mateřského organismu. Pak není překvapením, že v ženských tkáních (XX) mohou být identifikovány klony s mužských karyotypem (XY)
Mosaicismus je stav, kdy je část buněčné populace jednoho organismu mutována, takže jde o určitou podobnost s keramickou mosaikou. Jde buď o mosaicismus somatický, vzniklý mutací na některém stupni embryonálních kmenových buněk a propagující se v rámci příslušných částí postiženého vývojového klonu, nebo gonadální, postihující část zárodečných buněk. V obou případech jde o mutace v genomické DNA. Mutace v mitochondriální DNA, vznikající na úrovni embryonální se propagují nerovnoměrně se vznikem různého poměru mezi mutovanou a nemutovanou mtDNA - mosaicismus mitochondriální
Další termínyProgenitor - buňka s užším diferenciačním potenciálem než buňka kmenová a většinou již bez sebeobnovovací kapacity.
Prekursor (předchůdce) - spíše obecnější pojem. Jde o buňku stojící výše ve vývojovém řetězci.
Z čistě klonálního hlediska lze pohlížet na lidský organismus jako na unikátní vývojový klon odvozený ke subklonů derivovaných z embryonálních kmenových buněk nižší hierarchie (pluri- až multipotentních) které určovaly základní směry vývoje v embryonálním období. Po ukončení nitroděložního vývoje jsou terminální části vývojových klonů tvořících jednotlivé orgány, složené z cca. 200 buněčných typů, obnovovány pomocí složitého hierarchicky uspořádaného systému adultních kmenových buněk (AKB). Jde zejména o tkáně s vysokým stupněm obměny jejichž kmenové buňky mají vysoký klonogenní potenciál (klony trvalé, viz. shora). Jejich počet a stupeň poznání se neustále rozšiřují a upřesňují (viz. níže). Z dynamického hlediska je každá tkáň složena z klonálních jednotek (jejichž množství je dáno množstvím adultních kmenových buněk v dané tkáni), ve kterých probíhá neustále na různých úrovních mitotická aktivita a diferenciace minimálně v jedné buněčné linii. Tyto klonální systémy jsou zdrojem fysiologické obměny i regenerační aktivity příslušných tkání.
Lze tedy shrnout, že v diferencovaných adultních tkáních je možné rozlišovat dvojí klonální příslušnost: vývojovou (viz. níže), vztahující se retrospektivně("anamnesticky") k určitým embryonálním kmenovým buňkám (spojení je s nimi pochopitelně již neexistuje) a lokální, vztahující se k lokálním kmenovým buňkám adultním.
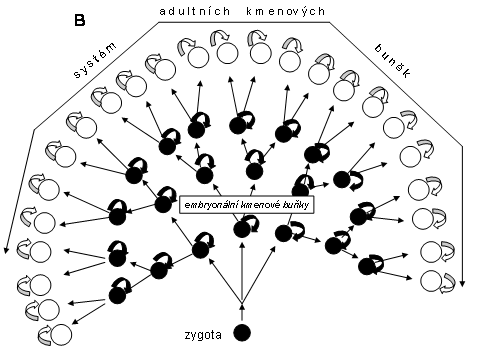
Vztah mezi vývojovou klonální příslušností a adultními kmenovými buňkami. Lze shrnout, že systémy adultních klonů (jejich adultní kmenové buňky) vznikají ze systému embryonálních kmenových buněk (obr.10, 11) - jsou jejich následníky. Embryonální kmenové buňky dominují před stadiem organogenese, kdy jsou nahrazovány adultními kmenovými buňkami. Retrospektivně lze říci, že adultní kmenové buňky (a tím celý klon z každé z nich vznikající) mají vývojový vztah k některé z nejčasnějších iniciálních totipotentních buněk časného embrya. V současnosti to lze určit pouze v ženském organismu podle X inaktivace paternálního nebo maternálního X chromosomu. Situace je znázorněna na následujících obrázcích (obr. 10,11).
U AKB nebyl nalezen žádný specifický fenotypový znak, lze je však definovat pomocí průkazu několika znaků současně. Kromě toho je pro řadu z nich typická resistence vůči anoikis (ztrátou adheze indukovaná apoptóza) a přítomnost membránových proteinů schopných pumpovat z cytoplasmy xenobiotika, což lze považovat za ochranu kmenových buněk před poškozením.
Obr. 10 A-C Zjednodušené schéma vztahu mezi embryonálními (černé kroužky) a adultními kmenovými buňkami (bílé kroužky). A průběžný stav embryonálního vývoje před vznikem kmenových buněk adultního typu (jejich budoucí přítomnost naznačují čárkované šipky); B demonstrace současné přítomnosti obou typů kmenových buněk: embryonálních, dávajících vznik adultním kmenovým buňkám; C postnatální stav, kdy jsou přítomny pouze adultní kmenové buňky a jejich permanentní klony
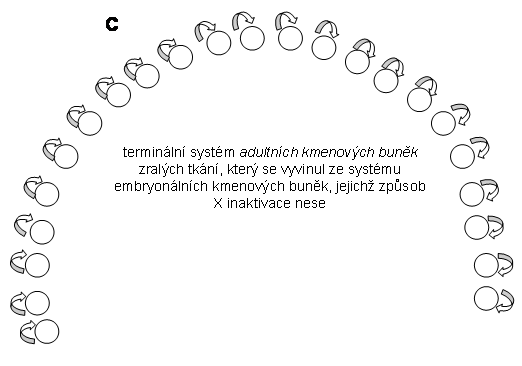
Obr. 11 A-B Vztah mezi vývojovým klonem a permanentním klonem adultním. Oproti shora uvedeným schématům jsou zde adultní tkáně presentovány jako permanentní adultní klony založené na adultních kmenových buňkách: A schematicky, B integrované do tkání; mezistadium pluripotentních embryonálních kmenových buněk je pro jednoduchost vynecháno
| A | B |
 |
 |
V následujícím textu jsou shrnuty současné základní poznatky o klonalitě lidských tkání za normálního stavu s větším důrazem na systémy lokálních adultních kmenových buněk.
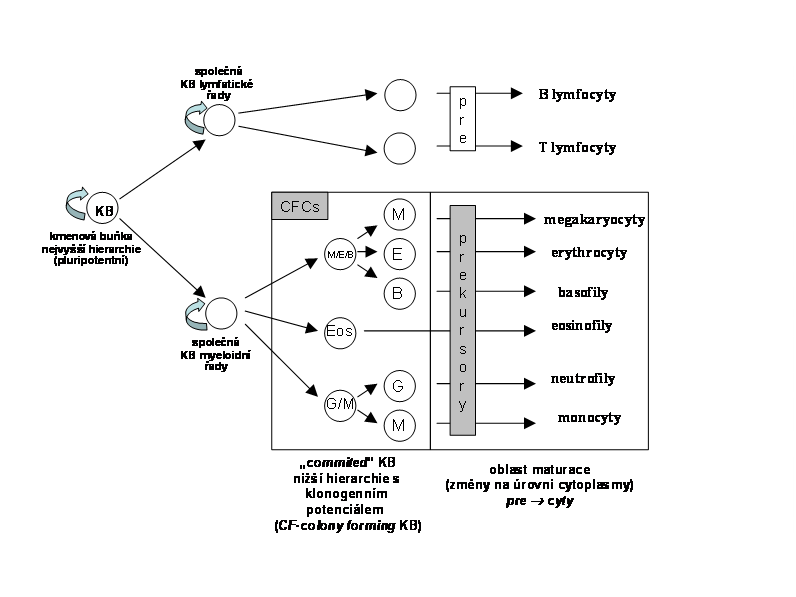
Hemopoetická dřeň kostní je složená ze systému vývojově polyklonálních adultních kmenových buněk. Podle matematické kalkulace procesu X inaktivace je celý lidský hemopoetický aparát derivátem šesti až devatenácti, nejpravděpodobněji deseti embryonálních kmenových buněk. Odhaduje se, že hematopoetické kmenové buňky tvoří jednu desetitisícinu buněk dřeně kostní. Jen část z celkového množství kmenových buněk udržuje v daném časovém intervalu normální hematopoesu dospělého člověka. Jejich množství se odhaduje řádově na stovky (cca. 400-100). Hematopoetické kmenové buňky jsou četné ve fetálních játrech. Určitá část cirkuluje po celý život v periferní krvi. Kompletní klonální jednotka založená na pluripotentní kmenové buňce zahrnuje jak linii lymfocytární tak linii dřeňových krevních buněk, je schematicky uvedena na obr.12. Na nižším stupni jsou intermediární progenitorové buňky s užším diferenciačním potenciálem, omezeným na určité linie (v případě hemopoetického klonu dřeně kostní jsou CFC - colony forming cells). Tyto progenitorové buňky jsou schopny výrazné mitotické expanse pod vlivem specifických růstových faktorů. Jejich životnost (selfreplikace) je však omezená.
Funkční kapacita hemopoetického klonu je zřejmě překvapivě velká. Z experimentálních studií vyplývá, že krvetvorbu u myši může po řadu měsíců udržovat jediná kmenová buňka. Běžnou hematopoesu údajně udržuje u myši okolo 60 kmenových buněk.
Obr. 12 Komplexní klon hemopoetické tkáně
Kmenové buňky dřeně kostní exprimují VEGF receptor typu 2 (VEGFR-2). Uznávaným markerem hematopoetických progenitorových buněk je molekula CD34 (fenotyp CD34+/CD38-). Část jejich populace je fixní, část cirkuluje krevním řečištěm. Jejich množství v krvi lze zvýšit podáním určitých cytokinů. Blíže je o hemopoetických kmenových buňkách pojednáno ve velmi obsáhlé literatuře.
Systém kmenových buněk v lymfatickém systému je podstatně méně prozkoumán
Lymfatický systém sdílí společnou KB s hematopoetickým systémem (KB o nejvyšší hierarchií). Tato KB o nejvyšší hierarchii je lokalisována ve dřeni kostní v subendostální oblasti. Dává vznik kmenové b. myeloidní a kmenové b. lymfatické. Vrcholná KB lymfatického systému dává vznik kmenovým buňkám T a B lymfatické řady (viz. obr.12). Jejich produktem jsou dřeňové pre B a pre T progenitory.
Prekursory B lymfocytů (pre-beta lymfocyty) podléhají selekci již ve dřeni kostní. Poté migrují do periferie jako naivní B lymfocyty do struktur periferního lymfatického systému (sleziny, lymfatických uzlin, MALT systému)
V případě T lymfocytárního systému putují dřeňové prekursory do cirkulace, kolonisují thymus, kde podstupují selekci, prostupují korou a dření thymu, odchází do oběhu jako naivní T lymfocyty a kolonisují periferní lymfatickou tkáň (lymfatické uzliny, slezinu, MALT). V této fázi (tedy po průchodu thymem) by se měli diferencovat na samostatné (nezávislé) linie (subtypy) cytotoxických, pomocných a regulačních lymfocytů. Tyto linie, které představují "commited cell lines", vznikají doposud ne zcela objasněným mechanismem z prekursorů, které nejsou rovněž zcela jednoznačně definovány, ale jejichž existence je uznávaná. V reakci na určitý antigen je složení výsledné populace T lymfocytů dáno klonální expansí antigen-specifických buněk, tak i etablováním paměťových buněk. Poměr mezi výše zmínenými "liniemi" je výslednící historie antigenních zásahů.
NK buňky, byť blízké cytotoxickým T lymfo mají odlišný původ, velmi pravděpodobně jako samostatná linie z kmenové buňky vyšší úrovně.Obnova buněk lymfocytárních systémů je dána příležitostním vstupem lymfocytů periferního systému do buněčného cyklu. V průběhu života dochází k pozvolnému doplňování z kmenových buněk kostní dřeně.
V tenkém a tlustém střevě jsou klonálními jednotkami střevní krypty. Progenitorem buněčné populace těchto strukturálních jednotek jsou kmenové buňky, lokalisované při basi krypt, dávající vznik všem buněčným typům v kryptě existujícím (Panethovy buňky, enterochromafinní buňky endokrinní, kolonocyty/enterocyty, pohárkové buňky). Kmenové buňky jsou v úzkém biologickém vztahu s mesenchymálními elementy v sousedství krypt. Systém kmenových buněk krypt GIT je vývojově polyklonální. Bylo to prokázáno jak typem X inaktivace, tak experimenty pomocí buněčných chimer. Životnost klonu patří k nejkratším v organismu. Obměna epitelu tenkého střeva trvá cca. 2-5 dní.
Žaludeční sliznice v oblasti fundu. Kmenové buňky jsou lokalizovány v oblasti krčku (isthmu) žlázek. Dceřiné deriváty putují jednak směrem k povrchu sliznice (hlenový epitel) jednak k basi žlázek (vznik hlavních, parietálních a endokrinních buněk). Existují doklady pro monoklonální charakter jednotlivých žlázových tubulů.
U myši bylo zjištěno, že podobně jako v střevních slizničních kryptách jsou zprvu žaludeční žlázky polyklonální (z více adultních lokálních kmenových buněk), později postnatálně převážně monoklonální.
Jaterní tkáň má klonální základ v tzv. "oválných" kmenových buňkách, situovaných na periferii lalůčku, ze kterých se odvozují jak struktury jaterního lalůčku (hepatocyty), tak struktury periferních žlučových cest. Obměna jaterního lalůčku trvá cca. 1 rok. Zvláštnost klonů jaterních je v tom, že za numerickou expansi (hyperplasii) klonu jsou zodpovědné zejména dceřinné intermediární populace (v jaterním lalůčku tedy zralé hepatocyty), jejichž mitotická aktivita kompensuje většinu ztrát. Pouze za stavů rozsáhlých nekros jsou masivně aktivovány periferní kmenové buňky (tzv. oválné buňky), dávající vznik strukturám, sdružujícím rysy jak hepatocytů, tak malých žlučovodů (tzv. pakanálky). Existuje řada dokladů, podle kterých jsou cirkulující kmenové buňky dřeně kostní (viz. shora) poslední možností regeneračního zdroje při těžkých jaterních destruktivních procesech.
Velikost vývojového klonálního okrsku jaterní tkáně není známa. Nepřímo lze na něj usuzovat z přítomnosti dispersních okrsků postižených hepatocytů při X vázaných enzymopatiích, např. močovinného cyklu (deficit OTC)
V prostatě jsou základem epiteliálních klonů basální kmenové buňky, známé vysokou expresí tzv. vysokomolekulárního cytokeratinu. Tyto dávají vznik linii žlázového epitelu a linii neuroendokrinních buněk. Okrsky vývojových klonů studované pomocí buněčných chimér u myši ukázaly, že naprostá většina vznikajících duktálních jednotek je vývojově monoklonální.
Výstelka orgánů močového a pohlavního systému. Existuje předpoklad, že celá lidská sliznice močového měchýře je tvořena mosaikou 200 - 300 okrsků, náležejících příslušné epiteliální adultní kmenové buňce lokalisované v basální vrstvě. Tento systém kmenových adultních buněk je vývojově polyklonální. Vývojový klonální okrsek má, podle X inaktivace velikost okolo 1 cm2 (komplex 2x106 buněk). Podobně veliké okrsky v močovém měchýři byly zjištěny u chimerické myši.
Studium buněčných myších chimér zaměřené na vývojovou klonalitu urogenitálních orgánů ukázaly, že vaginální epitel je mosaika, podobně povrchový epitel děložní sliznice, zatímco žlázky endometria byly vždy monoklonální. Vývody nadvarlete a ostrůvky sliznice semenných váčků byly mono- i polyklonální.
V epidermis (a sliznici kryté dlaždicobuněčným epitelem) jsou základem klonální struktury kmenové buňky o rozdílném stupni hierarchie v basální vrstvě epidermis, produkující buňky intermediární zóny spinosní a jejich keratinisované deriváty (v případě rohovějícího epitelu kůže). Řada pozorování svědčí pro to, že jejich distribuce v basální vrstvě je ložisková a rozdílná v různých oblastech kůže. Každá kmenová buňka a tvoří se svými deriváty jednotku zvanou EPU (Epidermal Proliferafion Unit). Kmenové buňky tvoří mezi 10 - 40% buněk basální vrstvy. Předpokládá se, že mají vyšší obsah α2β1 a α3β1 integrinů. Obměna epitelu epidermis se odhaduje na cca. 12-30 dní. Kmenové buňky v basální vrstvě představují dispersní populaci, jejíž četnost není přesně známa. Deriváty těchto basálních kmenových buněk se pohybují horizontálně a následně pak vertikálně, jak je tomu u všech povrchových epitelů. Suprabasální populace keratinocytů mají mírně diferencovaný fenotyp a odpovídají obecné zoně "transient amplifying cells" klonů.
Kmenovou buňkou ve vlasovém folikulu jsou keratinocyty zevní epitelové pochvy. U myši i u člověka jsou lokalizovány v hrbolkovitém ztluštění epitelu v oblasti spojení pilosebaceosní jednotky (stejná výše jako připojení musculi arrectores pillorum; angl. bulge region). Podle některých pozorování jsou kmenové buňky vlasového foliklu hierarchicky nadřazené kmenovým buňkám epidermálním a mohou být jejich zdrojem.
Vlasový folikul se nevýrazně liší od ostatních tkání regeneračním cyklem. Zatímco ostatní tkáně regenerují kontinuálně, vlasový aparát podléhá zhruba 8-10 kompletní regeneraci.Fáze: katagen (zánik programovanou buněčnou smrtí), následovaná klidovou fází (telogen - tráýní 1-4m) a fází růstu nového vlasu s vytlačováním vlasu předchozí fáze (anagen - doba trvání 2-6 let).
Buňky mazových žlázek jsou pod separátní kontrolou vývoje z kmenových buněk "hrbolku" (bulge region)
Pokud jde o další buňky lokalisované v epidermis, Langerhansovy buňky jsou původu hematogenního; melanocyty jsou původem z neurální lišty, ale jsou doklady i pro jejich původ z nedávno popsané separátní pluripotentní kmenové buňky vlasového foliklu pocházející z neurální lišty, ze které velmi pravděpodobně vznikají i buňky Merkelovy.
Podle matematických analýz je kůže derivátem okolo 15 embryonálních kmenových buněk. Předpokládají se monoklonální vývojové okrsky (podle X inaktivace) v rozsahu 20-350 basálních keratinocytů. Tzv. Blaschkovy linie představují pásovitě uspořádané klony epidermálních melanocytů
Epitel rohovky. Kmenové buňky rohovkového epitelu jsou lokalisovány v oblasti limbu. Jejich deriváty se posunují směrem ke středu rohovky, kde dávají vznik povrchním epitelovým vrstvám. Transplantát centrální části rohovky je tedy postupně nahrazen novými generacemi epitelu z limbálních kmenových buněk.
V případě geneticky podmíněných defektů rohovkového epitelu spojených se zákalem rohovky řeší tedy transplantát rohovky situaci pouze dočasně - do doby, kdy epitel donora nahradí původní geneticky defektní epitel příjemce.
Lalůček mléčné žlázy představuje podle dosavadních studií komplexní klon s několika relativně samostatnými klonogenními etážemi. Experimentální studie nasvědčují existenci vrcholné kmenové buňky, která, je-li transplantována, může dát vznik celému lalůčku. Zároveň bylo prokázáno, že lobuly i vývody mají odlišné progenitory. X inaktivační studie prokázaly uniformitu inaktivace maternálního nebo paternálního X chromosomu v jednotlivých lobulech.
V děložní sliznici jsou lokalisovány kmenové buňky na basi žlazek. Je pozoruhodné, že podle X inaktivačních studií jsou monoklonálního vývojového původu.
Slinivka břišní. Existuje řada dokladů pro existenci kmenových buněk v oblasti tubulů (dle některých autorů i acinů), z nichž se derivuje jak acinární, tak tubulární část exokrinního parenchymu. Experimenty na krysách prokázaly, že tyto kmenové buňky jsou pluripotentní a mají schopnost se diferencovat i v buňky jaterní. Přisuzuje se jim i vznik endokrinního aparátu pankreatu (isolovaných a ostrůvkových endokrinních buněk).
Endokrinní beta buňky jsou mitoticky velmi málo aktivní v dospělém organismu, takže i jejich regenerační aktivita je velmi omezená. Dnes již existuje řada pozorování nasvědčujících, že regenerační základnou Langerhansových ostrůvků jsou zmíněné tubulární kmenové buňky. Množí se však i studie dokládající mesenchymální povahu kmenových buněk pankreatu.
Otázka kmenových buněk v plicích není doposud jednoznačně rozřešena. V bronchiálním stromu a průdušnici jsou lokalizovány v basální vrstvě respiračního epitelu. Předpokládá se, že jsou prekursorem jak epiteliálních buněk bronchiální sliznice (pohárkových buněk, řasinkového epitelu), tak buněk neuroendokrinních. V bronchiolech představují kmenové buňky pravděpodobně buňky Clarovy, v alveolech jsou za kmenové buňky považovány pneumonocyty II typu (pneumonocyty typu I jsou terminální postmitotické elementy).
Ledviny. Otázka přítomnosti kmenových buněk adultního typu v ledvinách byla po dlouhou dobu zcela nejasná. Z nejrůznějších experimentů založených na destrukci proximálních stočených kanálků vyplývalo, že regenerační zónou v této oblasti nefronu se zdá být segment S3, přestože je z celého proximálního tubulu nejcitlivější na ischémii. V nedávné době byla prokázána regenerace tubulárního epitelu ze stromálních buněk a to přímo nebo nepřímo, cestou mesenchymální kmenové buňky dřeně kostní.
O velikosti vývojových klonů v lidské ledvině nejsou rovněž k disposici žádné údaje. U chimérické myši byla zjištěna polyklonalita jak epitelu Bowmanova váčku epitelu, tak v průběhu nefronu, stejně tak v systému sběracích kanálků. Studie však byla provedena v řezech, takže chybí informace o jednotlivých nefronech v jejich průběhu. Velikost vývojových klonů by přispěla k lepšímu chápání patologie některých geneticky podmíněných X vázaných nefropatií, např. u Fabryho nemoci.
Kmenové buňky v jiných než epitelových tkáních
Mesenchymové kmenové buňky. Existuje řada pozorování svědčících pro přítomnost mesenchymových KB adultního typu. Prozatím největší množství informací existuje o těchto buňkách isolovaných z kostní dřeně, ale byly isolovány i z vaziva mimo dřeň kostní, z tukové tkáně a z řady dalších tkání. Též z periferní krve. Tyto buňky představují zvláštní populaci nediferencovaných pluripotentních buněk, které v tkáňové kultuře, oproštěny od vlivu hemopoetické tkáně a za určité stimulace, dávají vznik liniím chondrocytů, osteoblastů, adipocytů a fibroblastů. Transplantovány do jiných orgánů jevily pozoruhodnou pluripotenci. Vztah k hemopoetickým kmenovým buňkám se předpokládá jen ve smyslu společného prekursora a vzájemného ovlivňování. Podle některých pozorování osidlují cirkulující mesenchymové kmenové buňky různé orgány a účastní se regenerace a fibroplastických procesů.
Pokud jde a hladké svalové buňky nejsou k disposici údaje o jejich případných adultních kmenových buňkách. Autoři popisující varianty hladkých svalových buněk typu "pacemakerů" svaloviny střevní předpokládají, že mají společný prekursor se standardními buňkami hladkého svalu v "mesenchymální kmenové buňce".
V případě melanocytů existují dvě teorie. Podle Cramera jsou kmenové buňky melanocytů lokalizovány v perineuriu kožních nervů v jejich terminální subepidermální části. Podle jiných jsou kmenové buňky melanocytů (u myší) lokalizovány ve vlasových folikulech.
Endotelové buňky. Výzkum posledních let potvrzuje existenci cirkulujících endotelových prekursorů, původu z dřeně kostní, které zřejmě významným způsobem přispívají k regeneraci endoteliálních defektů cévní stěny. Experimentálně bylo prokázáno, že u zvířat jimž byla voperována cévní protéza došlo k její endotelisaci buňkami transplantátu dřeně kostní. Problematika cirkulujících dřeňových endoteliálních prekursorů je předmětem intensivního výzkumu. Předpokládá se společný prekursor s hematopoetickou kmenovou buňkou, který by přetrvával z embryonálního období (společný prekursor hemangioblast) i postnatálně a který by zároveň vysvětlil i sdílení společných molekul CD34.
Existují pozorování, nasvědčující, že endotelové buňky patří do klonálního repertoáru nádorového klonu u chronické myeloidní leukemie podle přítomnosti Ph chromosomu. Rovněž existují důkazy pro kolonisaci endotelu akceptora buňkami donora u allogenní transplantace dřeně kostní.
Fibroblasty. Nové pohledy naznačují, že populace fibroblastů je značně heterogenní. Dokonce i v tak definované populaci jako jsou dermální fibroblasty lze nalézt významné rozdíly podle místa výskytu. To poněkud ztěžuje jednoznačné závěry o povaze jejich kmenové buňky. Podle posledních názorů je jí jednak mesenchymální kmenová buňka ať ve dřeni kostní (resp. tato buňka po přechodu do cirkulace) nebo v jiné lokalisaci (viz. níže). Byl prokázán i vznik fibroblastů přeměnou z epitelu (epithelial mesenchymal transition). V části hlavové oblasti jsou fibroblasty odvozeny z buněk neurální lišty.
Kmenové buňky v nervovém systému. V CNS jsou studovány kmenové buňky, isolované z fetálních mozků, a jejich schopnost víceliniové diferenciace jak v podmínkách tkáňové kultury tak po allo- nebo dokonce xenogenní transplantaci do různých oblastí mozku. Ukazuje se, že lokální faktory mohou zásadním způsobem ovlivnit jejich diferenciaci a místní zapojení těchto buněk. Úspěšnost doposud uskutečněných studií otevírá obrovské možnosti transplantační buněčné terapie neurodegenerativních onemocnění (viz. literární odkazy).
Populace neuronů zralé mozkové tkáně je tradičně považována za typický příklad postmitotické tkáně. I když toto platí nepochybně o diferencované neuronální síti, existují nezvratné důkazy o přítomnosti typických kmenových adultních buněk v savčím mozku. Ty byly prokázány v adultním lidském i v krysím mozku v subependymální oblasti, v hippokampu a ve striatu. Vykazovaly schopnost diferenciace gliové a neuronální v tkáňové kultuře a po reimplantaci zpět do mozkové tkáně. Ependymální buňky jsou některými autory považovány za kmenové neurální buňky (viz. doporučená literatura). Podle střízlivých odhadů v myším a krysím mozku vzniká každodenně jeden nový neuron na 2000 neuronů existujících.
Analysa vývojových klonů (podle X inaktivace) mozkové kůry myši pomocí buněčných chimer ukázala existenci radiálně upořádaných proužků, v nichž dominuje jeden klon neuronů a glie. Klonalita mozečkových Purkyňových buněk, studovaná X inaktivací u myši s deficitem G6PDH ukázala silnou promíšenost neuronů s maternální a paternální X inaktivací.
Pokud jde o srdeční sval, neexistují žádné přesvědčivé údaje o existenci kmenových buněk adultního typu, i když existují určité náznaky jejich přítomnosti v myokardu laboratorních zvířat. O existenci případných vývojových klonálních okrsků není známo nic podstatného.
Na tzv. reservní buňky v kosterním svalu je nutno pohlížet spíše jako na zásobní reaktivní klony s omezenou životností. Existují však pozorování svědčící pro jejich selfreplikační schopnost.
Závěrečná poznámka. Přehledné referáty o biologii kmenových buněk se shodují v tom, že vedle vlastních kmenových buněk v každém orgánu je, zejména u reparativních a regenerativních procesů, možné počítat s účastí kmenových buněk dřeně kostní (mesenchymálních i hemopoetických) jako poslední regenerační reservou (viz. též níže)
Současné přístupy k poznání klonality procesu či klonality určitého buněčného procesu jsou poměrně omezené.
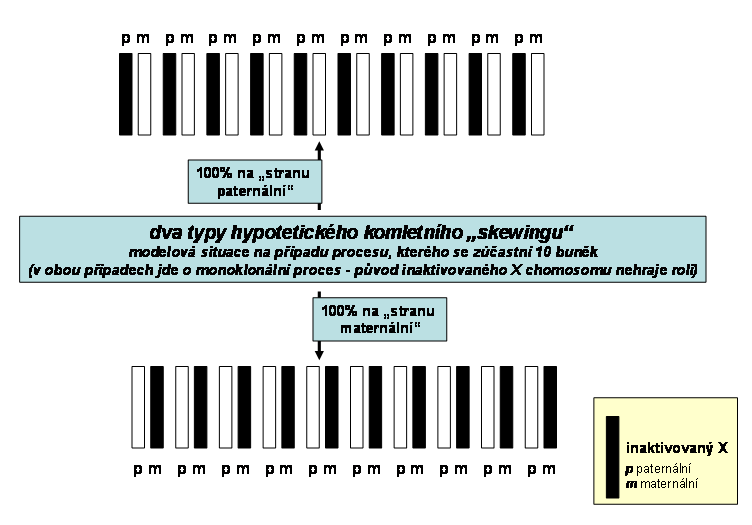
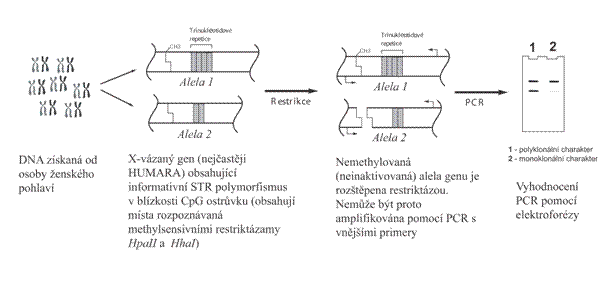
Nejčastějším přístupem je stále průkaz stupně inaktivace X chromosomu - tedy příslušnost k jednomu ze dvou ranných vývojových klonů. Za stejnou klonální příslušnost se považuje inaktivace stejného typu X chromosomu, ať paternálního nebo maternálního (obr. 13). Je zřejmé, že tento přístup je možný pouze v ženském organismu. Nejpoužívanějším přístupem se stalo vyšetření metylace CpG ostrůvků na X chromosomu v jejichž blízkosti se nachází vysoce informativní polymorfismus, pomocí kterého je možné odlišit oba chromozomy. CpG ostrůvky jsou na aktivním X až na výjimky nemetylované, heterochromatin neaktivního X je vysoce metylovaný. V současnosti je nejčastěji využíván délkový (STR) polymorfismus v promotorové oblasti genu pro androgenový receptor (HUMARA - human androgen receptor). Míra metylace DNA se obvykle zjišťuje pomocí restrikčních enzymů citlivých na metylaci. (obr.14). Kompletní metylace jednoho z chromozomů svědčí pro to, že ve vyšetřovaném vzorku jsou přítomny buňky patřící do jednoho klonu.
Obr. 13 schéma dvou extremních forem inaktivace X chromosomu
Obr. 14 průkaz inaktivace X chromosomu
Teoreticky lze využít i detekci virových insertů v dceřinných populacích infikovaných buněk. Jako marker je však nutno brát místo inserce viru, ne pouhou přítomnost viru. Dále přítomnost somatické mutace, strukturní chromosomální aberace nebo nejrůznějších alelických polymorfních markerů v heterozygotním nebo homozygotním stavu.
Určování klonality pomocí klonálních produktů: typu lehkých řetězců Ig (kappa nebo lambda) pro posouzení klonality lymfoproliferativního procesu s cílem zjistit zda se jedná o reaktivní (polyklonální) nebo nádorový (monoklonální) proces. Přítomnost obou řetězců svědčí pro polyklonalitu, přítomnost jednoho pro monoklonalitu, neboť každá imunokompetentní B buňka produkuje jeden typ imunoglobulinu.
In vivo přístupy jsou silně omezené. Jde pouze o sledování vznikajících populací jediné buňky přenesené do tkáňové kultury. Experiment využívající techniku vytvoření tkáňové chimery a sledování distribuce klonu derivovaného z implantované pokusné embryonální kmenové buňky v hostitelském organismu. Podmínkou je označení pokusné embryonální buňky vhodným sledovatelným markerem.
Význam znalosti klonů
Význam teoretický
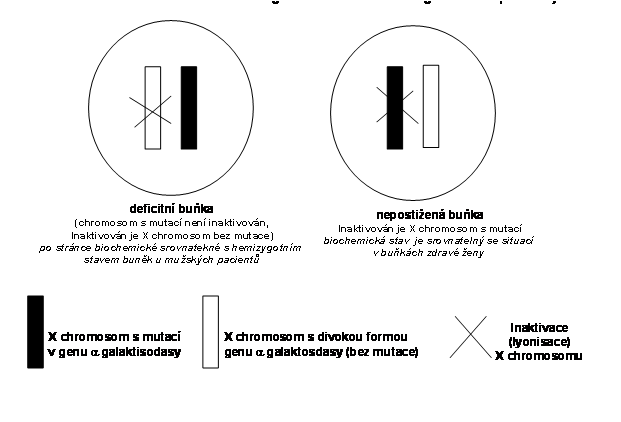
Znalost klonů umožnila lépe poznat podstatu řady biologických procesů, včetně nádorové transformace buňky (viz. oddíl nádory). U X vázaných genetických poruch má velký význam znalost embryonálně založené X vázané klonality pro pochopení interindividuální variability klinického obrazu u tzv. nosiček. U takto postižených žen postihuje mutace ve většině případů maternální X chromosom (proto jsou ženy přenašečky). Paternální homolog je postižen vzácně (v takových případech je otec buď manifestní hemizygot nebo je nepostižen somaticky, ale má mutaci v zárodečných buňkách varlete, takže část populace spermii je nositelem mutace. V takových případech je matka zdráva. Protože jeden z X chromosomů je zákonitě inaktivován a proces inaktivace je náhodný, může být část mutantních X chromosomů (ať maternálních nebo paternálních) v různé míře inaktivována. Tím může být v určité sadě buněk funkční pouze normální chromosom X, pokud je inaktivován X chromosom nesoucí mutovaný gen zatímco v sadě buněk, kde je inaktivován X chromosom nesoucí normální gen je aktivní mutantní chromosom X (obr. 15). To má za následek, že ženský organismus, postižený X vázanou poruchou je mosaikou složenou z buněk biochemicky normálních (inaktivace mutovaného X chromosomu) a deficitních (inaktivace nepostiženého X chromosomu). Ženský organismus je tak možné biochemicky přirovnat k mosaikovitému hemizygotovi. Klinická manifestace je tím ovlivněn tak, že podle procesu inaktivace X chromosomu je žena buď postižena minimální (subklinicky) nebo maximálně (jako muž - hemizygot). Ve hře je pravděpodobně ještě několik dalších faktorů, např. zvýhodnění biochemicky deficitní nebo normální buňky a jejich kvantitativní nárůst. I tak (v případě X vázaných lysosomálních enzymopatie) existují významné rozdíly ve stupni postižení např. mezi mukopolysacharidosou typu II (nemoc Hunterové) a Fabryho nemocí. V prvém případě je manifestace u postižených žen minimální a vzácná, oproti Fabryho nemoci, kde je manifestní postižení velmi časté.
Obr. 15. schéma situace u X vázané genetické poruchy v ženském organismu
Dále je to skutečnost, že jakákoliv změna, postihující kmenovou buňku, ať už příznivá (např. důsledek genové terapie) nebo nepříznivá (onkogenní mutace) je dlouhodobě fixována po dobu její životnosti, která je teoreticky trvalá. Je to dáno tím, že se kmenové buňky udržují systémem asymetrických mitos (viz. shora). Obráceně řečeno, změny postihující pouze dceřiné populace v klonu nemají možnost se v klonu zafixovat a jejich trvání je shodné s trváním života těchto buněk.
Na velmi reálnou možnost existence klonality je nutno pamatovat v pokusech prováděných s tkáňovými kulturami. Jde o nebezpečí přerůstání jednoho klonu buněk, který není representativní - neodráží charakter in vivo přítomné buněčné populace (například v tkáňové kultuře u prenatální diagnosy X-vázaných poruch)
Praktický dopad znalostí klonality
Sem patří výroba monoklonálních protilátek, využívající skutečnosti, že každá imunokompetentní B buňka má schopnost vytvářet protilátku jednoho typu (proti jedinému epitopu sledovaného antigenu, kterým byla imunisována). Podstatou technologie výroby je isolace jedné kompetentní B buňky (plasmocytu) po imunisaci celého organismu experimentálního zvířete (nejčastěji myši) a její fusí s buňkou plasmocytomu, jehož vlastní synthesa imunoglobulinu byla potlačena. Tímto je zaručena klonální (monoklonální) expanse jediné fusní buňky, jejíž expansi zajišťuje nádorový charakter plasmocytomu a typ protilátky zamířené pro jedinému epitopu stimulovaný plasmocyt experimentálního zvířete. Polyklonální protilátky se liší tím, že jde o směs monoklonálních protilátek, produkovaných všemi imunokompetentními buňkami celého organismu po jeho vystavení studovanému antigenu. Protilátky produkuje celá množina B buněk, které se mohou významně lišit tím, že byly stimulovány odlišnou částí (epitopem) antigenu.
Transplantace v nejobecnějším slova smyslu je přenos orgánu/tkáně nejčastěji mezi jedinci stejného druhu (allogenní). Řečeno zjednodušeně, jde o přenos intaktního integrovaného systému klonů tvořícího kompaktní transplantovaný orgán (játra, dřeň kostní, pankreas, plíce).
Klasická transplantace dřeně kostní, je příkladem přenosu přirozených suspensí klonogenních hematopoetických kmenových buněk do jejich přirozeného prostředí - lze očekávat, že v transplantátu jsou kmenové buňky nejrůznější hierarchie a že se do příjemce dostávají mimo standardní série krevních buněk i progenitory krevních endotelií (viz. shora) a obou lymfatických řad. Příměs progenitorů lymfatických řad hraje roli v reakci štěpu proti hostiteli (GVHD - graft versus host disease, též GVHR - graft versus host reaction).
Hlavní roli v bezprostřední akutní reakci hrají existující zralé T lymfocyty, přenesené v transplantátu (štěpu), které mají omezenou životnost. Pak roli přebírají nově vytvořené klony T lymfocytů vytvořené z kmenových buněk transplantátu. K vzniku těžké GVHD nemusí být přítomna žádná významnější neshoda v základních znacích HLA. S výjimkou jednovaječných dvojčat určitá forma GVDH vzniká prakticky vždy.
Analogii klasické transplantace dřeně kostní se stává transplantace suspensí buněk solidního orgánu, konkrétně jater, zaváděná jako dočasné řešení jaterních selhání a představující překlenutí kritického období do dostupnosti klasického orgánového transplantátu. Suspense hepatocytů se aplikují do portální žíly, čímž je zajištěna kolonisace přirozeného prostředí jaterní tkáně. Životnost transplantátu je zajištěna poměrně dlouhou životností diferencovaných hepatocytů, ale bude ovlivněna i stupněm jejich integrace a v neposlední řadě i stupněm příměsi jaterních kmenových buněk v podané suspensi.
Obrovské pole představuje využití embryonálních kmenových buněk pro vytváření náhradních orgánů. Zde je využíván obrovský diferenciační potenciál těchto buněk, který je usměrňován specifickými diferenciačními molekulami. Jde v podstatě o vytváření modifikovaných (řízených) subklonů vývojového typu, vycházející z isolovaných multipotentních EKB pocházejících z vnitřní buněčné masy moruly (viz. obr. 6)
Klonování celého organismu lze prakticky zajistit přenosem buněčného jádra somatické (diferencované) buňky do neoplozeného vajíčka , jehož jádro bylo před tím odstraněné či inaktivované. V tomto jádru musí nastat zrušení dosavadního jaderného diferenciačního procesu a k reprogramování celého biologického vývojového programu, který byl "narušen" procesem diferenciace na jednu ze 200 typů somatických buněk. Tím se z této uměle vytvořené zygoty stane ekvivalent zygoty donora jádra a tento donor "se znovu narodí" jako své jednovaječné dvojče. Pro tento proces je nezbytná dokonalá souhra implantovaného jádra s cytoplasmou vajíčka. Řada studii ukazuje, že efektivnější je přenos jádra z buňky kmenového typu (adultní kmenová buňka).
Lze si teoreticky představit, že pokud by se podařilo indukovat v oplodněném vajíčku (zygotě) asymetrickou mitosu, došlo by k prakticky neregulované (nebo regulovatelné) produkci identických jedinců.
Reaktivní klony nejsou obnovovány činností kmenových buněk oproti klonům trvalým.
Nejnázornějším příkladem fysiologického reaktivního klonu je reaktivní klonální expanse B a T lymfocytů imunitního systému, a následné vytváření specifických imunoglobulinových molekul (protilátek) nebo jiných efektorových molekul. Tyto buňky existují jako zdánlivě homogenní populace v počtu řádově desítek milionů, každá z nich pocházející z buněk, ve kterých došlo ke genovému přeskupení zajišťujícímu jedinečnou specificitu vazebných míst svého membránového povrchového receptoru. Po styku buňky s konformačně nejlépe odpovídajícím antigenem (nebo antigenním fragmentem) dojde za spolupráce s dalšími buňkami imunitního systému ke klonální expansi, která zajišťuje adekvátní funkční odezvu jak po kvantitativní (velikost klonu, secernovaný produkt) tak i po kvalitativní stránce. Antigen si "vybírá" z buněčného repertoáru ty buňky, jejichž membránové receptory jeví nejvyšší vazebnou aviditu. Každá imunokompetentní buňka je schopna na svých membránových receptorech (nekovalentně) vázat takové epitopy daného antigenu, které mají dostatečnou vazebnou afinitu, reaguje na jediný epitop daného antigenu produkcí jediného isotypu Ig: jeden typ lehkého řetězce, jeden typ těžkého řetězce (změna molekulárního složení může nastat ve smyslu přesmyku těžkého řetězce: např. isotypu M na isotyp G).
Membránové receptory imunokompetentní buňky jsou schopny (nekovalentně) interagovat s takovými epitopy daného antigenu, které mají dostatečnou vazebnou afinitu. Vazbě antigenního determinantu s receptorem se rovněž říka "epitop-paratopová" interakce (paratop je vazebné místo imunoglobulinové molekuly). Tato interakce tvoří prvotní signál v složité posloupnosti buněčných pochodů, s výsledkem (v případě B buněk) produkce imunoglobulinu jediné specificity. Tato specificita je definovaná sekvencí aminokyselin ve variabilní části lehkého a těžkého řetězce. V buňce produkující imunoglobulin isotypu M, může dojít k tzv. isotypovému přesmyku na isotyp G, přičemž genetická informace kodující variabilní část lehkého a těžkého řetězce (a tedy vazebného místa) zůstává nadále zachována, ale genetický úsek kodující konstantní část těžkého řetězce je nahrazen konstantní části charakteristickou pro isotyp G. Tato změna je ireversibilní.
Reakce buňky i celého klonu zaměřeného na jeden epitop je tedy zákonitě monoklonální, přičemž ale platí, že určitý epitop je schopný reagovat s buňkami v určitém rozmezí receptorových afinit, takže imunitní odpověď - i na jeden epitop - z hlediska celé buněčné populace může být polyklonální nebo alespoň oligoklonální (jinými slovy tyto vztahy nejsou zrcadlově symetrické). Vzhledem k tomu, že antigenní molekuly jsou vysokomolekulární a složené z velkého počtu epitopů, reakce imunitního systému je zákonitě polyklonální.
B lymfocyt po obdržení antigenního signálu skrze epitop-paratopovou interakci, a po dalších buněčných i molekulárních signálech klonálně expanduje a vytváří klon imunocytů (stadia blastocytů a plasmocytů), tedy výsledně B lymfocytů modulovaných do sekrece imunoglobulinových molekul. Velikost klonu je málokdy menší než 1000 jedinců, přičemž tvorba imunoglobulinů dosahuje 2000 Ig molekul za sekundu (pro buňku). V průběhu klonální expanse dochází k afinitnímu zrání, které je založeno na selektivní proliferační výhodě těch buněk, které náhodnými mutacemi obdržely vazebné místo o větší afinitě než měl počáteční klon. Tento proces příspívá ke klonální heterogenitě.
Vytvoření prvotního reaktivního klonu (a secernovaného imunoglobulinu) je nazýváno "primární protilátková odpověď", přičemž následné stimulaci (např. v souvislostí nové infekce) se říká "sekundární protilátková odpověď". Afinitní zrání probíhá i v průběhu primární i sekundární odpovědi, přičemž dlouhodobá stimulace často konsoliduje (snižuje) již existující klonální heterogenitu, a to nedostatečnou proliferační kapacitou těch méně afinitních jedinců. V období mezi primární a sekundární protilátkové odpovědi docházi k etablováni paměťových buněk, které vznikají poté co reaktivní klon zaniká. K zániku klonu docházi "vyčerpáním" klonálních buněk, apoptosou a vytvářením paměťových buněk, které již nejsou definovány jako členy prvotního klonu. Řádově odpovídá zastoupení paměťových buněk zhruba desetinásobku původně stimulovaných buněk, ale je jen zlomkem velikosti klonu v jeho zenitu.
Rozdílnost lymfatických klonů od klonů konstitucionálních je tedy zjevná. Zatímco u konstitucionálních klonů jde o stereotypní program regenerace určitého tkáňového systému (viz. shora) u lymfatických klonů lze považovat každý klon za specifickou - individuální reakci T nebo B systému na určitý antigen.
Životnost klonu je omezená a po zvládnutí přítomného antigenu se klon redukuje programovaným zánikem buněk, přičemž buňky, které apoptozou nebyly eliminované přecházejí do stadia paměťových buněk, jejíž životnost je omezená, a je podmíněna persistující přítomnosti příslušného epitopu obvykle deponovaného ve FDC (folikulárních dendritických buňkách). Paměťové buňky existují jak na úrovni B buněk tak na úrovni T buněk. Trvanlivost vakcinace je pravděpodobně v největší míře závislá na trvanlivosti antigenu v depotním systému FDC.
Klonální charakter reaktivního typu se předpokládá u různých patologických proliferativních stavů. Predisposice buněk k reaktivní klonální expansi může být dána somatickou mutací v systému regulujícím proliferaci. Velmi aktuální je tato otázka v současnosti v patologii cévní stěny. Názorným příkladem klonálního dysregulovaného proliferativního procesu jsou některé arteriální restenosy, vzniklé po angioplastikách. Jejich mechanismus je vykládán jako následek somatické mutace v genu receptoru typu II pro TGFβ1 v buňkách atherosklerotických plátů (pravděpodobně zejména myofibroblastů). Důsledkem je snížená citlivost na tento cytokin, který je významným antiproliferačním faktorem a je považován za klíčový faktor v regulaci hojení ran (proliferace a migrace cévních buněk a proliferace myofibroblastů atherosklerotických plátů). Předpokládá se, že mutace buněk atherosklerotického plátu mohou být způsobeny exogenními faktory nebo volnými radikály.
Dočasný charakter vývojového klonu lidského organismu, daný jeho přeměnou na systém adultních kmenových buněk, jehož patologie je probírána v samostatné části (4.3) předurčuje charakter jeho poruch. Na rozdíl od reaktivních a permanentních klonů postnatálních je patologie vývojových klonů omezena převážně na malformace a na geneticky podmíněné metabolické poruchy.
Mutace jaderné DNA.
Vznikne-li somatická mutace v průběhu embryonálního vývoje v některé embryonálních kmenových buněk a je-li kompatibilní s životností buňky, propaguje se její následek v celém příslušném následném vývojovém klonu. Extremním případem je zárodečná mutace s postižením celého organismálního klonu a s tím kontrastující mutace vzniklé v některé z embryonálních kmenových buněk pokročilého stadia vývoje. Výsledkem této druhé varianty je postnatální postižení komplexu tkání příslušných do jejího klonu.
U X vázaných poruch (mutace v genu na X chromosomu) se v důsledku lyonisace vytváří v ženském organismu dva vývojové klony, derivované z embryonálních kmenových buněk ve kterých dochází ve fázi blastuly k trvalé inaktivaci jednoho z X chromosomů. V jednom z klonů je inaktivován X chromosom mutantní, ve druhém X chromosom normální. Zákonitosti určující jejich rozsah nejsou známy - jde o faktory určující hodnotu "skewingu" ("zešikmení" - odchylky od poměru 1:1) a proliferační zvýhodnění buněk jednoho z klonů. Ženský organismus se tak stává mosaikou těchto dvou klonů (viz. shora)
Pokud jde o mitochondriální poruchy OXFOS na basi mutací mtDNA, které jsou ve většině případů dány zárodečnými mutacemi a jejich počátek je v oplodněném vajíčku, je jejich propagace dána propagací mutace v mitochondriální populaci podle zákonitostí doposud jen zčásti známých. V některých případech jde o mutace, pravděpodobně vzniklé de novo až v průběhu embryonálního vývoje.
Klonální charakter reakce se v některých studiích vztahuje k příslušnosti proliferujících buněk k objemnému vývojovému klonu (viz. 1.3) podle typu X inaktivace jehož počátek je v časné fázi vývoje (viz. obr.7, 8, 9). Naznačuje se tím vývojová biologická blízkost studované buněčné populace. Citována je starší práce popisující monoklonální charakter granulační tkáně organizující trombus (na podkladě stejného způsobu inativace X chromosomu). Naproti tomu fibroproliferativní reakce při tvorbě jizev je považována za polyklonální (rozdílná inaktivace X chromosomu).
Velmi diskutovaný byl monoklonální charakter např. při tvorbě atherosklerotických plátů v aortě. Zde se však ukázalo, že v aortě i v koronárních artériích jsou poměrně velké souvislé úseky hladkých svalových buněk monoklonálního vývojového původu (vznikly vývojově z jediného progenitoru), takže stimulus (např. atherogenní), může v určitém rozsahu působit na preexistující monoklonální populaci (populace se stejnou inaktivací X chromosomu).
O umělý klon ve formě určitého orgánu biotechnologicky připraveného z embryonální kmenové buňky specielním postupem je usilováno v mnoha laboratořích
Vedle klasického pohledu na tkáň jako na histologicky definovanou strukturu je výhodnější si uvědomit, že většina tkání s výraznější obměnou buněk je složena z množiny permanentních klonů. Tyto klony představují synchronisované buněčné systémy s výraznou kvantitativní plasticitou a trvale probíhající diferenciací. Znalost fysiologie a morfologie klonů sdružujících schopnost synchronisace, proliferace a diferenciace umožňuje lépe chápat a studovat procesy, které klon postihují. Jde jednak o změny kvantity produkovaných buněk ve smyslu numerické atrofie, hyperplasie a regenerace (synchronisované - polyklonální, nesynchronisované - monoklonální) a poruchy diferenciace (metaplaie nepřímá a dysplasie).
V případě fysiologických hyperplasií indukovaných růstovými faktory (hyperplasie = zvětšení systému, orgánu dané zmnožením buněk), včetně regeneračních stavů jde o synchronizovanou reakci všech (nebo většiny) existujících kmenových buněk (klonálních systémů) dané tkáně. Fysiologická hyperplasie má tedy polyklonální charakter. Přechody do oligoklonality až monoklonality lze vždy považovat za patologický projev systému kmenových buněk s potenciální prekancerosní povahou.
Nositelem proliferace jsou ve většině případů počáteční buněčné generace klonu, schopné významné mitotické aktivity a numerické expanse (transient amplifying cells, viz. obr. 16). Při výraznější destrukci tkáně, postihující větší část této aktuální regenerační zóny nastane aktivace adultních kmenových buněk, které představují významnou regenerační reservu (viz. např. jaterní tkáň).
Klasická numerická atrofie tkání založených na systému polyklonálních adultních kmenových buněk je výrazem snížené proliferační aktivity v místních klonech. Proces útlumu může být reversibilní nebo ireversibilní podle povahy vyvolávajícího momentu. Pokud dojde k nerovnoměrnému postižení klonů (jejich zániku nebo funkčnímu útlumu), může být stav kompensován hyperplasií zbývajících. Numerická atrofie kmenových buněk je tak současně maskována hyperplastickou reakcí zbývajících kmenových buněk, takže celkový počet buněk v systému může být udržován v normálním, resp. subnormálním rozmezí.
Ideálním systémem k demonstraci celé problematiky je krvetvorná tkáň dřeně kostní, která se výrazně liší od ostatních tkání. Odlišnost tkví v tom, že zatímco ve všech ostatních tkáních, založených podobně na systému adultních kmenových buněk existují klony ve vymezených tkáňových okrscích prostorově od sebe více či méně oddělených, veškeré produkované dceřinné populace hemopoetických kmenových buněk dřeně kostní přecházejí do cévního řečiště, kde se navzájem mísí. Elementy periferní krve představují tedy produkty všech momentálně funkčních kmenových hematopoetických buněk, jejichž množství se v daném okamžiku odhaduje u dospělého člověka řádově na stovky. Normální krvetvorba je polyklonální a to i za stavů fysiologické stimulace (např. kompensační hemopoesa při ztrátách krve). Existuje předpoklad, že pro značnou celkovou proliferační a sebeudržující kapacitu hematopoetických kmenových buněk dřeně kostní udržuje základní krvetvorbu v určitém okamžiku pouze část systému kmenových buněk (asynchronie klonů). Zbylá část kmenových buněk může být aktivována za větších funkčních nároků (ve dřeni i mimo dřeň).
Při aplastických procesech vedoucích k numerické atrofii dřeně kostní může jít o uniformní zánik nebo inhibici kmenových hemopoetických buněk nebo o jejich postupný zánik (případně inhibici). V případě progresivního zániku kmenových buněk (imunitní nebo toxická ataka) kompensují hemopoesu kmenové buňky zbývající. Hemopoesa se tak stává progresivně více a více oligoklonální. Počet krevních elementů může tak být po určitou dobu udržován v normálním rozmezí. V extremním případě redukce kmenových buněk se může stát hemopoesa monoklonální, což bylo u řady pacientů s aplastickou anemii a malou residuální krvetvorbou prokázáno.
Dysplasie. Jde o situace s nedostatečným vyzráváním, kdy v klonu převažují méně diferencované elementy. V hematologické praxi je tato situace známa jako zv. "posun do leva". K dysplasii dochází v dynamických klonech při překotné regeneraci, např. při regeneraci epiteliálních povrchů, žlázových epitelů, při kompensační hyperplasii krvetvorné tkáně. V takovýchto případech jde o regulované (reversibilní) polyklonální procesy většinou bez výraznějších buněčných atypií. Pokud jsou přítomny výraznější atypie jde o prvé fáze nádorové transformace, která má svůj počátek na úrovni kmenové buňky a projevuje se sníženou schopností diferenciace. V takovémto případě jde o proces ireversibilní.
Metaplasie je dle klasické definice přeměnou jedné diferencované tkáně v jinou diferencovanou tkáň.
Metaplasie přímá je výrazem přímé přeměny existujícího diferencovaného buněčného typu v jiný diferencovaný buněčný typ. De facto jde o přeměnu fenotypu diferencované buňky z terminální části klonu. Lze tedy předpokládat, že vzniklé buněčné varianty náleží stále do původního mateřského klonu (odkud je při své omezené životnosti doplňován). Pro vznik nezávislého nového klonu přímou přeměnu jednoho diferencovaného typu na jiný klonálně nezávislý typ neexistují přesvědčivé nálezy. V současnosti je proto používán spíše termín modulace, vyjadřující širší spektrum fenotypových variant dané buňky jako reakce na fysiologické podněty. Jednoduchými příklady představuje např. přeměna fibroblastu na jeho myxoidní variantu nebo na myofibroblast, přeměna makrofágu na epiteloidní histiocyt, B lymfocytu na plasmocyt, atd. Také vzájemné přeměny klasických mesenchymálních elementů: fibroblast - chondrocyt - osteocyt - adipocyt patří spíše do modulace, neboť jde o varianty v rámci širší rodiny fibroplastických elementů.
V kategorii přímá metaplasie je dnes diskutovaná a studovaná epiteliální - mesenchymální transformaci, která představuje obousměrnou a tedy regulovanou (reversibilní) modulaci (přeměnu) epitelu na disociované buňky mesenchymálního typu.
Obr. 16 Představa přímé metaplasie a jejího vztahu k výchozímu klonu
Tato přeměna (zejména mesenchym - epitel) probíhá podle současných znalostí v ledvinách nejen za embryonálního vývoje, ale i při regeneracích (viz. shora kmenové buňky ledvin). Nově jsou důkazy pro to, že v rozvoji fibrosy některých orgánů nastává rozsáhlá přeměna epitelu na fibroblasty (ledviny, plíce). Velká pozornost EMT je věnována v nádorech (viz. příslušnou část). Podle uvedeného schématu lze předpokládat, že při transformaci epitelu na mesenchym je biologickým centrem vzniklého mesenchymu stále kmenová buňka epiteliální. V opačném případě by bylo nutno předpokládat, že při transformaci epitel (mající svoji epiteliální kmenovou buňku) na mesenchym, by musela vzniknout i mesenchymální buňka kmenová.
Obr.17 Schéma základních procesů adultního typu klonu. A normální situace s progresivní diferenciací, numerickou expansí a úbytkem klonogenní aktivity. Konečná, plně diferencovaná populace má omezenou životnost; B hyperplasie - numerická expanse klonální populace s plnou diferenciací; C numerická atrofie - numerická redukce klonální populace s plnou diferenciací; D dysplastické změny v klonu, charakterisované významným zpomalením diferenciace (znázorněná neprohlubováním tmavnutí)

Metaplasie nepřímá je dle definice dána substitucí existující tkáně tkání jinou. V klonální pojetí tkání jde o změnu diferenciačního programu příslušné adultní kmenové buňky, která pod vlivem nejrůznějších zevních podnětů "přepíná" na alternativní program. Jak bylo řečeno, diferenciační potenciál každé AKB zajišťuje určité spektrum buněčných typů v příslušném orgánu/tkáni. Existuje řada situací, kdy se diferenciační program AKB změní a
Obr. 18. Schematické znázornění nepřímé metaplasie přeprogramováním adultní kmenové buňky (programy I, II, III)
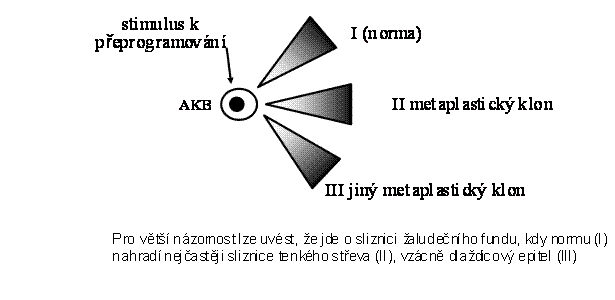
změní se i spektrum buněčných typů v daném klonu - původní diferencovaná tkáň je nahrazena jinou diferencovanou tkání. Dochází k tomu v rámci chronických zánětů bakteriálního nebo nebakteriálního původu, nebo v rámci regeneračních procesů. Příklady jsou uvedeny v příslušné kapitole o diferenciaci (díl I skript). Zde jen stručný přehled základních příkladů: enterální metaplasie sliznice žaludku, dlaždicová metaplasie v respiračním epitelu, urotelu (vzácně v jiných epitelech), změna nerohovějícího dlaždicového epitelu v epitel rohovějící. Výčet naznačuje, že k přeprogramování AKB inklinují některé epiteliální tkáně. Je pozoruhodné, že v některých epiteliálních systémech (např. ve střevní sliznici, zejména v tenkém střevě) je tato přeměna příslušných AKB zcela výjimečná.
V experimentu byl popsán i vývoj jaterní tkáně v pankreatu a obráceně pankreatické tkáně v játrech Spontánní nepřímá metaplasie je velmi vzácná v oblasti mesenchymu, kde přichází v úvahu i přímá přeměna diferencovaných mesenchymálních buněk (modulace).
Skutečný průlom do poznání metaplastických procesů (nepřímých) bylo poznání, že diferenciační potenciál AKB je nejspíše dán místními faktory. Jinak řečeno, dostane-li se AKB do jiného prostředí než jeho přirozené (určené fylogenetickým a ontogenetickým vývojem) změní svůj původní diferenciační potenciál na diferenciační potenciál místní. Svědčí proto řada experimentů, realizovaných s tzv. mesenchymálními kmenovými buňkami a hematopoetickými kmenovými buňkami, při kterých bylo prokázáno jejich začlenění a transdiferenciace odpovídající kolonizovanému orgánu (včetně transplantátu). Množí se pokusy o jejich využití v regeneraci poškozených orgánů různého typu. (např. u transplantátů).
Referováno je však i o alternativních vysvětleních včetně pokusů, kterými se nepodařila reprodukce těchto výsledků.
Poznámka
Jak kmenové buňky, tak buňky, které mohou diferencovat jen do určitých buněčných typů, vykazují klonální charakteristiky a jejich kmenový nebo progenitorový charakter je určován expresí určitých transkripčních faktorů, epigenetickým uspořádáním chromatinu a jejich buněčným mikroprostředím. Kmenový nebo progenitorový charakter těchto buněk je však dynamický stav, který může být regulován nejen směrem od buněk totipotentních a multipotentních k unipotentním, ale také v obráceném směru. To je ilustrováno tvorbou takzvaných indukovaných pluripotentních buněk (iPS) expresí specifických faktorů již částečně diferencovaných buňkách (Oct4, Sox2, Klf4 a c-Myc nebo Nanog) nebo dokonce jen dvěma faktory (Oct4 and Sox2) za přítomnosti specifických látek (jako je inhibitor deacetyláz histonů kyselina valproová).
Skupina definovaných systémových nenádorových klonálních (myšleno monoklonálních) procesů je nečetná a její znalost je v současnosti omezena na hemopoetickou tkáň. Klasickým příkladem je paroxysmální noční hemoglobinurie (PNH), která je v dnešním pohledu klonální poruchou vzniklou somatickou mutací adultní kmenové hematopoetické buňky. Mutace postihuje geny kódující syntesu enzymů oligosacharidového řetězce (glykosyltransferas) navázaného NA fosfatidylinositol tvořícího "kotvu" (GPI kotvu - glykosylovaný fosfatidylinositol) pro celou řadu povrchově vázaných proteinů* buněk krevních řad (erytrocytů, leukocytů, destiček, monocytů a lymfocytů ) přináležející do klonu příslušné mutované kmenové buňce. V současné době se předpokládá účast asi deseti autosomálních genů. Mutace obou alel je však velmi málo pravděpodobná. To je zřejmě vysvětlením, proč je za PNH zodpovědná prakticky výlučně mutace X-vázaného PIG-A genu kódujícího jeden z proteinů heterotetrameru N-Acetylglukosaminyl transferasy (tři další proteiny tohoto enzymového komplexu jsou z autosomů).
Progrese onemocnění a její klinická manifestace a tíže průběhu jsou závislé na stupni expanse mutovaného klonu. Zde se však uplatňují další, doposud ne zcela známé faktory, které tuto klonální expansi umožňují. Samotná mutace zřejmě nevede k růstovému zvýhodnění klonu. Předpokládá se přítomnost dalšího zásahu do DNA, který za expansi klonu u PNH pacientů zodpovídá. Ukazuje se navíc, že se u určitého procenta případů PNH může vyvinout i myelodysplastický syndrom ev. akutní myeloidní leukémie nebo naopak aplastická anemie. Jsou určité doklady pro to, že jde o změny v rámci mutovaného klonu.
Podle posledních pozorování má základní význam stupeň hierarchie kmenové buňky postižené mutací. V případě PHN jde nejspíše o kmenovou buňky nejvyšší hierarchie. Je známa celá řada případů, kdy jsou mutace přítomné na nižších úrovních dřeňových buněk (obr.12), jejichž životnost je omezena a nevedou tak z závažné poruše. Byly popsány i případy s několika mutacemi u jednoho individua.
* v případě červených krvinek jsou to DAF (decay accelerating factor - CD55), CD59 (inhibitor membrány atakujícího komplexu), acetylcholinesterasa, u granulocytů je to alkalická fosfatasa, údajně dále celá řada dalších povrchově zakotvených proteinů u lymfocytů, trombocytů, monocytů (jsou tendence k trombosám)
** PIGA phosphatidylisnositol glycan-class A gene)
Klonalita u nádorových procesů je probrána separátně.