Základní sexuální fenotyp je určen karyotypem XX resp. XY, které ale nedeterminují další sexuální vývoj ve všech případech. Defekty se primárně mohou vyskytnout na chromozomální (abnormální a mozaikové kombinace X a Y) nebo genové úrovni . Vlastní gonadální diferenciace začíná asi v 6. týdnu a nemusí přísně korespondovat s chromozomální výbavou. Při absenci Y chromosomu postačuje jen přítomnost maskulinního genu SRY (sex-determinating region Y) a naopak se testikulární formace mohou vyvinout mutacemi i při XX karyotypu. Další problémy mohou vznikat vcestováním karyotypicky nepříslušných zárodečných buněk do již založených testes nebo ovarií, kde může sekundárně dojít k afunkci nebo i sexuální konverzi.
Testikulární organogeneze je rychlejší než ovariální. Produkce testosteronu (T) začíná již v 9. týdnu spolu s AMH ( glykoprotein primitivních Sertolliho buněk, antimüllerian hormone), kdežto histologická diferenciace ovarií je patrná až mezi 17. - 20. týdnem. Přitomnost T a AMH určuje v dalším vývoji histologickou diferenciaci interního genitálu. Embryogeneze externího genitálu a terminální části zažívací trubice je v časném stádiu tj. před sexuální diferenciací společná. Po 8. týdnu dozrává u normálního mužského plodu enzymový systém ( 5a-reduktáza) konvertující T na mnohem účinnější dihydrotestosteron ( DHT). Ten po vazbě na jaderný androgenní receptor kompletizuje vývoj externího mužského genitálu. Poruchy mohou nastávat při nedostatku syntézy či redukce T nebo při zvýšené produkci antiandrogenů (např. progesteronu).
U genotypicky ženského fétu, tj. za nepřítomnosti sekrece testosteronu, nedochází k morfogenezi mužského typu externích genitálií. Rozhodující pro případné defekty je 14. týden, kdy je při absenci androgenů ukončen základní vývoj ženských genitálií. Při virilizaci po 14. týdnu dochází jen k relativně menším změnám (clitoris), kdežto při dřívější androgenizaci může být zevní genitál u ženských plodů malformován zásadním způsobem.
Výčet možných poruch změn karyotypu nebo různě podmíněných malformací interního a externího genitálu přesahuje téma kapitoly. Stručně je třeba uvést, že v diagnostickém algoritmu je prvotní morfologická přítomnost externích gonád (testes nebo jejich rudimentů), které signalizují základní mužský fenotyp. Pomineme-li karyotypicky založené odchylky (pravý hermafroditismus, mozaikové gonadální dysgeneze), pak jsou nejdůležitější a z hlediska biochemických syndromů nejčastější tyto vrozené poruchy:
1.1 U ženského fenotypu (absence externích gonád a přítomnost abnormálních struktur Müllerova vývodu)
1.1.1.1 Vzácný mitochondriální defekt 20,22 desmolázy ( P450scc)
1.1.1.2 Defekt 3ß-hydroxysteroid-dehydrogenázy a 5-4 isomerázy.
1.1.1.3 Defekt 17a-hydroxylázy (5 v obr. 10.1).
1.1.1.4 Defekt 21-hydroxylázy (3 v obr. 10.1)
1.1.1.5 Defekt 11ß-hydroxylázy (4 v obr. 10.1)
1.1.2 Virilizační syndromy
1.2 Pravý hermafroditismus a mozaikové karyotypy
1.3 U mužského fenotypu
1.3.1 Kongenitální absence hormonu proti strukturám ductus Mülleri (AMH). Biochemická diagnostika není možná, steroidogeneze je v normě.
1.3.2 Bilaterální kryptorchismus. Bývá normální neonatální koncentrace sexagenů a gonadotropinů. Při anorchii jsou naopak velmi vysoké plazmatické FSH a LH, nízký T a negativní HCG stimulační test.
1.3.3 Ageneze nebo hypoplazie Leydigových buněk. Obraz je podobný jako u předchozího stavu, ale FSH je v normě, rozhodne testikulární biopsie.
1.3.4 Receptorové poruchy v účinku androgenů (typ I s normálním DHT a vysokým LH a typ II s nízkým DHT a normálním LH).
1.3.5 Poruchy biosyntézy testosteronu - enzymové defekty
(viz část 3.3 této kapitoly).
1.3.6 V rámci kongenitálního panhypopituitarismu, kdy je nízký STH, hypoglykémie a úplná absence LH a FSH.
2. Syntéza a metabolismus nadledvinkových steroidů a sexagenů
Úvodní přeměna cholesterolu na pregnenolon je společná nadledvinkám i gonádám (Obr. 10.1). Většina enzymů je spojena s komplexem cytochomu P450, působí zde celkem 9 oxidačních kroků a na schématu jsou uvedeny jejich obvykle používané názvy. Čistě nadledvinkového původu jsou tyto steroidy: 11-deoxykortikosteron (DOC), kortikosteron, aldosteron, 11-deoxykortizol a kortizol. Ostatní steroidy se mohou tvořit i mimo nadledvinky. Steroidní hormony se při nadprodukci nemohou hromadit v sekrečních tkáních, takže je intenzita jejich syntézy většinou úměrná plazmatickým koncentracím. Hlavním představitelem glukokortikoidní (glk) sekrece je u člověka kortizol, u jiných živočišných druhů (hlodavci) kortikosteron. Mineralokortikoidní aktivitu má především aldosteron, slabší pak vykazují 11- a 18-hydroxy-DOC, kortikosteron a kortizol. Nadledvinkové androgeny jsou D5-steroidy. Především jde o dehydroepiandrostendion (DHEA), který se v cirkulaci vyskytuje většinou jako sulfátový konjugát (DHEAS), zatímco volná frakce DHEA tvoří jen asi 0,2-0,3%. Tyto androgeny jsou velmi slabé, ale mohou se po konverzi v řadě tkání - včetně kůry nadledvin - přes androstendion nebo androstendiol měnit na testosteron (T). U mužů tvoří produkce T z nadledvinek jen kolem 1-2% produkce z testes, u žen představuje nadledvinkový T 50% celkové produkce. Estrogeny obecně vznikají transformací androgenů aromatázami přítomnými především v gonádách, v nadledvinkách, ale i např. tukové tkáni. Testosteron se mění na estradiol, androstendion a estron. U ženy je v produktivním věku periferní a nadledvinková produkce estrogenů zanedbatelná a na významu nabývá až po menopauze nebo ovarektomii.
Asi 80 - 90% kortizolu (ale také dalších příbuzných steroidů) je v plazmě vázáno na glykoprotein nazvaný corticosteroid binding globulin, transkortin (CBG), jehož plazmatická koncentrace je kolem 30 mg/l. Asi 10% kortizolu se váže na albumin, malá část na a1-kyselý glykoprotein (orosomukoid). Aldosteron je vázán slaběji (asi z 50%) na albumin a asi z pětiny na CBG. DHEA a androstendion z nadledvin mají slabou afinitu k albuminu, naopak vazba DHEAS je velmi vysoká a proto jsou jeho plazmatické koncentrace řádově téměř 103 x vyšší než u volné frakce DHEA. Specifickým nosičem sexagenů je sex hormone binding globulin (SHBG) a jeho afinita ke steroidům klesá v pořadí dihydrotestosteron (DHT), T, androstendiol, estradiol (E2) a estron. Jaterní syntézu vazebných bílkovin a jejich afinitu významně ovlivňuje řada faktorů jak hormonálních, tak i metabolických, nutričních a dalších.
Katabolismus steroidů se odehrává hlavně v játrech a to buď zvýšením jejich polárnosti (konjugace na sulfáty a glukuronidy) a vyloučením ledvinami, nebo snížením biologické účinnosti dalšími redukcemi a hydroxylacemi steroidního skeletu. Kortizol je proti ostatním steroidům díky své pevné vazbě na CBG nejvíce chráněn před degradací a má tedy nejdelší biologický poločas. Sumu intermediárních molekul syntézy glk, jejich redukovaných metabolitů a příslušných glukuronidů či sulfátů lze vyšetřit jako tzv. 17-hydroxysteroidy (Porter-Silberovy chromogeny, 17-OH-CS). Toto vyšetření je dnes většinou nahraženo vyšetřením volného kortizolu v moči. 17-ketogenní steroidy (17-KS) zahrnují hlavně metabolity 17-OH-progesteronu a týkají se tedy širšího spektra steroidů než 17-OH-CS. Až 40% T se metabolizuje touto cestou - proto je močová exkrece 17-KS vyšší u mužů. U žen jejich produkce odráží především syntézu adrenálních androgenů.
Aldosteron má velmi krátký biologický poločas (15 minut) a metabolizuje se redukcí a konjugací podobně jako kortizol. Jeho glukuronidy se někdy stanovují také v moči jako ukazatel denní produkce. Nadledvinkové i gonadální androgeny dávají při degradaci vznik různým redukovaným meziproduktům se snižující se androgenní aktivitou, které se vylučují většinou jako glukuronidy. Ty se činností 5a-reduktázy v cílových buňkách mění na účinnější DHT a oba se metabolizují cestou derivátů androstandionu. DHEAS se přímo vylučuje močí.
Řízení sekrece nadledvinkových androgenů je dáno kortikotropní osou, z malé části se ale regulace účastní i prolaktin (PRL) a u některých species pravděpodobně také pro androgeny specifický tropní hormon hypofýzy.
3. Testes a poruchy androgenní steroidogeneze
3.1 Syntéza testikulárních hormonů a spermatogeneze
Receptory pro LH na Leydigových buňkách mají společnou sekvenci pro FSH a TSH, vazba LH má nejvyšší afinitu a signál pro syntézu T je zprostředkován cAMP. Při nadbytku resp. nedostatku LH dochází k "down-" nebo "up-" regulaci počtu LH receptorů, což je obecný fenomén a znamená snížení nebo zvýšení citlivosti cílové buňky na hormon, v případě Leydigových buněk na LH, ale také např. HCG. Proto je u mužů s nadbytkem HCG (například u testikulárního karcinomu) snížena syntéza T.
Testosteron je produkován Leydigovými buňkami způsobem, který sleduje sekreci LH v adenohypofýze. U člověka je pulsní charakter sekrece T oslaben opožděnou reakcí na LH, značným cirkulujícím poolem T a jeho tvorbou v kůře nadledvin a v periferních tkáních ( asi po 5% celkové produkce). U mladých mužů je naznačen cirkadiánní rytmus s maximem sekrece T v ranních hodinách.
V cirkulaci je vázán především na SHBG (60%), albumin (38%), volná frakce je asi 2%. Hladina SHBG významně klesá v období puberty, což znamená vzrůst fyziologicky účinné volné frakce. Afinita albuminu vzhledem k T je ve srovnání s SHBG asi 5x nižší. Pokles syntézy SHBG nastává při obezitě, akromegalii, hypotyreóze, v pubertě a při nadbytku androgenů, naopak hypertyreóza, cirhóza jater a estrogeny ( gravidita, kontraceptiva) jeho syntézu zvyšují. Vazbu sexagenů k SHBG ovlivňují také nejrůznější farmaka, zvláště se steroidní strukturou.
Hlavní periferní aktivační cestou T je jeho lokální přeměna na 2-3x účinnější androgen DHT enzymem 5a-reduktázou, který má vysokou aktivitu v cílových tkáních.
Testosteron se degraduje v játrech ( asi 70%) a v periferních tkáních (30%), a to cestou konverze na androsteron a etiocholanon ( 20-30% močových 17-ketosteroidů) a nebo konjugací DHT či androstendionu na sulfáty a glukuronidy a jejich exkrecí močí.
Pulzní sekrece GnRH je pro aktivaci LH / FSH osy důležitá, protože bylo zjištěno, že při kontinuální infúzi GnRH produkce gonadotropinů klesá. Pulzní charakter hypofyzární produkce FSH je méně nápadný než u LH. Na charakter sekrece gonadotropinů mají výrazný vliv především zpětné vazby z periferie (sexageny, inhibin, folistatin). Testosteron působí inhibičně především na úrovni hypotalamu, estrogeny na obou úrovních tj. v hypotalamu i v hypofýze.
Sérové hladiny FSH jsou u dospělého muže zhruba stejné jako u ženy ve folikulární fázi cyklu (2 - 10 U/l), pro LH jsou asi poloviční (muži 0,5-10, ženy 2-20 U/l). Denní produkce LH (= minimální substituce při deficitu LH ) je u mužů asi 1000-2000 U.
Regulace spermatogeneze je pod dominantním vlivem FSH, který je stimulován stejným GnRH jako LH. Periferní androgeny mohou modifikovat konečnou posttranskripční koncentraci FSH v hypofýze, dále poměr FSH/LH stoupá v pubertě, při relativním snížení GnRH (hypotalamická amenorea, mentální anorexie) a při hyperprolaktinemii. Sekrece FSH je negativně ovlivňována inhibiny typu A či B ze Sertoliho buněk, jejichž tvorba je naopak FSH stimulována. Jejich syntéza je dále ovlivňována prostaglandiny, inzulínem a růstovými faktory. Inhibiny působí naopak lokálně v testes stimulačně na biosyntézu testosteronu. Snížení sekrece FSH působí také peptidy izolované společně s inhibiny ze Sertoliho buněk (folistatiny). V testes byly ale prokázány také látky se stimulační aktivitou na FSH ( skupina aktivinů).
Z dalších regulačních mechanismů spermatogeneze je třeba zmínit vliv vysokých lokálních koncentrací testosteronu, který proniká hematotestikulární bariérou do Sertoliho buněk. Nově se k dalším lokálním faktorům regulujícím spermatogenezi řadí mnoho parakrinních působků typu cytokinů, růstových faktorů (EGF, TGFß), prostaglandinů a opioidů. Při hyperprolaktinemii dochází především k inhibici sekrece GnRH na úrovni hypotalamu a následně k poklesu sekrece gonadotropinů. PRL má ale prokázané receptory také přímo v testes a inhibuje 5a-reduktázu (snížená produkce DHT).
3.3 Základní biochemické vyšetřovací metody při testikulárních poruchách
Základní biochemické informace přinesou hormonální vyšetření uvedená v bodech 3.3.1 až 3.3.6. Jejich referenční hodnoty jsou uvedeny v Tab.10.1. Vždy je nutné tyto hodnoty posuzovat vzhledem k věku a klinickému obrazu sexuální maturace.
3.3.1 Plazmatickou koncentraci testosteronu (T) hodnotíme vždy ve vztahu k hodnotám LH pro rozlišení nekompenzovaných a kompenzovaných periferních výpadových syndromů a centrálního hypogonadismu. Ideální je vyšetření volné tj. nevázané frakce T, které je ale technicky náročné. Proto vyšetření celkového T doplňujeme stanovením SHBG resp. albuminu a tak lze provést aproximativní výpočet volné frakce T.
3.3.2 Při normálním nebo i zvýšeném celkovém T a malformacích zevního genitálu vyšetřujeme plazmatickou koncentraci DHT (enzymopatie s defektem 5a-reduktázy).
3.3.3 Další možné enzymopatie v rámci CAH lze nejsnáze zjistit vyšetřením 17-OH-progesteronu a dalších steroidů (viz část 1. této kapitoly) při zkráceném ACTH testu.
3.3.4 Mírně zvýšené hodnoty plazmatického estradiolu (E2) u mužů bývají při gynekomastii v pubertě a při chronických hepatopatiích. V reprodukčním věku je u plazmatický E2 u zdravých mužů na úrovni žen ve folikulární fázi cyklu. Jednoznačně vysoké hodnoty E2 se naleznou při testikulárních a adrenokortikálních nádorech s produkcí E2. U testikulárních nádorů se často nalezne vysoká hodnota ß-podjednotky HCG (trofoblastová dediferenciace).
3.3.5 Vyšetření FSH v plazmě signalizuje při vysokých hodnotách, při jinak intaktním hypotalamo-hypofyzárním systému, periferní, tj. primární dysfunkci Sertoliho buněk resp. semenotvorných kanálků, včetně deficitu inhibinů.3.3.6 Vyšetření PRL provádíme vždy - i u mužů může hyperprolaktinemie například při prolaktinomu vést k hypogonadismu.
3.4. Funkční testy
3.4.2 Klomifenový test.
3.4.3 GnRH (LHRH) test.
4. Ovaria a regulace reprodukčního cyklu u ženy
4.1 Základní morfologické aspekty
(a) granulózové buňky, na nichž se postupně exprimují receptory pro FSH (rozhodující pro růst a diferenciaci), receptory pro LH (ovulace), receptory pro PRL (blokáda účinku FSH spolu s glk a progesteronem) a receptory pro další steroidní hormony; (b) intersticiální a tékální buňky s receptory především pro LH a HCG produkují androgeny, které většinou následně konvertují na E2.
Ovulující folikul se mění rychlým zvýšením počtu LH receptorů a preovulačním zvýšením plazmatických koncentrací LH a PRL na corpus luteum, které preferenčně produkuje progesteron. Po uvolnění vajíčka z folikulu dochází k luteolýze, která je ale v případě oplodnění blokována HCG z blastocysty. Luteolýza (apoptóza a fibrotizace corpus luteum) je regulována jak sekrecí gonadotropinů a sexagenů, tak i lokálními růstovými faktory a cytokiny.
4.2 Biosyntéza a transport ovariálních hormonů
Přeměna na 17a-OH-progesteron (17-0H-PRG, folikulární fáze) je dána činností 17a-hydroxylázy, konverze na progesteron (luteální fáze, zvláště po ovulaci), tj. změna z D5 na D4-steroidy je zprostředkována komplexem dvou enzymů (ad 2 v obr. 10.1). Z hlediska estrogenní sekrece je překvapující, že žádný typ ovariálních buněk nemá kompletní výbavu pro syntézu estrogenů de novo. Biosyntéza 17ß-estradiolu (E2, nejvýznamnější estrogen) a estronu se děje z androgenních prekursorů androstendionu a testosteronu. Ty jsou produkovány pouze intersticiálními a tékálními buňkami za stimulace LH (granulózové buňky nemají enzymy 3 a 4). Androstendion se dostává difuzí do granulózových buněk, které obsahují enzymy 6 a 7 a jsou tedy sekundárně ("oklikou" přes androgeny) schopné estrogeny tvořit. Aktivita posledně jmenovaných enzymů je kontrolována především FSH, jehož receptory jsou jen v buňkách granulózy, a proto sekrece estrogenů stoupá ve folikulární fázi, při ovulaci produkce poklesne a ke konci cyklu opět poněkud stoupá. Mikrosomální aromatázový komplex granulózových buněk 7 je inhibován DHT (5a-reduktáza).
Progesteron (PRG) je primárním produktem granulózových buněk, a to především v luteální fázi ( tj. v ovariu s ovulujícím folikulem). Ve folikulární fázi je sekrece P z obou ovarií symetrická a polovina z celkového P se tvoří v kůře nadledvin. Transport estrogenů se uskutečňuje především vazbou na SHBG a albumin (pro E2 37% resp. 60%, volná frakce 1,8%), progesteronu vazbou na CBG a albumin (18% resp., 70%, volná frakce 2,4%). Vazba na specifické globuliny je přes nižší celkové procento významnější pro svou vysokou afinitu. Jak již bylo řečeno dříve, jaterní syntézu SHBG a CBG zvyšují mimo jiné především estrogeny ( u žen jsou až dvojnásobně vyšší hodnoty SHBG ) a T4, naopak ji snižují androgeny a gestageny. Spolupůsobí ale také řada dalších metabolických a farmakologických vlivů.
4.3 Odbourávání sexagenů
Progesteron má krátký biologický poločas (kolem 5 minut) a je po hydrogenaci vylučován močí jako pregnandiol-glukuronid, jehož exkrece odráží celkovou produkci progesteronu. Konečnými metabolity androgenů jsou androsteron, epiandrosteron, androstendiol (z DHT) a etiocholanolon.
Hlavním negativním zpětnovazebným mechanismem regulace sekrece gonadotropinů je tedy sekrece estrogenů a progesteronu. Během normální menstruace tato regulace udržuje plazmatické hladiny gonadotropinů pod 25 U/l. Při poklesu periferní produkce sexagenů existuje především na úrovni hypofýzy (možná i hypotalamu) také pomaleji se vyvíjející pozitivní zpětná vazba, tj. stimulace sekrece gonadotropinů (vysoké plazmatické koncentrace LH a FSH jsou v menopauze a po ovarektomii). Vedle LH a FSH, jejichž ovariální receptory patří do superrodiny receptorů využívajících k signalizaci G-proteiny (TSH, PTH, AVP, katecholaminy, ale i některé interleukiny), působí v ovariu velké množství lokálních regulačních peptidů. Ovulaci jiného než dominantního folikulu potlačuje skupina tzv. follicule regulatory proteins (FRP), existuje lokální luteinizační stimulátor i inhibitor, GnRH podobné peptidy apod. Do cirkulace se secernují podobně jako v testes aktiviny, inhibiny a folistatin. Jejich úloha v menstruačním cyklu není zcela vyjasněna. Žluté tělísko produkuje během gravidity pod kontrolou HCG relaxin. Ve fetálním období a premenarché jsou sice ovaria schopná tvorby androstendionu (význam syntézy není zcela jasný), ale při absenci gonadotropinů dojde k jejich atresii bez cyklické změny hormonální produkce. Kolem 6. roku věku se některé folikuly zvětšují a stoupá produkce estrogenů. V důsledku zvýšených hladin FSH a LH kolem 10.roku produkce estrogenů akceleruje, zvětšuje se růst folikulů až do nástupu menarché, kdy dojde k prvnímu výběru dominantního folikulu a začátku menstruačních cyklů. Menarché resp. menstruační cyklus zahrnuje málo objasněný mechanismus výběru dominantního folikulu, který probíhá již během předchozí menstruace, jeho přeměnu na Graafovský folikul, ovulaci, vývoj žlutého tělíska a luteolýzu. Postovulační tj. luteální fáze je poměrně konstatní (14 dní), změny v délce celého menstruačního cyklu jsou dány především kolísáním délky preovulační, folikulární fáze. Hormonální změny jsou schematicky znázorněny na Obr. 10.4. Preovulační produkce estrogenů stimuluje sekreci LH, jehož peak ( LH surge) zahajuje ovulaci. Zvyšuje se - i když méně - také produkce FSH a PRL. V období ovulace klesá syntéza estrogenů, nastupuje zvýšení progesteronu a vrcholí také produkce androstendionu a testosteronu. V dalším vývoji corpus luteum se opět zvyšuje sekrece estrogenů, jejichž pokles na konci cyklu vede k menstruaci, zvýšení FSH a zahájení dalšího cyklu. Nástup menopauzy je dán vyčerpáním zásoby vhodných premordiálních folikulů, jejichž množství je určeno stavem na počátku puberty. Přestane probíhat proces výběru folikulů a klesá především produkce estrogenů.
4.5 Biochemické vyšetřovací metody při ovariálních poruchách.
4.5.1 Klomifenový test.
4.5.2 Gonadoliberinový test.
4.5.3 Progesteronový test
4.5.4 Mimo biochemické metody je nutné zmínit měření bazální teploty, kde termogenní účinek progesteronu signalizuje ovulaci, endometriální nebo vaginální cytologii (typické histomorfologické změny při různém poměru sexagenů) a v poslední době i sonografickou folikulografii, která zachytí folikuly větší než 12 mm a jejich vývoj do ovulace. Všechna tato vyšetření se integrálně hodnotí s hormonálními analýzami.
4.5.5 Při poruchách sexuální maturace je na prvním místě vyšetření karyotypu s kombinací vyšetření jako u sekundární amenorhey.
Diagnostické algoritmy pro vyšetření primární a sekundární amenorhey, virilizace (hirzutismu) a poruchy fertility jsou ve speciálních kapitolách endokrinologických učebnic. Například schéma vyšetření sekundární amenorhey se z hlediska biochemických metodik primárně opírá při vyloučení gravidity o vyšetření plazmatických koncentrací PRL a TSH ( prolaktinomy, hypotyreóza) a dále při jejich normálních hodnotách o vyšetření FSH, LH a výsledek progesteronového testu.
1.1.1 Kongenitální adrenální hyperplasie (CAH)
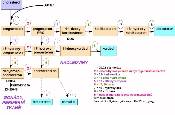 CAH představuje soubor nejméně 5 enzymových defektů steroidogeneze v kůře nadledvin s různým biochemickým a klinickým obrazem. Tyto defekty vedou především k nedostatečné syntéze kortizolu a tím stimulaci sekrece ACTH. Jeho nadbytek vede k hypertrofii kůry nadledvin a hromadění produktů steroidogeneze před enzymovým blokem. Důsledky jsou dány účinky kumulovaných intermediárních produktů nebo jejich metabolitů
(Obr. 10.1).
CAH představuje soubor nejméně 5 enzymových defektů steroidogeneze v kůře nadledvin s různým biochemickým a klinickým obrazem. Tyto defekty vedou především k nedostatečné syntéze kortizolu a tím stimulaci sekrece ACTH. Jeho nadbytek vede k hypertrofii kůry nadledvin a hromadění produktů steroidogeneze před enzymovým blokem. Důsledky jsou dány účinky kumulovaných intermediárních produktů nebo jejich metabolitů
(Obr. 10.1).
vede ke generalizovanému výpadku všech nadledvinkových a gonadálních steroidů (kongenitální lipoidní adrenální hyperplasie) a i při terapii přežívá jen asi třetina novorozenců. Všechny steroidní hormony jsou sníženy, odpověď na ACTH (u chlapců i na HCG) je minimální nebo chybí, je vysoká koncentrace P-ACTH, plasmatické reninové aktivity (PRA) , deplece NaCl (tzv. salt-wasting crisis), u chlapců je pseudohermafroditismus.
Výsledkem jsou vysoké koncentrace ACTH, PRA při chybění kortizolu, aldosteronu a sexuálních steroidů ležících ve schématu biosyntézy distálně od DHEA. Postižené děti opět trpí těžkou deplecí NaCl (salt-wasting crisis), klinicky jde o mužský i ženský pseudo-hermafroditismus. U abortivních forem může být předčasná adrenarche, poruchy v pubertálním vývoji a menstruaci, hirzutismus apod. Laboratorně se diagnóza opírá o výrazné zvýšení bazálních a ACTH stimulovaných plazmatických a močových hodnot D5-steroidů, tj. všech před blokem 2 (Obr. 10.1) a s nízkými 4-steroidy (za místem působení 2). Většinou se používá kritéria zvýšení 17-hydroxypregnenolonu nebo jeho poměru k 17-hydroxyprogesteronu minimálně o + 2s proti normě. V normě nepřesáhnou za 60 min po aplikaci ACTH sérové koncentrace 17-hydroxypregnenolonu 48 nmol/l a DHEA 58 nmol/l , poměr 17-hydroxypregnenolon: 17-hydroxyprogesteron je menší než 11 a poměr DHEA : androstendion je menší než 8. Při plně vyjádřené patologii jsou tyto hodnoty mnohonásobně překračovány a po podání supresivní terapie glukokortikoidy se výrazně snižují. Enzymový defekt má vliv i na hormonální produkci v testes, kde po několikadenním podání 1500 až 5000 jednotek HCG může sice dojít k obvyklému zvýšení testosteronu, ale rozhodující je opět výrazně vyšší poměr D 5 :D 4 steroidů v séru i moči, především výrazné zvýšení androstendiolu.
je zpravidla kombinován s defektem 17,20- lyázy (6 v obr. 10.1). Výsledkem je opět defekt syntézy 17-OH-steroidů, a to nízké bazální i stimulované (ACTH, HCG) koncentrace kortizolu, aldosteronu a sexagenů. Stimulací kůry zvýšeným ACTH se hromadí se především 11-DOC, kortikosteron a jejich 18-OH deriváty. Výsledkem nadbytku těchto steroidů s mineralokortikoidním účinkem je hypertenze a hypokalemie, sekundárně je suprimována PRA a zbytková sekrece aldosteronu. V případech s defektem 16,20-lyázy jsou zvýšeny hladiny 17-OH-pregnenolonu a 17-0H-progesteronu. Důležité je opět zlepšení patologických hodnot při terapii glukokortikoidy.
tvoří asi 90% CAH. Výsledkem je nedostatek kortizolu, DOC, kortikosteronu a aldosteronu, zvýšení sekrece ACTH a nadbytek nadledvinkových androgenů (močové 17-KS). V klinickém obrazu dominuje virilizace a zvýšené vylučování NaCl s hypotenzí. Bazální hodnoty 17-OH-progesteronu jsou 300-3000 nmol/l a dále se po ACTH aplikaci zvyšují, hodnoty androstendionu jsou mezi 6,9 - 28 nmol/l . Poměr PRA : aldosteron je zvýšen.
tvoří 5-8% CAH a vede k poklesu syntézy kortizolu, kortikosteronu a aldosteronu, naopak se hromadí 11-DOC s následnou retencí tekutin a hypertenzí. Jsou zvýšené adrenální androgeny, které působí virilizaci.
Představují další velkou skupinu poruch. Jsou způsobeny zvýšenou přítomností androgenů u matky (virilizující tumory během gravidity, hormonální terapie progestogeny v časné graviditě) nebo u plodu (nerozpoznaná residua testes) .
Při rovnováze genotypu XX/XY a při podobných chomozomálních mozaikových karyotypech dochází k vývoji typicky ambivalentních zevních genitálií s dalšími variabilními projevy kombinace mužského a ženského fenotypu.
Pro diagnózu je nutná úplná absence struktur ductus Mülleri, naopak externí gonády jsou alespoň rudimentárně přítomny, k inkompletní androgenizaci dochází z různých příčin uvedených v bodech 1.3.1 až 1.3.5.
Základním společným prekursorem nadledvinkových steroidů a sexagenů je cholesterol pocházející (a) z cirkulujících LDL, které se váží na membránové receptory sekrečních buněk a uvolňují volný chlesterol, (b) z esterů cholesterolu deponovaných v cytoplazmatických vakuloách a (c) z resyntézy cholesterolu z acetyl-CoA.
Podstatnými morfologickými strukturami testes jsou
(a) intersticiální Leydigovy buňky (5% objemu ) syntetizující testosteron,
(b) Sertoliho buňky semenotvorných kanálků, které tvoří hematotestikulární bariéru a mají především podpůrné a trofní funkce vzhledem k spermatogoniím a
(c) buňky zárodečného epitelu v semenotvorných kanálcích se spermatogoniemi. Zde probíhá první a druhé meiotické dělení a tvorba spermií. Biosyntéza sexagenů má společný začátek se steroidogenezou v nadledvinách, tj. začíná konverzí cholesterolu na pregnenolon (Obr. 10.2). Další metabolismus probíhá
Biosyntéza sexagenů má společný začátek se steroidogenezou v nadledvinách, tj. začíná konverzí cholesterolu na pregnenolon (Obr. 10.2). Další metabolismus probíhá
(a) cestou 17a-hydroxypregnenolonu a DHEA(S) a jeho konverzemi na testosteron v gonádách či periferních tkáních (D4 - cesta).
(b) cestou tvorby progesteronu, 17-OH- progesteronu a androstendionu (D5 -cesta). Jak androstendion, tak testosteron se mohou účinkem aromatázy v některých periferních tkáních měnit na estrogeny ( u muže asi 0,4% z celkově secernovaných 7 mg T) . Malá část syntézovaných androgenů může být ve formě sulfátů deponována v Leydigových buňkách. 3.2 Hypotalamo-hypofyzární-testikulární osa (Obr. 10.3)
3.2 Hypotalamo-hypofyzární-testikulární osa (Obr. 10.3)
Gonadotrofní buňky hypofýzy mají receptory pro hypotalamický gonadoliberin GnRH, který stimuluje sekreci jak LH, tak i FSH zvýšením intracelulárního Ca2+ v těchto buňkách. Starší označení LHRH pro tento spouštěcí hormon se vzhledem k prokázanému vlivu i na FSH přestává používat. Oba gonadotropiny jsou glykoproteiny se společnou a -podjednotkou, kterou sdílí i s TSH a HCG, ale každý ze jmenovaných hormonů má odlišnou ß-podjednotku, syntézovanou expresí specifických a nezávislých genů. Podjednotky se spojují po ukončení translace a molekula se následně glykosyluje. Stupeň a charakter glykosylace není konstantní a vzniká více glykosylačních produktů s variabilní biologickou aktivitou.
Klinický obraz deficitu testosteronu závisí na době jeho vzniku. U novorozenců je nutné vyšetření karyotypu, využití zobrazovacích metod při malformacích genitálu (přítomnost rudimentárních externích gonád) a v dospělosti vyšetření spermiogramu.
3.4.1 HCG ( Praedynový) test má řadu modifikací.
Principem je podání 250 - 3000 U HCG (dávka záleží na věku), který má biologickou aktivitu LH, po dobu 3 dní s následným stanovením plazmatické koncentrace HCG a testosteronu. Při funkčních Leydigových buňkách dojde po ukončení testu ke vzestupu T z normálních hodnot na 2-8 násobek. Test diferencuje centrální a periferní hypogonadismus, anorchii proti bilaterálnímu kryptorchismu a enzymové defekty biosyntézy testosteronu.
Klomifen kompetitivně obsazuje E2 receptory v hypotalamu a hypofýze a způsobuje zvýšení GnRH, LH a FSH. Po 10 dnech podávání dojde v normě ke zvýšení LH alespoň o 50%, FSH a T alespoň o 30%. K diagnóze centrální poruchy je podstatná odpověď LH.
Po i.v. podání 0,1mg syntetického GnRH je sledována odpověď plazmatické koncentrace LH a FSH. Při intaktní hypofýze dojde ke zvýšení u LH 2-9x, u FSH 1,5-2x. Základním biochemickým vyšetřovacím algoritmem je tedy zhodnocení bazálních plazmatických hodnot testosteronu, LH, FSH a z ostatních metod diagnostika karyotypu a spermiogramu. Při předpokladu enzymových defektů provedeme vyšetření steroidů tak, jak jsou uvedena u CAH. Příslušné nozologické jednotky z oblastí centrálních a periferních forem mužských hypogonadismů, testikulárních nádorů, poruch mužské puberty a dalších patologických stavů (Klinefelterův syndrom, kryptorchismus, gynekomastie, infertilita) jsou uvedeny v učebnicích endokrinologie.
Ovaria mají podobně jako testes 2 hlavní funkce, které jsou úzce propojeny a v reprodukčním věku ženy cyklicky uspořádány: produkce zralého vajíčka a změny v sekreci sexagenů během 28-30 dnů.
Na konci puberty obsahují ovaria asi 400 tisíc primordiálních folikulů. Z původního počtu několika milionů jich většina zanikne atresií před formací antra, protože až do stadia terciárního (antrálního) folikulu jsou jeho diferenciace a růst kontrolovány lokálními faktory. Plné zralosti během reprodukčního věku ženy dosáhne jen asi 400 folikulů. Předpoklady dominance (výběru) a zahájení vývoje konkrétního folikulu nejsou známé. Nejčastěji je uvažována tzv. duální teorie koordinované činnosti obou gonadotropinů: LH navodí primárně v tékálních buňkách syntézu androstendionu a ten po konverzi na estradiol v granulózových buňkách - kontrolované FSH - způsobí začátek vývoje folikulu. Vývoj do Graafova folikulu ( vzrůst na 30 mm) je plně podřízen gonadotropinové sekreci. Graafův folikul obsahuje kromě zralého oocytu s haploidním genotypem několik typů buněk:
Ovaria jsou v reprodukčním věku ženy hlavním zdrojem estrogenů a v luteální fázi cyklu i gestagenů. Produkují také androgeny a jejich konverze mimo ovarium tj. v periferních tkáních na estrogeny je důležitá v menopause a při ovariálních dysfunkcích.
Principiálně se biosyntéza sexagenů neliší od adrenální a testikulární sekvence ( obr. 10.1 a obr. 10.2.). Kvantitativně limitujícím článkem syntézy je iniciální konverze cholesterolu a jeho esterů na pregnenolon, která je v lokalisována v tékálních buňkách a dominantně kontrolována LH.
17ß-estradiol se rychle a reverzibilně dehydrogenuje na estron. Ten je konvertován na dihydroxy-, methoxy-, katechol- deriváty a estriol. Alternativně je ledvinami po konjugaci vylučován estronsulfát nebo estriolglukuronid. 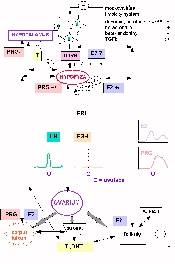 4.4 Regulace menstruačního cyklu a ovulace (Obr. 10.4)
4.4 Regulace menstruačního cyklu a ovulace (Obr. 10.4)
GnRH ( dříve LHRH) je hypotalamický dekapeptid, který je esenciálním faktorem pro syntézu a uvolnění obou gonadotrofinů. Jeho koncentrace v periferní krvi je velmi nízká a pravděpodobně mírně stoupá v preovulatorní fázi. Sekrece je pulsní v intervalech 1-3 h a pulsní rytmus je nutný k normální menstruaci. Spouštění, pulsní intervaly GnRH a tím i charakter menstruačního cyklu jsou spíše řízeny ovariální produkcí sexagenů než suprahypotalamickými strukturami CNS. Výrazněji než u mužů dochází při jeho trvale zvýšených koncentracích - např. arteficiálně při infúzním podání - ke ztrátě citlivosti (down-regulaci) hypofyzárních receptorů GnRH a snížené odpovědi obou gonadotropinů.
Základními laboratorními parametry při endokrinních ovariálních poruchách jsou plazmatické koncentrace LH, FSH, PRL, estradiolu a progesteronu (referenční hodnoty jsou uvedeny v Tab.10.1.). Z dynamických testů se používají dále uvedené.
Klomifen se váže na estrogenové jaderné receptory a kompeticí navozuje hypoestrogenní stav. Podává se 5 dní po 100 mg, a to 5.den cyklu při anovulačních menstruacích nebo kdykoliv u sekundární amenorhey. Tím se navodí zvýšení GnRH a současně - nebo spíše v důsledku této stimulace - i zvýšení LH a FSH. Oba gonadotropiny působí při intaktních ovariích ovulaci, která je detegována, bez ohledu na následnou přítomnost či absenci menstruace, zvýšením plazmatického progesteronu nad 16 nmol/l. Vyšetření provádíme 12. den od ukončení aplikace klomifenu. Negativní, tj. patologický test indikuje spíše hypotalamickou poruchu, ale nevylučuje ani hypofyzární poruchu.
GnRH (LHRH) test se provádí syntetickými analogy s odběrem vzorků na vyšetření plazmatické koncentrace LH a FSH před a po bolusové aplikaci 0,1 mg preparátu. Vzorky odebíráme po 30 minutách od - 60 do + 120 min. Ve folikulární fázi cyklu stoupne bazální hladina LH nejméně 2x, u FSH 1,5x. Odpovídající hodnoty vzestupu jsou pro luteální fázi 4-8x (LH) a 2x (FSH). Snížená odpověď svědčí pro hypofyzární poruchu, ale interpretace není úplně jednoznačná pro možnost snížené citlivosti hypofýzy na GnRH při déletrvající hypotalamické poruše.
je nepřímé funkční vyšetření, které prokazuje dostatečnou estrogenizaci dělohy a tedy proliferaci endometria. Podáváme 5 dnů 15 mg progesteronu a v případě dostatku estrogenů se dostaví menstruace do 2-7 dní po ukončení aplikace preparátu.