Poruchy acidobázické regulace
Autor kapitoly: MUDr.Pavel Pick, Ústav klinické biochemie VFN a 1.LF UK Praha
1. Úvod
Poruchy acidobázické regulace (ABR) jsou stavy, které vznikají v úzké souvislosti se změnami celého vnitřního prostředí. Objevují se při narušení funkce orgánů, podílejících se na regulaci homeostázy. Hodnocení poruch ABR proto musí být komplexní s hodnocením změn všech parametrů vnitřního prostředí. Při rozpoznání a terapii poruch ABR se řídíme podrobnou anamnézou, nálezem fyzikálního interního vyšetření a výsledky vyšetření biochemických parametrů. To zahrnuje parametry ABR, koncentraci kationtů a aniontů, laktátu a ostatní laboratorní výsledky, které umožňují hodnocení funkce orgánů, podílejících se na regulaci vnitřního prostředí. Úvodem zopakujeme některé základní pojmy z chemie a fyziologie, které jsou nutné pro pochopení dalšího výkladu.
Kyselina je látka, která je schopna uvolnit H+.
Báze (zásada) je látka, která je schopná vázat H+.
Kyseliny dělíme na silné a slabé, a to na základě jejich schopnosti disociovat:
HCl -----> H+ + Cl-
I.st. H3PO4 -----> H+ + H2PO4-
II.st. H2PO4- -----> H+ + HPO42-
III.st. HPO42- -----> H+ + PO43-
CH3COCH2COOH -----> H+ + CH3COCH2COO-
Mírou disociace je hodnota pK, což je záporný dekadický logaritmus disociační konstanty kyseliny. Silné kyseliny mají hodnotu pK nízkou, slabé kyseliny vyšší.
| Kyselina | pK |
| chlorovodíková | blízké 0 |
| fosforečná | 2.0 |
| acetoctová | 3.58 |
| mléčná | 3.86 |
| beta hydroxymáselná | 4.39 |
| uhličitá | 6.10 |
Koncentrace H+
Koncentrace H+ je v krvi velmi nízká, asi 40 nmol/l. Většinou se neužívá přímé vyjadřování koncentrace ve zlomcích molu na litr, ale v jednotkách pH, které je definováno jako záporný dekadický logaritmus molální aktivity H+ .
Zjišťujeme aktivitu - aH+, která se v krvi prakticky od koncentrace neliší a můžeme tedy v dalším výkladu oba pojmy zaměňovat. Při hodnocení pH ve vztahu k aktivitě je třeba přihlížet k tomu, že jde o logaritmický vztah. Malá změna pH odpovídá velké změně v aktivitě H+ (Obr. 3.1).
Normální hodnoty pH v arteriální krvi u dospělých jsou 7.400 + - 0.040. Hodnoty pH pod 7.360 označujeme jako acidémii, nad 7.440 označujeme jako alkalémii.
2. Nárazníkové systémy (pufry)
Jsou to soustavy látek, které brání změně pH roztoku po přidání kyseliny nebo zásady. Nárazníky jsou tvořeny párem - slabá kyselina a její sůl se silnou zásadou, nebo naopak slabá zásada a její sůl se silnou kyselinou. Nárazníkové roztoky působí tak, že volný H+ vážou ve formě slabé kyseliny, která je velmi málo disociovaná a tak se koncentrace H+ udržuje relativně stálá. pH nárazníkového roztoku je dáno vztahem, který podle autorů nazýváme Hendersonova-Hasselbalchova rovnice:
| pH = pK + log | [súl] |
| ---------- |
| [kyselina] |
Z rovnice vyplývá, že při konstantní hodnotě pK závisí pH pufru výhradně na velikosti poměru koncentrace soli ke koncentraci kyseliny. Jakákoliv změna v tomto poměru se projeví změnou pH.
Nárazníkový systém hydrogenkarbonátový
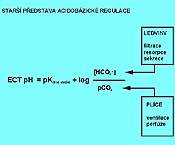
Základním nárazníkovým systémem v krvi je systém hydrogenkarbonátový (hydrogenuhličitanový, nesprávně bikarbonátový), a to proto, že je co do kapacity nejrozšířenější a snadno se regeneruje. Je v rovnováze s nárazníky "nebikarbonátovými", kterým je schopen jak předávat H+ a sám se regenerovat, tak od nich H+ přijímat. Je tvořen kyselinou uhličitou (H2CO3) a hydrogenkarbonátem (bikarbonátem, převážně sodným, NaHCO3). Jeho pH je definováno Hendersonovou-Hasselbalchovou rovnicí pro hydrogenkarbonátový nárazník:
| pH = pKkys.uhlič + log | [HCO3-] | = 6.1 + log | [HCO3-] |
| ---------- | ---------- |
| [H2CO3] | [H2CO3] |
Výraz (H2CO3) v rovnici lze nahradit výrazem (pCO2.s), kde malé "s" je koeficient rozpustnosti, kterým násobíme pCO2, abychom dostali koncentraci kyseliny uhličité
v mmol/l. Pro pCO2 vyjádřený v kPa je tento koeficient roven 0,225 (pro vyjádření v torrech je roven 0,03).
Disociační konstanta kyseliny uhličité (pKI H2CO3)
Číselná hodnota pKI H2CO3 byla deklarována jako konstantní a rovna 6.1. Zjistilo se však, že hodnota pKI H2CO3 může kolísat v závislosti na iontovém složení krve, zejména u pacientů v těžkých stavech, a to od hodnoty 5.8 do 6.4. Protože pKI H2CO3 se užívá k výpočtu koncentrace hydrogenkarbonátů, jak vyplývá z Hendersonovy-Hasselbalchovy rovnice, musí se při hodnocení koncentrace hydrogenkarbonátů, respektive BE nebo BD (viz dále) k této skutečnosti přihlédnout.
Parciální tlak oxidu uhličitého (pCO2)
Kyselina uhličitá se v Hendersonově-Hasselbachově rovnici označuje jako respirační složka. Její koncentrace v arteriální krvi je dána rovnováhou mezi množstvím CO2 produkovaného ve tkáních a množstvím, které je z organismu vyloučeno plícemi. V alveolárním vzduchu se za fyziologických podmínek ustálí parciální tlak CO2 na hodnotě 5,35 kPa. Při průchodu krve plicními kapilárami se vyrovná pCO2 v alveolárním vzduchu s pCO2 v krvi, protékající plicními kapilárami a pCO2 v arteriální krvi je prakticky totožný s pCO2 v alveolárním vzduchu.
H2CO3 se v krvi vyskytuje jako:
1) fyzikálně rozpuštěný CO2
2) hydratovaný CO2, to znamená H2CO3.
Vzájemný poměr obou složek je 800 : 1 a jsou ve vzájemné rovnováze. Součet jejich koncentrací se označuje jako efektivní koncentrace kyseliny uhličité. Ke kvantitativnímu vyjádření velikosti respirační složky proto běžně používáme hodnotu pCO2, kterou můžeme přepočítat na koncentraci kyseliny uhličité, jak už bylo zmíněno. Normální hodnoty pCO2 v arteriální krvi jsou 5.3 kPa ± 0.5.
Hodnoty nad 5.8 kPa -----> hyperkapnie
Hodnoty pod 4.8 kPa -----> hypokapnie
Hydrogenkarbonátový anion (HCO3-)
Jeho koncentrace je označována jako metabolická složka Hendersonovy-Hasselbalchovy rovnice. Jeho vznik je dán vztahem
H2CO3 <-----> H+ +HCO3-.
Koncentrace hydrogenkarbonátového (bikarbonátového) aniontu v krvi je závislá na činnosti ledvin a na působení zákona elektroneutrality, respektive na vztahu koncentrace silných kationtů a aniontů a slabých netěkavých kyselin, jak bude zmíněno v dalším výkladu.
Ostatní nárazníkové systémy
V krvi se uplatňují při regulaci koncentrace H+ ještě další (nebikarbonátové) nárazníkové systémy, které jsou s hydrogenkarbonátovým systémem v určité rovnováze a jsou schopny regenerace tím, že mohou předat H+ hydrogenkarbonátovému nárazníkovému systému. Naopak jsou schopny v případě potřeby přijímat H+ z kyseliny uhličité a tím umožnit regeneraci hydrogenkarbonátového aniontu:
BUFF- + H2CO3 <-----> HBUFF + HCO3-
Nehydrogenkarbonátové nárazníkové systémy
1) Systém hemoglobin - oxyhemoglobin
Oxygenovaný hemoglobin se chová jako silnější kyselina, která proton odštěpuje, deoxygenovaný hemoglobin jako slabší kyselina, respektive jako silnější konjugovaná báze a proton váže.
2) Bílkoviny krevní plazmy
Za fyziologického pH jsou téměř všechny bílkoviny v oblasti pH vyššího, než je jejich izoelektrický bod. Proto mají negativní náboj (anionty), jsou schopny vázat proton (H+) a chovají se jako silné konjugované baze.
3) Systém primárních a sekundárních fosfátů (H2PO4- a HPO42-)
Uplatňuje se spíše intracelulárně, dále v prostředí kostí a zubů. Jako jeden z možných nárazníků se podílí na acidobázické regulaci v ledvinách.
Podíl jednotlivých nárazníkových systémů na celkové nárazníkové kapacitě krve.
| ERYTROCYTY |
| Systém oxyhemoglobin - hemoglobin | 35 % |
| Systém anorganických a org. fosfátů | 5 % |
| Hydrogenkarbonátový systém | 18 % |
| PLAZMA |
| Hydrogenkarbonátový systém | 35 % |
| Bílkoviny plazmy | 7 % |
| CELKEM |
| Hydrogenkarbonátový nárazníkový systém | 53 % |
| Ostatní nárazníkové systémy | 47 % |
V nazírání na problematiku acidobazické regulace došlo, jako ostatně v celé řadě jiných oborů, k určitému vývoji a posunu hodnocení úlohy některých složek podílejících se na regulaci ABR. Přispěly k tomu práce Stewarta a Fencla, které zejména zdůrazňují vliv zákona elektroneutrality, respektive vliv koncentrací silných kationtů a aniontů, slabých netěkavých kyselin a pCO2 na aktivitu H+ v krvi a intersticiální tekutině. Je zdůrazněna role plazmatických bílkovin, zejména albuminu v regulaci ABR. Je zvýrazněn podíl dalších orgánů (jater a střeva) na regulaci ABR. Zavádí se pojem silných iontů, které nevstupují do reakcí. Počítáme k nim silné kationty - Na+, K+, Ca++, Mg++, a silné anionty - Cl-, laktátový anion, SO42-, a anionty oxokyselin.
Definují se tyto nezávisle proměnné veličiny:
SID (strong ion difference) rozdíl v koncentraci silných kationtů a aniontů
Atot - koncentrace všech slabých netěkavých kyselin. Odpovídá především koncentraci plazmatických bílkovin a anorganických a organických fosfátů.
pCO2 - parciální tlak oxidu uhličitého v arteriální krvi.
Změny velikosti nezávisle proměnných veličin mají za následek změny v koncentraci závisle proměnných veličin, což jsou koncentrace HCO3- a H+. Tyto vztahy jsou odvozeny z fyzikálně chemických zákonů, platných pro vodné soustavy rozpuštěných látek.
Výpočet SID:
SID= (Na+ + K+ + Ca++ + Mg++) - (Cl- + laktát + SO42- + anionty oxokyselin)
 Při pohledu na grafické znázornění SID (Obr.3.2) je zřejmé, že jde o část sloupce aniontů vyplněnou hydrogenkarbonáty a plazmatickými bílkovinami. Změny velikosti SID jsou způsobeny hlavně změnami v poměru Na+ ku Cl-, eventuelně zmnožením reziduálních aniontů (RA). Každé zvětšení SID je sledováno z důvodů zachování elektroneutrality zvýšením koncentrace hydrogenkarbonátů, což vede ke zvýšení pH. Naopak zmenšení SID vede ke snížení koncentrace hydrogenkarbonátů v rozsahu nutném pro zachování elektroneutrality a druhotně k poklesu pH. Pokles koncentrace Atot vede ke zvýšení koncentrace hydrogenkarbonátů, což je příčinou vzniku metabolické alkalózy u stavů se sníženou koncentrací bílkovin, nebo jen albuminu.
Z následujících schémat, převzatých z práce Kováče a spol., vyplývá rozšíření pohledu na acidobazické regulace při použití parametru SID a Atot (Obr.3.3 a 3.4). Změny nezávisle proměnných veličin vedou ke změnám v koncentraci hydrogenkarbonátu a v pH. Hodnotu SID přímo nevypočítáváme. Z technických důvodů nelze rychle stanovit některé parametry z oblasti reziduálních aniontů. K hodnocení metabolických poruch acidobazické rovnováhy používáme některé parametry, které jsou vypočítávány z koncentrací jednotlivých kationtů, aniontů a bílkovin. Jde o BBS (buffer base séra), AG (anion gap) a RA (reziduální anionty, viz dále).
Při pohledu na grafické znázornění SID (Obr.3.2) je zřejmé, že jde o část sloupce aniontů vyplněnou hydrogenkarbonáty a plazmatickými bílkovinami. Změny velikosti SID jsou způsobeny hlavně změnami v poměru Na+ ku Cl-, eventuelně zmnožením reziduálních aniontů (RA). Každé zvětšení SID je sledováno z důvodů zachování elektroneutrality zvýšením koncentrace hydrogenkarbonátů, což vede ke zvýšení pH. Naopak zmenšení SID vede ke snížení koncentrace hydrogenkarbonátů v rozsahu nutném pro zachování elektroneutrality a druhotně k poklesu pH. Pokles koncentrace Atot vede ke zvýšení koncentrace hydrogenkarbonátů, což je příčinou vzniku metabolické alkalózy u stavů se sníženou koncentrací bílkovin, nebo jen albuminu.
Z následujících schémat, převzatých z práce Kováče a spol., vyplývá rozšíření pohledu na acidobazické regulace při použití parametru SID a Atot (Obr.3.3 a 3.4). Změny nezávisle proměnných veličin vedou ke změnám v koncentraci hydrogenkarbonátu a v pH. Hodnotu SID přímo nevypočítáváme. Z technických důvodů nelze rychle stanovit některé parametry z oblasti reziduálních aniontů. K hodnocení metabolických poruch acidobazické rovnováhy používáme některé parametry, které jsou vypočítávány z koncentrací jednotlivých kationtů, aniontů a bílkovin. Jde o BBS (buffer base séra), AG (anion gap) a RA (reziduální anionty, viz dále).
3. Laboratorní vyšetření nutná pro hodnocení poruch ABR
1) Vyšetření parametrů ABR
pH, pCO2, pO2, koncentrace standardních hydrogenkarbonátů, BE, koncentrace aktuálních hydrogenkarbonátů, saturace Hb kyslíkem.
2) Ostatní laboratorní vyšetření
Koncentrace kationtů: Na+, K+, Ca++, Mg++
Koncentrace aniontů: Cl-, laktátu, bílkovin, případně zvlášť albuminu
Koncentrace ostatních látek: Urea, kreatinin, glykemie, osmolalita, event. ketolátky
Jak vyplývá z poměrně rychlé dynamiky změn vzájemného působení složek vnitřního prostředí, je nutné odebírat krev na vyšetření všech parametrů současně.
3.1. Vyšetření parametrů ABR
Vyšetřuje se arteriální krev, arteriolární, respektive kapilární krev nebo smíšená venózní krev. Arteriální krev odebírá lékař arteriální punkcí. Odběr se provádí do injekční stříkačky z plastiku, kde v konusu je malé množství heparinu a případně i skleněná kulička k promíchání krve. Krev musí být nabrána bez vzduchových bublin. I malé množství vzduchu je nutno okamžitě vypudit. Krev s ponechanými vzduchovými bublinami je pro vyšetření parametrů ABR nevhodná. Přítomnost vzduchu snižuje výsledky vyšetření pCO2, zvyšuje pO2 a posunuje pH na alkalickou stranu. Kapilární (arteriolární) odběr se provádí z ušního lalůčku nebo z bříšek prstů, u kojenců z patičky po předchozí hyperemizaci. Rozšíření arteriol lze dosáhnout použitím hyperemizačních mastí, jako např. Finalgon, nebo působením tepla. Z hlubokého vpichu sterilní lancetkou po předchozí desinfekci povrchu odebíráme krev do heparinizovaných kapilár. Krev odebíráme bez vymačkávání (příměs krve z venul a přítomnost lymfy není žádoucí). Sloupec krve v kapiláře nesmí být přerušen vzduchovou bublinou. Do kapiláry vložíme krátký drátek z nerez oceli, kapiláru uzavřeme plastikovými uzávěry a pomocí magnetu, kterým pohybujeme podél kapiláry, promícháme krev, aby se v ní rozpustil vysušený heparin ze stěn kapiláry. Sraženou krev nelze vyšetřit!
Arteriální krev vyšetřujeme u pacientů, kde se z různých důvodů liší výrazně složení arteriální krve od krve arteriolární. K takovým rozdílům dochází zejména u pacientů s centralizací oběhu, kde výsledky vyšetření kapilární krve poskytují informace o poměrech ve tkáni, odkud byla krev odebrána, nelze je však vztahovat na celý organismus. Rovněž při posuzování hodnot pO2 je výhodnější vyšetření arteriální krve, neboť hodnoty v krvi kapilární jsou vždy poněkud nižší než hodnoty systémové.
Vyšetření se musí provést co nejdříve po odběru. Nastane-li z technických důvodů prodleva, je nutno odebranou krev uchovávat ve vodní lázni s ledem (nezmrazovat!), a to maximálně 2 hodiny od odběru. Déle skladovaný vzorek nemá smysl posílat do laboratoře a měřit.
Acidobazické analyzátory, tj. analyzátory pH a krevních plynů, jsou dodnes často nazývané podle jednoho z prvních autorů "Astrup". Jsou to složité přístroje, které pomocí elektrod umožňují přesné měření základních parametrů ABR, t.j. pH, pCO2 a pO2. Ostatní parametry jsou kalkulovány podle softwarového vybavení analyzátoru na bázi Hendersonovy-Hasselbalchovy rovnice. Modernější analyzátory umožňují kromě stanovení základních parametrů ještě stanovení koncentrace Hb, OxyHb a dalších derivátů hemoglobinu. Tato stanovení jsou základem pro výpočet ostatních parametrů, které jsou důležité pro posouzení oxygenace organismu.
3.1.1. Parametry a výpočty, používané při hodnocení poruch ABR
3.1.1.1.pH arteriální krve u dospělých: 7.400 ± 0.040
3.1.1.2. pCO2: 5.35 kPa ± 0.5
3.1.1.3. Koncentrace standardních hydrogenkarbonátů
Je to koncentrace hydrogenkarbonátů v 1 litru krve za standardních podmínek (37 °C, plně okysličená krev, pCO2 = 5.35 kPa). Referenční rozmezí je 24.0 + - 2.0 mmol/l. Podle koncentrace standardních hydrfogenkarbonátů lze posuzovat kvalitu hydrogenkarbonátového nárazníkového systému krve.
3.1.1.4. Koncentrace aktuálních hydrogenkarbonátů
Je to koncentrace hydrogenkarbonátů v 1 l plně okysličené krve, při
37 °C, při aktuálním pCO2, které pacient skutečně má v okamžiku odběru. Hodnoty referenčního rozmezí se kryjí s hodnotami standardních hydrogenkarbonátů. Je-li pCO2 vyšší než 5.35 kPa, pak i koncentrace aktuálních hydrogenkarbonátů je vyšší než koncentrace standardních hydrogenkarbonátů a naopak. Koncentrace aktuálních hydrogenkarbonátů ukazuje na aktuální stav hydrogenkarbonátového nárazníkového systému pacienta.
3.1.1.5. BE (Base excess, přebytek bazí), BD (Base deficit, nedostatek bazí)
BE v mmol/l udává o kolik je v 1 litru plné a plně okysličené krve , při 37°C, při pCO2 5.35 kPa více bazí než má být, aby pH této krve bylo 7.400. Nedostatek bazí bývá označován zpravidla jako BD nebo také jako záporný BE. Pro BD platí, že jde o mmol/l kyseliny, které přebývají a proto mluvíme o deficitu bazí. Referenční rozmezí je od + 2.5 do - 2.5 mmol/l. Používají se při výpočtech dávek korekčních roztoků. Při úpravě BE nebo BD na hodnotu 0 dosáhneme pH 7.400 jen tehdy, je-li pCO2 rovno 5.35 kPa. Nulový BE při pCO2 nižším než 5.35 vede k alkalémii, při pCO2 vyšším k acidémii.
3.1.1.6. Parciální tlak kyslíku (pO2)
U vyšetření ABR je parciální tlak O2 běžně udáván spolu s ostatními parametry. I když sám o sobě není přímo údajem o ABR, jeho hodnota má pro posuzování poruch acidobazické rovnováhy velký význam. Snížený pO2 vede k úvaze o možnosti tkáňové hypoxemické metabolické laktátové acidozy, i když ani normální hodnota pO2 tuto možnost nevylučuje. Referenční rozmezí: 9.3 - 15.5 kPa. Rozmezí je závislé na věku, u starších osob se hodnoty fyziologicky snižují. Pro vyšetření pO2 je vhodný odběr arteriální krve, případně odběr z dobře hyperemizovaného ušního lalůčku. Odběr z bříška prstu není vhodný pro nestardandně falešně nižší hodnoty.
3.1.2. Parametry umožňující posouzení smíšených poruch ABR
3.1.2.1. Buffer base séra = BBS
BBS = (Na+ + K+) - Cl-
BBS hodnotí vztah mezi hlavními kationty a Cl- aniontem. Zvýšená hodnota BBS svědčí o relativním poklesu Cl- a tím o zvýšení podílu hydrogenkarbonátů ve sloupci aniontů - tedy o přítomnosti složky metabolické alkalózy. Snížená hodnota BBS ukazuje na relativní hyperchlorémii vedoucí z důvodů elektroneutrality ke snížení koncentrace hydrogenkarbonátů a k hyperchloremické metabolické acidóze. Referenční rozmezí: 42 ± 2 mmol/l.
3.1.2.2. Anion gap, AGAP - aniontová mezera
AGAP = (Na+ + K+) - (Cl- + HCO3-)
Anion gap prakticky odpovídá součtu koncentrací [RA + plazmatické bílkoviny]. Zvýšená hodnota AGAP svědčí o přítomnosti metabolické složky acidózy. Nevýhodou při používání parametru AGAP je, že mění-li se koncentrace bílkoviny a RA protichůdně, celková hodnota AGAP se nemění, přestože může být přítomna změna ABR. Referenční rozmezí = 18 ± 2 mmol/l.
3.1.2.3. RA - Reziduální anionty
RA = (Na+ + K+ + Ca++ + Mg++) - (Cl- + HCO3- + proteiny)
Hodnota reziduálních aniontů odpovídá koncentraci aniontů organických i anorganických kyselin. Použije-li se k výpočtu koncentrace RA koncentrace albuminu místo koncentrace celkových proteinů, respektive počítáme-li s jejich náboji, potom je referenční rozmezí 8 + - 2 mmol/l. Zvýšená hodnota reziduálních aniontů svědčí o podílu metabolické acidózy.
4. Reakce organismu směřující k udržení stálého pH
Poruchy ABR se dělí co do původu na poruchy metabolické a respirační. U poruch metabolických se primárně mění nezávisle proměnné veličiny SID a Atot a sekundárně koncentrace HCO3- a pH. U respiračních se primárně mění pCO2, koncentrace HCO3- zůstává prakticky nezměněna a mění se pH. Reakce organizmu na poruchy ABR směřují k zachování stálého pH a lze je rozdělit na
1) nárazníkové reakce,
2) kompenzační reakce,
3) korekční reakce.
4.1 Nárazníkové reakce
Probíhají jako bezprostřední reakce organismu na vzniklou poruchu. Jejich kapacita je limitována a trvá-li příčina poruchy déle, nárazníková schopnost krve se vyčerpá a dochází k výraznějším změnám pH.
4.2 Kompenzační reakce
Kompenzační reakce jsou vždy zajišťovány orgány nepostižené složky, tj. u poruch respiračních ledvinami, u poruch metabolických plícemi a směřují k udržení pH. Jejich dynamika se liší. Kompenzační reakce zajišťované ledvinami se rozvíjejí postupně, maxima účinnosti dosahují do 5 dnů a po odeznění příčiny vyvolávající poruchu stejně dlouho odeznívají. Plíce kompenzují poruchu tak, že maxima účinnosti je dosaženo do 24 hodin od začátku poruchy a stejně dlouho trvá návrat k normě po odeznění.
4.2.1. Kompenzační reakce ledvin při respirační acidóze
1) Ve zvýšené míře se resorbuje a generuje HCO-
2) Zvyšuje se vylučování H+
a) Volný H+ (malé množství) - pH moči neklesá pod pH 4.4
b) Jako NH4+, který vzniká v buňkách tubulů. Co do kapacity jde o nejúčinnější mechanismus.
c) Jako H2PO4-, titrovatelná acidita moče.
3) Zvýšeně se resorbují Na+ a zvýšeně se vylučují Cl- jako (teoreticky) NH4Cl.
4.2.2. Kompenzační reakce ledvin při respirační alkalóze
1) Zvyšuje se vylučování HCO3- a snižuje se jeho tvorba.
2) Klesá vylučování H+ ve formě NH4+ a titrovatelné acidity moče.
4.2.3. Kompenzační reakce plic u metabolické acidózy
Zvýšeným drážděním dechového centra při metabolické acidóze dochází k hyperventilaci. Sníží se pCO2 v alveolárním vzduchu a tím i v arteriální krvi. Snížením koncentrace respirační komponenty Hendersonovy-Hasselbalchovy rovnice dochází k úpravě pH.
4.2.4. Kompenzační reakce plic u metabolické alkalózy
Organismus reaguje hypoventilací a zvýšením pCO2. V důsledku hypoventilace klesá i pO2, což je limitující faktor kompenzace, protože hypoxémie působí stimulačně na dechové centrum a další zvyšování pCO2 není možné.
4.3 Korekční reakce
Přicházejí v úvahu prakticky jen u metabolických poruch za předpokladu, že příčinou poruchy není onemocnění ledvin. Upravují koncentraci primárně změněné složky. U respiračních poruch je postižení funkce plic z různých důvodů vždy příčinou poruchy a nelze tedy o korekci plícemi uvažovat.
4.3.1. Korekce u metabolické acidózy
Intenzivní vylučování H+ všemi již dříve popsanými mechanismy. Retence HCO3- u některých typů metabolické acidózy.
4.3.2. Korekce u metabolické alkalózy
Stoupá vylučování HCO3- ledvinami, moč je alkalická. Je-li zároveň s metabolickou alkalózou přítomna i hypovolémie, objevuje se zvýšená zpětná resorbce Na+, za které je v distálním tubulu secernován H+ a K+ a moč může být paradoxně kyselá.
K orientaci je vhodný záznamový list acidobazické regulace dle Engliše a Kazdy (Obr. 3.5). Zobrazuje jednak pásma hodnot základních akutních poruch ABR:
aMAC - akutní metabolická acidóza
aMAL - akutní metabolická alkalóza
aRAC - akutní respirační acidóza
aRAL - akutní respirační alkalóza
Kromě pásem hodnot akutních poruch jsou zde vyznačena pásma hodnot ustálených poruch, kam se dostane 95 % pacientů s jednoduchými základními poruchami po rozvinutí všech kompenzačních a korekčních mechanismů. Graf umožňuje jednoduchý záznam změn parametrů ABR, posouzení kompenzačních a korekčních dějů. Vede nás případně k podezření na přítomnost některých smíšených poruch a umožňuje přibližný odhad terapeutických dávek vzhledem k BE a pCO2.
5. Jednoduché poruchy ABR
5.1 Metabolická acidóza
Příčinou metabolické acidózy může být snížení SID nebo zvýšení Atot. Můžeme rozlišovat metabolickou acidózu:
1. Hyperchloremickou
2. Z nadprodukce RA nebo z jejich zhoršeného vylučování.
5.1.1 Hyperchloremická metabolická acidóza
Laboratorně se projeví snížením BBS, zatímco AG a RA jsou v referenčních mezích. Vyskytuje se při ztrátách HCO3- a Na+ gastrointestinálním traktem, při průjmech, při píštěli, při odsávání pankreatické sekrece a žluči, kde je koncentrace HCO3- vysoká. Pankreatická sekrece reprezentuje cca 2000 ml/24 h. s koncentrací HCO3- až 120 mmol/l. Může se objevit také po ureterosigmoideostomii, kdy se ve střevě zvyšuje zpětná resorpce Cl- a sekrece HCO3-.
Vyskytuje se při renálních ztrátách HCO3- a Na+, bez ekvivalentní ztráty Cl-. Např. podávání inhibitorů karboanhydrázy (Acetazolamid /Diluran/ používaný při léčbě glaukomu) inhibuje aktivitu karboanhydrázy buněk renálních tubulů a kartáčových lemů v tubulech. Inhibicí karboanhydrázy vázne resorbce HCO3-, Na+ a K+. Více se zpětně resorbují chloridy, což vede ke vzniku hyperchloremické acidózy. Při renální tubulární acidóze (RTA) proximální i distální se rozvíjí rovněž hyperchloremická acidóza. O RTA podrobněji v kapitole o ledvinách. Hyperchloremickou MAC způsobuje též podávání HCl nebo látek obsahujících Cl-, např. NH4Cl, arginin nebo lysin hydrochlorid, používaných k acidifikaci. Po zmetabolizování amoniaku, argininu nebo lysinu zůstává v organismu nadbytek Cl-. Stejný účinek má perorální podávání některých dalších látek, jako CaCl2, MgCl2, cholestyraminu.
Z ostatních příčin MAC: při rychlé expanzi extracelulární tekutiny, přívodem tekutiny , která neobsahuje HCO3-, dojde ke snížení koncentrace bikarbonátu a tím k diluční acidóze. Korekce ledvinami následuje velmi rychle.
5.1.2 Metabolická acidóza z nadprodukce reziduálních aniontů nebo z jejich zhoršeného vylučování
Laboratorně: zpravidla nalézáme zvýšenou hodnotu AG a zvýšenou hodnotu RA. Vyskytuje se při diabetické ketoacidóze. Příčinou je zvýšená produkce kyseliny acetoctové a beta hydroxymáselné. Občas je diagnóza diabetické ketoacidózy ztížena tím, že nemusí být vždy přítomna výrazná hyperglykémie. Až 15% pacientů s diabetickou ketoacidózou má koncentraci glukózy v krvi nižší než 19 mmol/l. Kvalitativní zjišťování přítomnosti acetoctové kyseliny v krvi může být negativní nebo jen slabě pozitivní, protože dominuje kyselina beta hydroxymáselná, která nedává pozitivní reakci s činidly na bázi nitroprussidu. Někteří pacienti mohou mít normální hodnotu AG. Metabolická acidóza tohoto typu se rozvíjí také při ketoacidóze z hladovění, kde stoupá produkce ketokyselin v játrech a jejich utilizace ve tkáních je snížena, nebo při laktátové acidóze.
Podle vzniku rozlišujeme 2 druhy laktátové acidózy:
- Typ A laktátové acidózy podmíněný nedostatečnou oxygenací na úrovni mitochondrií. Zvýšená koncentrace laktátu je způsobena jak zvýšením jeho produkce, tak sníženým metabolizováním v játrech a ledvinách, kde je obvykle za normálního stavu konvertován na pyruvát a použit buď v glukoneogeneze nebo metabolizován aerobní cestou v Krebsově cyklu. Příčinou laktátové acidózy typu A jsou stavy, kdy vázne dodávka O2 do tkání - kardiogenní, hemoragický, hypovolemický, septický šok, selhání levé komory srdeční, mezenteriální vaskulární insuficience (zvýšená produkce laktátu tenkým střevem). Při klinickém podezření na laktátovou acidózu je třeba vyšetřit koncentraci laktátu, nejlépe v arteriální krvi. Referenční rozmezí koncentrace laktátu je 0.3 - 1.3 mmol/l. Jako závažný stav hodnotíme laktátovou acidózu, kde koncentrace laktátu je vyšší než 5 mmol/l a pH menší nebo rovno 7.250. Kazda se Zítkem sledovali prognostický význam koncentrace laktátu v šokových stavech a zjistili přímou závislost mortality na koncentraci laktátu.
- Typ B laktátové acidózy. Je vyvolán podáním celé řady látek, které zasahují na různých úrovních metabolismu. Působí buď na úrovni mitochondriální membrány nebo inhibicí aktivity některých enzymů. Při intenzivním metabolismu některých substrátů, které mají ve svých degradačních drahách NAD - dependentní kroky, jako např. sorbitol, fruktóza, etanol, stoupá poměr NADH : NAD+, a to vede ke snížení glukoneogeneze a sníženému odbourávání laktátu v játrech. Při podávání např. biguanidinových antidiabetik dochází k vystupňování metabolismu glukózy v cytosolu a k zásahu do respiračního řetězce na úrovni mitochondriálních membrán. Kongenitální laktátová acidóza typu B je podmíněna vrozenými defekty v glukoneogenezi, ev. defektem v oxidaci pyruvátu.
Laktátová acidóza typu B vzniká:
- Podáním toxických dávek biguanidinových antidiabetik,
salicylátů, Na-nitroprussidu.
- Podáním fruktosy a sorbitolu i.v.
- U otrav etanolem, metanolem, kyanidy, etylenglykolem, INH, CO, strychninem
- U diabetu, u některých maligních tumorů, u některých vrozených metabolických vad
- U respirační alkalózy
Alkoholická acidóza
Jde buď o laktátovou acidózu nebo o ketoacidózu, případně o oba typy acidózy společně. U alkoholiků se jedná velmi často o smíšenou poruchu ABR, na jejímž vzniku se podílí jak laktátová acidóza, tak ketoacidóza z nedostatečného příjmu potravy. Hyperventilace a zvracení působí protichůdně a mohou vyvolat zároveň alkalózu respirační a metabolickou.
Otrava salicyláty
Požití větších dávek salicylátů vede, kromě jiného, i k metabolické acidóze. Na vzniku acidózy se podílejí kyseliny salicylová, mléčná a některé další kyseliny vznikající působením kyseliny salicylové. Porucha ABR, která při intoxikaci salicyláty vzniká, je vždy smíšená (MAC + RAL).
Otrava metanolem a etylenglykolem
K podezření na otravu metanolem nebo etylenglykolem nás vede metabolická acidóza s hodnotou AG vyšší než 50 mmol/l. Metanol se pomalu oxiduje na kyselinu mravenčí cca 12 - 18 hodin po požití. Kyselina mravenčí působí toxicky zásahem do aerobního metabolismu a vede ke zmnožení organických kyselin včetně kyseliny mléčné. Při intoxikaci etylenglykolem je konečným produktem jeho degradace kyselina šťavelová. Acidóza jde na vrub kumulace této kyseliny. U otrav metanolem a etylenglykolem záleží velice na časné diagnóze, protože včasný terapeutický zásah může minimalizovat toxické poškození organismu a zabránit i rozvoji metabolické acidózy.
Acidóza při renálním selhání - akutním nebo chronickém
Neschopnost ledvin vylučovat denní produkci silných kyselin, respektive jejich aniontů (HSO4- a H2PO4-) způsobuje metabolickou acidózu se zvýšenými hodnotami AG a RA. Na regulaci metabolické acidózy při renálním selhání se výrazně podílí pufrovací kapacita kostního minerálu.
5.2 Metabolická alkalóza
Příčinou metabolické alkalózy může být buď zvýšení SID nebo pokles Atot. V obou případech se zvyšuje koncentrace HCO3-, hodnota pCO2 se nemění a pH se zvyšuje.
5.2.1 Ztráty Cl- bez odpovídajících ztrát silných kationtů.
a) Zvracení kyselého žaludečního obsahu, eventuálně odsávání kyselého žaludečního obsahu sondou. Za 24 hodin se v žaludeční šťávě odčerpá přibližně 40 až 160 mmol Na+, 15 mmol K+, 200 mmol Cl-, 25 až 100 mmol H+. Při zvracení nebo odsávání žaludečního obsahu jsou ztráty Cl- vyšší než ztráty Na+. Hypokalémie je způsobena spíše zvýšeným vylučováním K+ močí, než ztrátou žaludečního obsahu (sekundární hyperaldosteronismus ze sníženého objemu ECT).
b) Léčba diuretiky. Většina diuretik, která působí v oblasti vzestupného raménka (Furosemid, etacrinová kyselina, thiazidová diuretika), způsobují zvýšené vylučování Cl- a H+.
c) Zvýšené ztráty Cl- stolicí. U vrozených chloridy ztrácejících průjmů, dále u pacientů s adenomatózou tlustého střeva, obsahuje někdy stolice větší množství bílkovin, Na+, K+, ale hlavně Cl-.
d) Primární hyperaldosteronismus. Zvýšená sekrece aldosteronu vede ke zvýšené resorbci Na+, zvýšené sekreci H+ a K+, a k výrazně vyššímu vylučování Cl-. Výskyt metabolické alkalózy, hypokalémie a hypertenze bez známek deplece ECT vedou k podezření na hyperaldosteronismus.
e) Bartterův syndrom. Výskytuje se zpravidla u dětí, je způsoben zvýšenou hladinou reninu a aldosteronu při hyperplazii juxtaglomerulárního aparátu,a je charakteristický metabolickou alkalózou a hypokalémií bez hypertenze. Do jaké míry se na vzniku Bartterova syndromu podílí zvýšená produkce prostagladinů v ledvinách není jasné, avšak v řadě případů se osvědčila terapie inhibitory produkce prostaglandinů (indometacin). Pseudo Bartterův syndrom - převážně u dospělých, se projevuje trvající metabolickou alkalózou a hypokalémií nejasného původu.
f) Cushingův syndrom. Při nadprodukci glukokortikoidů, ale i mineralokortikoidů dochází k rozvoji mírné metabolické alkalózy a hypokalémie podobně jako u hyperaldosteronismu. Výraznou alkalózu a hypokalémii nacházíme u syndromu ektopické sekrece ACTH. Je to přičítáno silně zvýšené produkci deoxykortikosteronu a kortikosteronu.
g) Podávání preparátů z lékořice. Lékořice obsahuje látky, mající podobný účinek jako aldosteron. Vyvolávají hypertenzi, metabolickou alkalózu a hypokalémii.
5.2.2 Zisk Na+ bez odpovídajícího zisku Cl-
a) Podávání NaHCO3 perorální, či parenterální. Při jednorázovém podání NaHCO3 ledviny velmi rychle vyloučí nadbytek hydrogenkarbonátů. Pouze trvalý přívod vede ke zvýšení jejich koncentrace a k metabolické alkalóze. U zdravého jedince při podávání větších dávek perorálně je vzestup koncentrace plazmatických hydrogenkarbonátů poměrně malý a to o 0.26 mmol/l pro 1 mmol hydrogenkarbonátu/kg hmotnosti/24 hodin. U pacientů s renální insuficiencí je snížena schopnost vylučování hydrogenkarbonátů a plazmatická koncentrace při perorálním podání stoupá výrazněji.
b) Parenterální podání solí organických kyselin. Na-acetát, Na-laktát, event. masivní transfúze krve s Na-citrátem jako antikoagulačním činidlem. Po zmetabolizování organických kyselin se zvětší SID, stoupne koncentrace hydrogenkarbonátů a projeví se metabolická alkalóza.
c) Náhlá úprava metabolické poruchy a metabolizace nahromaděných aniontů. Např. úprava diabetické ketoacidózy event. laktátové acidózy.
d) Podání velkých dávek solí léků jako např. Carbenicillin, PNC
e) Hyperkalcémie - ne při hyperparathyreóze. Hyperkalcémie při kostních metastázách nebo při myelomu je provázena alkalózou mírného stupně, která je připisována uvolňování nehydrogenkarbonátových nárazníků z kosti. U hyperparathyreózy se naopak působením parathormonu, který tlumí resorbci hydrogenkarbonátů v ledvinách, rozvíjí mírná acidóza, navzdory jeho destruktivnímu působení na kostní strukturu.
f) Koncentrační alkalóza, při zmenšení objemu ECT bez ztráty bazí.
5.2.3 Metabolická alkalóza ze snížení Atot
Prakticky jde o stavy se sníženou koncentrací proteinů nebo samotného albuminu v krvi. Uvádí se, že pokles koncentrace albuminu o 10 g/l vede k vzestupu koncentrace HCO3- o 3 mmol/l. K poklesu koncentrace bílkovin plazmy dochází při zvýšených ztrátách, zejména GIT, při jejich nedostatečné syntéze a při vystupňovaném katabolismu.
5.3 Respirační acidóza
Rozlišujeme akutní a chronickou respirační acidózu. Respirační acidóza je stav, který vzniká nerovnováhou mezi produkcí CO2 ve tkáních a jeho nedostatečným vylučováním v plicích. Denní produkce CO2 je přibližně 13000 - 15000 mmolů a stejné je i jeho vylučování plícemi. Při snížené účinnosti plicní exkrece CO2 stoupá pCO2 v alveolárním vzduchu, až se ustálí nová rovnováha mezi tvorbou a vylučováním. Se zvýšením pCO2 v alveolárním vzduchu se zvyšuje i pCO2 v krvi a klesá pH. Koncentrace hydrogenkarbonátů se sníží nepatrně.
5.3.1 Akutní respirační acidóza
Akutní nástup hyperkapnie je vždy provázen hypoxemií s určitým podílem laktátové acidózy. Podle druhu a stupně poruchy, která vyvolala akutní stav, objeví se u pacienta příznaky dechové tísně - neklid, tachypnoe, dyspnoe. Horší-li se stav, dochází až ke stuporu a kómatu. Příčiny akutní respirační acidózy můžeme rozdělit do několika skupin.
- Obstrukce dýchacích cest: laryngospasmus, bronchospasmus, aspirace cizího tělesa, aspirace zvratků, edém laryngu.
- Neuromuskulární příčiny: poškození mozkového kmene nebo prodloužené míchy s útlumem dechového centra, syndrom Guillan-Barré, myasthenia gravis, botulismus, tetanus, předávkování sedativy a narkotiky.
- Redukce dýchací plochy: pneumothorax, hemothorax, masivní pneumonie, těžký plicní oedém.
- Poruchy cirkulace: masivní plicní embolie.
- Špatně prováděná umělá ventilace.
5.3.2 Chronická respirační acidóza
Je způsobena chronickým snížením efektivní alveolární ventilace se vzestupem pCO2. V organismu dochází při trvající poruše k renální kompenzaci, která se rozvíjí a dosahuje maxima do 5 dnů. V rámci adaptace dochází k retenci Na+ a HCO3- a zvýšenému vylučování Cl2 nad 9 kPa dochází k jeho útlumu. Jako stimulační podnět působí v této fázi hypoxémie.
Příčin chronické respirační acidózy může být celá řada, většina z nich však postihuje plíce, resp. plicní ventilaci:
- nejčastější a nejobvyklejší příčinou chronické respirační acidózy je chronická obstruktivní choroba bronchopulmonální,
- chronické předávkování sedativy s následnou depresí dechového centra,
- primární alveolární hypoventilace,
- Pickwickův syndrom,
- neuromuskulární postižení - poliomyelitis, myopatie, roztroušená skleróza, paralýza bránice,
- anatomická postižení hrudníku omezující ventilaci - kyfoskolióza, hydrothorax, fibrothorax,
- další příčiny: terminální stádia intersticiální plicní fibrózy.
U pacientů v ustálené chronické respirační acidóze může nastat náhle změna, sníží-li se rychle a výrazně schopnost odventilovat CO2. Např. u chronické bronchitidy ataka akutního infektu, kdy se pCO2 zvýší na novou vyšší hladinu. Pokles pH, který nastane, není úměrný vzestupu pCO2, jak tomu bývá u akutní respirační insuficience. Organismus plně adaptovaný na chronickou respirační acidózu má poměrně vysokou koncentraci bikarbonátů a dále reaguje promptně renální kompenzací, resp. zvýšeným vylučováním H+.
5.4 Respirační alkalóza
Vzniká, poklesne-li pCO2 v alveolárním vzduchu. K poklesu pCO2 dochází, když převládá exkrece CO2 plícemi nad jeho produkcí ve tkáních. Protože produkce CO2 ve tkáních je relativně konstantní, je pokles pCO2 primárně způsobován hyperventilací. K hyperventilaci může vést zvýšená neurochemická stimulace centrálními nebo periferními nervovými vlivy, hyperventilace při řízené ventilaci nebo vědomá hyperventilace pacienta. Nárazníková reakce u respirační alkalózy probíhá velmi rychle, aby se zabránilo výraznému vzestupu pH na hodnoty, které by mohly ohrozit životní funkce organismu. 99 % H+ pochází z nitrobuněčných zdrojů, tj. z laktátu a z organických kyselin, jejichž koncentrace v buňkách stoupá díky sníženému přísunu O2 (posun disociační křivky Hb doleva při alkalóze).
Příčiny respirační alkalózy:
- Centrální stimulace dechového centra při strachu, bolesti, horečce, v těhotenství, při traumatech hlavy, mozkových tumorech, krvácení do CNS. Z léků vyvolávají hyperventilaci zejména salicyláty.
- Stimulace dechového centra z periferie. Plicní embolizace (menšího rozsahu nebo sukcesivní), městnavá slabost srdeční, intersticiální plicní fibróza, pneumonie, pobyt ve velké výšce.
- U pacientů s cirhózou mohou být příčinou zmnožené plicní zkraty, ev. zvýšená koncentrace amoniaku. U gramnegativní sepse a některých forem šoku patří respirační alkalóza k časným příznakům.
- Při umělé ventilaci se může nesprávným nastavením přístroje způsobit pokles pCO2 a respirační alkalóza.
Výrazná alkalémie způsobuje poruchu srdečního rytmu a díky poklesu koncentrace ionizovaného Ca i zvýšenou neuromuskulární dráždivost s tendencí ke křečím.
6. Smíšené poruchy ABR
Vyskytují se poměrně často. Jde o kombinaci dvou nebo více základních poruch nebo o více příčin, které vyvolávají tutéž poruchu ABR. Při hodnocení smíšených poruch je třeba vycházet z komplexního hodnocení anamnézy, fyzikálního nálezu a všech potřebných laboratorních vyšetření, ne pouze z hodnocení výsledků vyšetření parametrů ABR.
Nejčastější smíšené poruchy ABR jsou:
- respirační acidóza a metabolická alkalóza,
- respirační acidóza a metabolická acidóza,
- respirační alkalóza a metabolická acidóza,
- respirační alkalóza a metabolická alkalóza,
- metabolická acidóza a metabolická alkalóza.
6.1 Respirační acidóza a metabolická alkalóza
U pacientů s chronickým plicním onemocněním, kde je rozvinutá ustálená respirační acidóza, se může objevit městnavá srdeční slabost (dekompenzované cor pulmonale). Podání diuretik způsobí zvýšenou ztrátu Cl-, zvětšení SID a následné zvýšení koncentrace HCO3- v míře větší, než odpovídá ustálené respirační acidóze. Rovněž ztráta kyselého žaludečního obsahu při zvracení přispívá u těchto pacientů k rozvoji metabolické alkalózy.
Metabolickou alkalózu můžeme ovlivnit podáním roztoků s NaCl a KCl, musíme však přihlédnout k možné retenci tekutin při ne zcela optimální činnosti srdce a dávkovat opatrně. Ovlivní se složka metabolické alkalózy, pCO2 ale zůstává nezměněno.
Laboratorně zjišťujeme zvýšené pCO2, BE, BBS. Pokud není výraznější hypoxemická laktátová acidóza, RA a AGap se nemění. Hodnota pH se mění podle toho, zda převládá metabolická alkalóza nebo respirační acidóza.
6.2 Respirační acidóza a metabolická acidóza
Tato smíšená porucha se nejčastěji rozvíjí u pacientů se zástavou srdeční, kteří vyžadují kardiopulmonální resuscitaci, u pacientů s těžkým plicním edémem a u pacientů s metabolickou acidózou, kde dojde k selhání plicních funkcí. U pacientů se zástavou srdeční jde o kombinaci respirační acidózy a metabolické hypoxemické tkáňové laktátové acidózy.
Laboratorně nalézáme snížení pH, BE, BBS. Zvýšeny jsou pCO2, RA, AGap a koncentrace laktátu.
6.3 Respirační alkalóza a metabolická acidóza
Tuto kombinaci vídáme u pacientů s hepatálním selháním. Složka respirační alkalózy je podmíněna hyperventilací z dráždění dechového centra, složka metabolické acidózy buď renálním selháváním nebo renální tubulární acidózou, případně laktátovou acidózou ze sníženého metabolizování laktátu v poškozených játrech. Dále u pacientů s chronickým renálním selháním s metabolickou acidózou, kteří při nasedající uroinfekci s bakteriémií hyperventilují. Otrava salicyláty vyvolává také smíšenou poruchu ABR typu respirační alkalózy (toxické dráždění dechového centra) a metabolické acidózy (jednak působením salicylové kyseliny, jednak mechanismem laktátové acidózy typu B).
Laboratorně se zjišťuje výsledek stanovení pH zpravidla okolo normálních hodnot, snížené jsou BE, pCO2 a BBS, zvýšené RA a AGap.
6.4 Respirační alkalóza a metabolická alkalóza
Kombinace respirační a metabolické alkalózy se nejčastěji objevuje u pacientů s cirhózou, kteří hyperventilují, jsou léčeni diuretiky (ascites, edémy), jsou hypoproteinemičtí (pokles Atot) a případně zvrací. Může se také vyvinout u pacientů s chronickou respirační acidózou s rozvinutými kompenzačními ději se zvýšenou koncentrací bikarbonátu v krvi, kteří jsou náhle a prudce ventilováni s výrazným poklesem pCO2.
Laboratorně: Vyšší pH, BE, BBS, snížené pCO2.
6.5 Metabolická acidóza a metabolická alkalóza
Jsou to poruchy působící proti sobě ve všech parametrech. Např. protrahované zvracení, které vyvolá metabolickou alkalózu a vede k hypovolémii a hypotenzi, které podmíní rozvoj metabolické acidózy z renálního selhání a event. tkáňovou laktátovou acidózu ze snížené perfuze a nedostatku O2. Přítomnost složek metabolické acidózy a alkalózy se snažíme diagnostikovat z klinického průběhu a z laboratorních parametrů a to zejména z BBS, AGap a RA. Pochopitelně může dojít i ke kombinaci více než dvou základních poruch: např. stav pacienta s metabolickou a respirační alkalózou při jaterním selhání se může komplikovat selháním renálním s metabolickou acidózou.
Diferenciální diagnostika kombinovaných poruch ABR je složitá. U celé řady pacientů i při posouzení všech parametrů a přihlédnutí ke klinickému průběhu je zpravidla zatížena mnoha omyly.
7. Terapie poruch ABR
Obecné zásady terapie poruch ABR:
Terapie musí být především kauzální, to znamená odstranit příčinu, která poruchu ABR vyvolává. Musí být komplexní, neupravuje pouze pH, ale celé vnitřní prostředí. Pokud nelze vyvolávající příčinu odstranit, snažíme se upravit hodnotu pH krve k hodnotám optimálním. Řídíme se přitom zásadou, že organismu, který je adaptován na určité pH, prudká změna pH spíše uškodí než prospěje. Při úpravě pH je nutno počítat se stupněm rozvinutí kompenzačních a korekčních dějů a s předpokládanou dobou jejich trvání.
7.1 Látky používané k alkalizační terapii
Působí zvýšení koncentrace hydrogenkarbonátů, buď jejich přímým podáním, nejčastěji ve formě roztoku hydrogenkarbonátu sodného nebo podáním roztoků, které obsahují sodné či draselné soli organických kyselin. Po zmetabolizování organických aniontů zůstává v nadbytku silný kation a dojde ke zvětšení SID.
Z důvodů elektroneutrality se generuje hydrogenkarbonát a jeho koncentrace v krvi se zvýší.
Roztoky NaHCO3
8.4 % roztok hydrogenkarbonátu sodného je roztok jednomolární, to znamená, že v 1 ml roztoku je 1 mmol NaHCO3 a 4.2 % roztok hydrogenkarbonátu je tedy 0.5 molární, v 1 ml roztoku je 0.5 mmol NaHCO3. Oba roztoky jsou výrazně hyperosmolární, proto se přidávají k hypotonickým ev. isotonickým infuzním roztokům. Při podávání větších dávek hydrogenkarbonátu sodného je třeba mít na zřeteli, že organismu dodáváme i nezanedbatelné množství Na. V poslední době se na základě experimentů na zvířatech i lidech dochází k názoru, že podání NaHCO3 vyvolává intracelulární acidózu, která vzniká proto, že podaný hydrogenkarbonát je titrován protony na H2CO3, která dává vznik CO2 a H2O. Za normálních podmínek perfuze tkání a za normální plicní ventilace je vzniklý CO2 z organismi odstraňován. Vázne-li ale perfuze nebo plicní ventilace, dochází k hromadění CO2 a intracelulární acidóze. Větší dávky NaHCO3 podané i.v. v akutních stavech vedou navíc ještě k hyperosmolalitě. Z těchto důvodů se názory na podávání hydrogenkarbonátů v akutních stavech liší. Někteří jeho podání nedoporučují, jiní jej naopak podávají k úpravě pH extracelulární tekutiny.
THAM (tris-[hydroxymetyl]-aminometan)
3.64 % roztok je izotonický a obsahuje v 1000 ml 300 mmol báze. Působí intracelulárně, váže H+ z H2CO3 a tím zvyšuje koncentraci hydrogenkarbonátu. Někdy vyvolává útlum dechového centra. Pomaleji se vylučuje z organismu. Při aplikaci THAMu je třeba mít možnost případné řízené ventilace pro přechodný útlum dechového centra. Popisovány bývají i přechodné hypoglykémie.
Roztoky solí organických kyselin
Na-laktát, Na, K-citrát, event. acetát působí alkalizačně jen tehdy, jsou-li předpoklady pro zmetabolizování aniontu organické kyseliny.
7.2 Látky používané k acidifikaci
K úpravě metabolické alkalózy používáme acidifikující roztoky. U většiny těchto roztoků se dodává v nadbytku Cl-, tím dochází ke zmenšení SID a ekvivalentnímu poklesu koncentrace hydrogenkarbonátů.
Izotonický roztok NaCl (fyziologický roztok)
Obsahuje 154 mmol/l Na+ a 154 mmol/l Cl-. Poměr Na:Cl je 1:1, zatímco v plazmě je tento poměr 1,4:1. Izotonický roztok NaCl obsahuje ve srovnání s plazmou relativní nadbytek Cl-. 1000 ml fyziologického roztoku je ekvivalentní 53 mmol Cl, tedy stejnému množství kyseliny. Kromě toho neobsahuje žádný hydrogenkarbonát, to znamená, že na 1000 ml schází ještě 24 mmol HCO3-. Dilucí stávající koncentrace hydrogenkarbonátů, při prakticky okamžité ekvilibraci CO2 působí též acidifikačně.
Chlorid amonný - NH4Cl
Používá se spíše perorálně, parenterální použití není vhodné. Podání je omezeno na pacienty, u kterých je předpoklad, že jsou schopni metabolizovat NH3. U pacientů s poškozením jaterního parenchymu je podání NH4Cl kontraindikováno.
Arginin hydrochlorid
4,2 % roztok, 1000 ml roztoku je ekvivalentní 200 mmol kyselin. I proti jeho používání jsou námitky. Bazická aminokyselina arginin působí v nitru buňky alkalizačně a teprve po její metabolizaci se uplatní acidifikační vliv Cl-. Kromě toho byly po podání Arginin hydrochloridu popsány i těžké hyperkalémie.
Kyselina chlorovodíková - HCl
Podává se silně zředěná 0,1 - 0,15 mol/l katetrem do velkých žil, pomalu, aby nedošlo k poškození žilní stěny a erytrocytů.
Acetazolamid
Diuretikum, inhibitor karboanhydrázy, zvyšuje vylučování HCO3- a kalia ledvinami. Je vhodný k podávání u pacientů s metabolickou alkalózou spojenou s městnavou slabostí srdeční s neschopností snášet zátěž většími objemy tekutin např. fyziologickým roztokem.
Výpočet potřebné dávky roztoků korigujících acidózu nebo alkalózu
Při úpravě pH vnitřního prostředí používáme některé výpočty potřebného množství korigujících roztoků. Základní vzorec pro úpravu BE nebo BD v krvi je vzorec podle Mellemgarda a Astrupa:
mmol hydrogenkarbonátu = BE . 0,3 . kg hmotnosti
Máme-li místo kladného BE záporný BE, neboli BD, pak místo mmol hydrogenkarbonátu dosadíme mmol kyseliny, resp. Cl-.
Podáním vypočteného množství bazí nebo kyselin upravíme BE nebo BD na hodnotu 0. Hodnota pH bude rovna 7,400 pouze tehdy, bude-li pCO2 rovno 5,35 kPa. Při nerespektování hodnoty pCO2 můžeme pacientovi sice upravit BE nebo BD na 0, ale pH krve se může od hodnoty 7,400 výrazně lišit a pacienta tato změna může spíše poškodit. Při úpravě pH na hodnotu, kterou si určíme, lze použít korigovaný vzorec podle Nejedlého, který zohledňuje aktuální pCO2 pacienta:
| mmol HCO3- = BD . 0,3 . kg . | pHcílové - pHzjištěné |
| --------------------- |
| pHx - pHzjištěné |
Hodnotu pHx vyhledáme z tabulky podle pCO2 pacienta:
| pCO2 kPa | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 | 4.5 |
5.0 | 5.5 | 6.0 | 6.5 | 7.0 | 7.5 | 8.0 | 8.5 | 9.0 | 9.5 |
| pHx | 7.670 | 7.610 | 7.567 | 7.517 | 7.487 | 7.457 |
7.427 | 7.397 | 7.377 | 7.350 | 7.332 | 7.314 | 7.298 | 7.280 | 7.263 | 7.248 |
Vypočtenou dávku potřebnou ke korekci nepodáváme najednou. Po podání cca jedné poloviny vypočtené dávky zkontrolujeme parametry ABR a další dávkování řídíme podle zjištěných hodnot.
Doporučená literatura:
Bedřich Nejedlý a spolupracovníci: Vnitřní prostředí, klinická biochemie a praxe.
Avicenum, zdrav. nakladatelství Praha 1980
Antonín Kazda: Biochemické monitorování nemocných v intenzivní a resuscitační péči. Avicenum, zdrav. nakladatelství Praha 1984
Jaroslav Masopust: Požadování a hodnocení biochemických vyšetření. Zdravotnické aktuality 216. Avicenum, zdrav. nakladatelství Praha 1990
Robert W. Schrier: Renal and Electrolyte Disorders. Little, Brown and Company 1992
Kolektiv autorů: Vybrané kapitoly z problematiky biochemického sledování v intenzivní péči. Účelová publikace, vyd. STAPRO,spol.s.r.o., Pardubice 1990
 Při pohledu na grafické znázornění SID (Obr.3.2) je zřejmé, že jde o část sloupce aniontů vyplněnou hydrogenkarbonáty a plazmatickými bílkovinami. Změny velikosti SID jsou způsobeny hlavně změnami v poměru Na+ ku Cl-, eventuelně zmnožením reziduálních aniontů (RA). Každé zvětšení SID je sledováno z důvodů zachování elektroneutrality zvýšením koncentrace hydrogenkarbonátů, což vede ke zvýšení pH. Naopak zmenšení SID vede ke snížení koncentrace hydrogenkarbonátů v rozsahu nutném pro zachování elektroneutrality a druhotně k poklesu pH. Pokles koncentrace Atot vede ke zvýšení koncentrace hydrogenkarbonátů, což je příčinou vzniku metabolické alkalózy u stavů se sníženou koncentrací bílkovin, nebo jen albuminu.
Z následujících schémat, převzatých z práce Kováče a spol., vyplývá rozšíření pohledu na acidobazické regulace při použití parametru SID a Atot (Obr.3.3 a 3.4). Změny nezávisle proměnných veličin vedou ke změnám v koncentraci hydrogenkarbonátu a v pH. Hodnotu SID přímo nevypočítáváme. Z technických důvodů nelze rychle stanovit některé parametry z oblasti reziduálních aniontů. K hodnocení metabolických poruch acidobazické rovnováhy používáme některé parametry, které jsou vypočítávány z koncentrací jednotlivých kationtů, aniontů a bílkovin. Jde o BBS (buffer base séra), AG (anion gap) a RA (reziduální anionty, viz dále).
Při pohledu na grafické znázornění SID (Obr.3.2) je zřejmé, že jde o část sloupce aniontů vyplněnou hydrogenkarbonáty a plazmatickými bílkovinami. Změny velikosti SID jsou způsobeny hlavně změnami v poměru Na+ ku Cl-, eventuelně zmnožením reziduálních aniontů (RA). Každé zvětšení SID je sledováno z důvodů zachování elektroneutrality zvýšením koncentrace hydrogenkarbonátů, což vede ke zvýšení pH. Naopak zmenšení SID vede ke snížení koncentrace hydrogenkarbonátů v rozsahu nutném pro zachování elektroneutrality a druhotně k poklesu pH. Pokles koncentrace Atot vede ke zvýšení koncentrace hydrogenkarbonátů, což je příčinou vzniku metabolické alkalózy u stavů se sníženou koncentrací bílkovin, nebo jen albuminu.
Z následujících schémat, převzatých z práce Kováče a spol., vyplývá rozšíření pohledu na acidobazické regulace při použití parametru SID a Atot (Obr.3.3 a 3.4). Změny nezávisle proměnných veličin vedou ke změnám v koncentraci hydrogenkarbonátu a v pH. Hodnotu SID přímo nevypočítáváme. Z technických důvodů nelze rychle stanovit některé parametry z oblasti reziduálních aniontů. K hodnocení metabolických poruch acidobazické rovnováhy používáme některé parametry, které jsou vypočítávány z koncentrací jednotlivých kationtů, aniontů a bílkovin. Jde o BBS (buffer base séra), AG (anion gap) a RA (reziduální anionty, viz dále).