Céliakální sprue, gluten-senzitivní enteropathie, a nové diagnostické
přístupy
Ceterum 1997/11, str.17-19
Céliakální sprue (céliakie) je onemocnění spojené s permanentní intolerancí lepku (glutenu, resp. jeho složek); céliakie je označována jako gluten-senzitivní enteropathie. Obiloviny obsahují zásobní proteiny (prolaminy), které se u pšenice označují termínem gliadiny. Gliadiny tvoří heterogenní skupinu bílkovin a jejich další charakterizace je odvozena od pohyblivosti jednotlivých frakcí při škrobové gelové elektroforéze1. Rozlišujeme tak skupiny a-, b-, g- a w-gliadinů. Pšeničné gliadiny, které jsou jednoznačně zodpovědné za vznik a rozvoj onemocnění vykazují významnou sekvenční homologii s geneticky příbuznými prolaminy (secalin, hordein, avenin) dalších obilovin žita, ječmenu, ovsa atd. Společným rysem těchto proteinů jsou opakující se sekvence s vysokým obsahem prolinu a glutaminu. Průkaz vztahu glutenu k onemocnění céliakií popsal před téměř 50 lety Dicke2. Výzkum v oblasti etiopatogenetických faktorů céliakie je soustředěn na studium gliadinových peptidů3,4 a jejich biologickou aktivitu.
Patogenetické mechanizmy
glutenové enteropatie dosud nebyly jednoznačně definovány. Byla prokázána genetická vazba s výskytem produktu hlavního histokompatibilního komplexu HLA-DQw2 ve vazbě s HLA-A1, B8 a DR3/DRw17. Céliakální sprue je řazena k autoimunitním onemocněním5 a byla prokázána řada mechanismů účinku gliadinových peptidů na buněčné struktury sliznice tenkého střeva. Zde se uplatňuje vazba na enterocyt, průnik do lamina propria, reakce s T-lymfocyty i B-lymfocyty, produkce anti-gliadinových protilátek, aktivace imunologických procesů s uvolněním cytokinů a další mechanismy (obrázek č.1).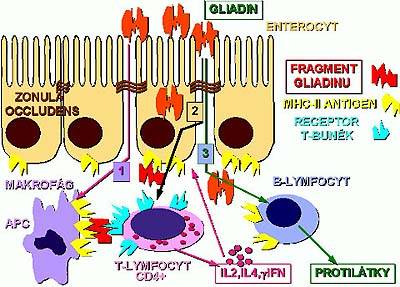 obr.1
obr.1
Klinické projevy
se nejčastěji objevují již v dětství, kolem jednoho roku věku, u některých nemocných dochází k manifestaci až v dospělosti. Charakteristické jsou příznaky porušené funkce zažívacího traktu (průjmy, anorexie, meteorismus, bolesti břicha) nebo průvodní projevy malabsorbce6 (např. hubnutí, anémie, osteoporóza). Patologické změny lze označit jako atrofickou jejunitidu. Maximum zánětlivých změn prokazujeme v proximální části tenkého střeva při histologickém a histochemickém vyšetření bioptických vzorků sliznice. V histologickém obraze dominuje redukceabsorpční plochy - snížená až plochá, atrofická sliznice (obrázek č.2) a edematózní lamina propria se zánětlivou lymfoplasmocytární infiltrací. Zvýšená permeabilita sliznice je důsledkem defektů buněčného těsného spojení (zonula occludens). Histochemickou detekcí prokazujeme výrazné snížení aktivity enzymů kartáčového lemu enterocytu. Klinická manifestace onemocnění se značně liší v závislosti na věku a rozsahu střevního poškození. Z tohoto důvodu zůstává řada nemocných nediagnostikována, resp. céliakie je zjištěna jako vedlejší diagnóza.
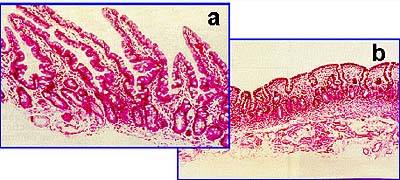
obr.2
Céliakalní sprue se sdružuje s dalšími autoimunitními chorobami, především s podobným HLA haplotypem. Duhringova herpetiformní dermatitida7 je kožní onemocnění popsané v roce 1884. V 60tých letech byly u nemocných prokázány slizniční léze shodné jako u céliakie, shodný je HLA haplotyp a dnes je toto onemocnění považováno za jednu z forem glutenové enteropathie. Do skupiny ko-incidentních chorob patří insulin-dependentní diabetes mellitus (I.typu)8, autoimunní thyreoitida, IgA nefropatie, revmatoidní arthritida a další.
Základním léčebným opatřením je nasazení bezglutenové (bezlepkové) diety, tj. vyloučení všech potravin, k jejichž přípravě je použito mouky z pšenice, žita ječmene i ovsa; náhradou je mouka rýžová a sojová. Dodržování této bezlepkové diety je celoživotním opatřením. Po vyloučení glutenu z potravy dochází u nemocných s klasickou formou céliakie k remisi, ústupu obtíží a při vyšetření bioptických vzorků je prokázán normální histologický obraz. Diagnostika podle doporučení ESPGAN (Společnost pro dětskou gastroenterologii a výživu) zahrnuje 3 bioptické odběry a to 1.průkaz atrofie při normální dietě, 2.normalizaci po bezlepkové dietě a 3.relaps, tj. znovu prokázáné poškození sliznice při návratu k normální dietě obsahující gluten. Tato diagnostická kriteria jsou nyní revidována s přihlédnutím k využití serologických markerů. Diagnostická kriteria a screening céliakie tvořily hlavní náplň odborného 7.Mezinárodního symposia céliakie, které se konalo v září 1996 ve Finském Tampere.

Laboratorní diagnostika
Céliakální sprue je primárním malabsorpčním syndromem. Základním, orientačním stanovením absorpční funkce tenkého střeva9 je sérová hladina ß-karotenu. Přesnější kvantifikaci poskytují zátěžové, toleranční testy s D-xylózou a A-vitaminem, podezření na glutenovou enteropatii lze podpořit stanovením serologických markerů. Jednoznačným diagnostickým kriteriem zůstává histologickým průkaz v bioptickém vzorku střevní sliznice.
ß-karotén je retinoid, prekursor vitaminu A (z jedné molekuly ß-karotenu vznikají 2 molekuly A-vitaminu), jeho zdrojem je především ovoce a zelenina. A-vitamin i ß-karoten jsou rozpustné v tucích, jejich hladina v séru je proto závislá na trávení a vstřebávání tuků. V cirkulaci je ß-karotén vázán z 80% na LDL, 8% na HDL a z 12% na VLDL lipoproteiny. Ze sérových karotenoidů tvoří ß-karoten asi 25%. Stanovení ß-karotenu se provádí pomocí HPLC nebo extrakční metodou se spektrofotometrickým měřením. Referenční hodnoty závisí na postupu stanovení, běžně je uváděno rozmezí pro extrakční metodu tj.stanovení celkových sérových karotenoidů, 0.90-4.60 µmol/l, užší pásmo referenčních hodnot je 1.12-3.72 µmol/L. Pro screening malabsorpčního syndromu u dospělých se uvádí pouze dolní hranice 0.93 µmol/l.
D-xylóza je 5-uhlíkový monosacharid (pentóza), který je asi ze 60% pasivně absorbován v proximální části tenkého střeva (duodenojejunální) a z cirkulace je eliminován ledvinami. Clearance cca 87% je dána tubulární reabsorbcí D-xylózy. Při tolerančním testu stanovujeme hladinu v séru a v moči, nalačno a za 5 hodin po podání zátěže (pro stanovení odpadu močí je prováděn 5 hodinový sběr moče).Stanovení D-xylózy je založeno na reakci 4-bromanilinu s furfuralem, který vzniká dehydratací D-xylózy v kyselém prostředí. Vzniklý barevný produkt je měřen fotometricky při 520nm. Alternativní postupy pro stanovení D-xylózy jsou plynová chromatografie, HPLC a enzymová procedura s D-xylózo:NADP+ 1-oxido-reduktázou. Patologickým výsledkem je hladina za 2 hodiny u dospělých po podání 25g < 1.67 mmol/l u dětí po podání 5 g < 1.33 mmol/l. V 5ti hodinovém sběru moče je u dětí 5-12 let po podání 5g D-xylózy patologickým výsledkem hodnota < 0.8g/5hod, u dospělých osob po podání 25g hodnota < 4g/5 hod. Variantou klasického absorbčního testu je dechový test s 13/14C-D-xylózou.
Dechový test s 13C-D-xylózou je variantním uspořádáním funkčního testu. Po podání testovaného substrátu (13C-D-xylózy) jsou odebírány vzorky vydechovaného vzduchu (obrázek č.4) a je měřena koncentrace CO2 resp. izotopu 13C hmotnostní spektrometrií. Testy se substrátem značeným izotopem uhlíku 14C vyžadovaly měření radioizotopové a jsou proto dnes nahrazeny substancemi s izotopem uhlíku13C. K provedení dechových testů jsou dodávány soupravy, které obsahují definované množství substátu, 2-6 odběrových nádobek pro vzorky vydechovaného vzduchu (podle uspořádání testu) a odběrovou trubičku.
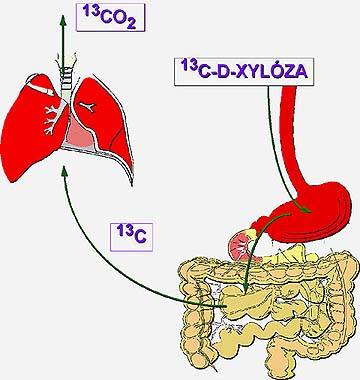
obr.4
A-vitamin je v tuku rozpustný vitamin, molekulové hmotnosti 286.44 existující ve dvou přirozených formách retinol (A1) a 3-dehydro-retinol (A2); prekursorem A-vitaminu je ß-karoten. A-vitamin (Axeroftol) je podán ve formě esteru rozpustného v tucích, který je hydrolyzován pankreatickými enzymy a v enterocytu pak dochází k jeho re-esterifikaci nejčastěji s kyselinou palmitovou; v plasmě se váže na specifický lipoprotein (retinol vázající protein). Stanovení A-vitaminu v séru je možno provádět extrakční metodou se spektrofotometrickým měřením nebo separací technikou HPLC. Normální hodnoty A-vitaminu v séru jsou v rozmezí 1.8-2.3 µmol/l, klinicky se prosté stanovení sérové hladiny využívá jen zřídka. Zátěžový toleranční test s A-vitaminem je hodnocen vzestupem hladiny v séru za 3 a 5 hodin po podání testovací zátěže.Patologický výsledek testu je při hodnotách < 3.6 µmol/l za 3 hodiny resp. < 7.2 µmol/l za 5 hodin.
Serologické markery10
zahrnují detekci protilátek ke gliadinu (třídy IgA a IgG) a autoprotilátek k retikulinu resp. endomysiu třídy IgA. Podle revidovaných kriterií ESPGAN je k průkazu céliakie nutná pozitivita alespoň dvou ze tří serologických markerů při současném histologickém průkazu atrofické sliznice.
Antigliadinové protilátky (AGA) jsou produkovány B-lymfocyty ve střevní slizniciu nemocných s céliakální sprue. K průkazu se většinou používá ELISA techniky na mikrotitračních destičkách s antigenem = gliadinem. Specificita a senzitivita stanovení je závislá na typu použitého antigenu, resp. na způsobu jeho purifikace. Specificita AGA IgA protilátek je uváděna v rozmezí 84-100%, senzitivita 65-95%, hladina klesá při bezlepkové dietě více u IgA než IgG třídy protilátek. IgG protilátky vykazují specificitu 70-95% a sensitivitu 80-95%. Naše pracoviště používá ke stanovení antigliadinových protilátek ELISA desky s purifikovaným a-gliadinem11. Aplikace a-gliadinu jako antigenu zvyšeuje podle některých studií senzitivitu testu 3x při porovnání se surovým gliadinem. Vzhledem ke značené heterogenitě používaných antigenů je zcela zásadní otázkou standardizace tohoto vyšetření. Mezinárodní, mezilaboratorní systém standardizace je již realizován v některých evropských zemích systémem, který vypracoval prof.Stern z Tübingen v Německu. Tento standardizační projekt byl prezentován na symposium v Tampere v minulém roce12.
Antiretikulinové (ARA) a antiendomysiální (EmA, AEA) protilátky prokazatelné v séru u nemocných s céliakii jsou dokladem autoimunitních charakteru tohoto onemocnění. Protilátky reagují pravděpodobně se strukturami intercelulární matrix, s retikulinovými vlákny a s endomysiem hladkého svalstva. Dosud nebyly identifikovány cílové struktury autoantigenů ani úloha těchto protilátek v etiopatogenezi onemocnění. K průkazu se používá imunofluorescenční techniky, substrátem pro ARA protilátky je nejčastěji tkáň krysí ledviny, pro EmA hladká svalovina opičího jícnu nebo lidského pupečníku. Specificita EmA je uváděna v rozmezí 90-100%, senzitivita 97-100%. EmA a ARA protilátky (třídy IgA) nelze prokázat u nemocných s céliakií, kteří mají současbně selektivní IgA deficit (2-3% pacientů s céliakií). Antiretikulinové protilátky třídy IgA mají senzitivitu i specificitu kolem 90%, stanovení ARA třídy IgG se již opouští.
Screeningové programy
Klinický obraz onemocnění nemusí provázet charakteristické rysy malabsorpčního syndromu. Incidence glutenové enteropathie je podle nejnovějších, epidemiologických studií, které byly provedeny v minulých letech v řadě evropských zemí, podstatně vyšší, než naznačovaly ukazatele klinické diagnostiky. Tyto studie jsou založeny na screeningu pomocí serologických markerů a to především kombinace protilátek antigliadinových (AGA) a antiendomysiálních (EmA). Na základě těchto studií byl definován “ledovcový model” céliakie (obrázek č.6). Incidence v evropských zemích se pohybuje v rozmezí 1:200 - 1:250, tj. dosavadní údaje o počtu klinicky diagnostikovaných onemocnění představují jen vrchol ledovce a nejméně 80% nemocných zůstává nediagnostikováno. Model ledovce tak zahrnuje klasickou formu céliakie s charakteristickými projevy malabsorpce, dále tzv. tichou (silent) formu bez symptomatologie onemocnění trávicího ústrojí, formu latentní bez prokazatelného poškození sliznice tenkého střeva a konečně formu tzv. potenciální céliake, kam patří případy geneticky predisponovaných osob a rodinní příslušnící pacientů s céliakií.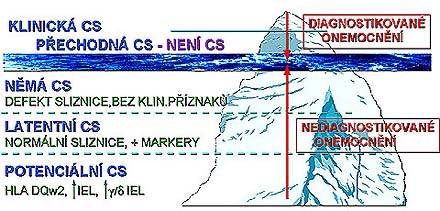
obr.6
Na základě zkušeností z uvedených epidemiologických studií byl vypracován doporučený postup screeningu. Založen je na kombinaci AGA a EmA, které lze stanovit paralelně nebo sekvenčně (obrázek č.7).
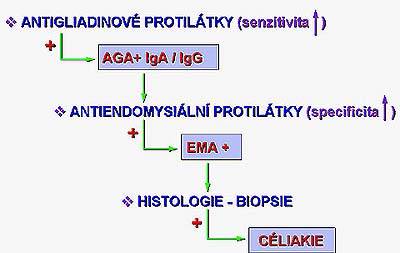
obr.7
Senzitivita AGA-A, AGA-G, EmA a kombinace všech tří testů je podle studie prof.Sterna 95, 92, 97 a 98%, specificita testů je 67, 81, 90 a 100%, prediktivní efektivita je 88, 89, 95 a 100%. Sekvenční přístup je ekonomicky výhodnější: prvním krokem je stanovení AGA protilátek IgA a IgG třídy. Při pozitivitě stanovujeme EmA protiláteky a jsou-li EmA protilátky positivní, nebo EmA negativní s IgA AGA positivitou (tj. zachycení nemocných s deficitem IgA) je doporučena střevní enterobiopsie. Tímto postupem byla provedena studie Catassiho13 (obrázek č.8) na souboru 17201 asymptomatických studentů a bylo dignostikováno 82 případů céliakie (incidence je zde 1:210).
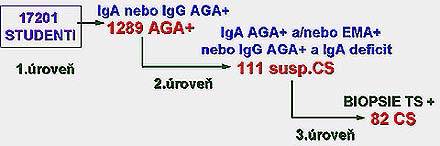
obr.8
Ve spolupráci s doc. Tlaskalovou z Imunologického oddělení MBÚ AV ČR připravujeme screeningový program se zajištěním kontroly kvality a standardizace laboratorních vyšetření koordinovanou evropským centrem prof.Sterna. Zkušenosti se screeningem v České republice referoval na symposiu v Tampere dr.Pozler z Hradce Králové. Kombinací EmA a ARA protilátek u 1454 dětí s následnou biopsií tenkého střeva bylo diagnostikováno 121 případů céliakie. S ohledem na koincidenci s dalšími autoimunitními onemocněními byly některé screeningové studie zaměřeny na nemocné s insulin dependentním diabetes mellitus (I.typu). Švédská studie z Uppsaly popisuje diagnostiku 20 céliakií v souboru 442 dětí s IDDM pomocí kombinace AGA a ARA protilátek s potvrzením enterobiopsií.
Klinický význam screeningu
vyplývá z již uvedených výsledků evropských studií. Závažnost nerozpoznané céliakie však spočívá v možnosti vzniku řady komplikací, které vyplývají z malabsorpce, která není-li diagnostikována, není ani patřičně léčena. Nemocní s céliakií (a to i bez klinických příznaků) patří do vysoko-rizikové skupiny s vyšším výskytem maligních tumorů. Dodržování bezlepkové diety u těchto nemocných riziko malignity výrazně snižuje a právě tato skutečnost je závažným důvodem k screeningu céliakie pomocí serologických markerů. U nemocných s céliakií se malignity (sqamózní CA jícnu a faryngu, střevní adenokarcinom a lymfom) vyskytují signifikantně častěji a úmrtí na tyto nádory jsou 1.9x častější než v ostatní populaci. Striktní dodržování bezlepkové diety by snížilo morbiditu nádorovými onemocněními u nemocných céliakií až 11x, jak vyplývá ze studie Howdle14. Lewis15 popsal v minulém roce soubor 487 pacientů s Duhringovou herpetiformní dermatitidou, přičemž 8 případů lymfomu se týkalo pouze nemocných, kteří nedodržovali bezlepkovou dietu.
Literatura
1) Kocna, P.; Holáková-Kočová, M.; Šašek, A.; Z.Lebens. Unters. Forsch.; 1983; 177: 454-456
2) Dicke, W.K.; Thesis Utrecht; 1950
3) Kocna, P.; Frič, P.; Kočová-Holáková, M.; Slabý, J.; Kasafírek, E.; Hekkens, W.Th.J.M.;J.Chromatogr.; 1988; 434: 2, 429-438
4) Kocna, P.; Mothes, T.; Krchňák, V.; Frič, P.; Z.Lebens.Unters. Forsch.; 1991; 192: 1, 116-119
5) Tlaskalová-Hogenová, H.; Štěpánková, R.; Tučková, L.; Farré, M.A.; Větvička, V.; Trávníček, J.; Kolínská, J.; Kocna, P.; Frič, P.; Holub, M.; Zoric, M.; Nilsson, L.; Ascher, H.; Advances in Mucosal Immunology; 1995; 37: 1, 1191-1198
6) Frič, P.;Malabsorpční syndrom SZN Praha 1969
7) Dvořák, M.; Frič, P.; Lojda, Z.; Čs.Gastroent.Výživa; 1979; 33: 7, 403-410
8) Kocna, P.; Perušičová, J.; Frič, P.; Dvořák, M.; Abs.IX.Europ. Congress Clin.Chemistry, Krakow; 1991; : 03-45, 66
9) Frič,P.; Biochem Clinica Bohemoslovaca; 1985; 14: 3, 209-219
10) Grodzinsky, E. Serological markers. Linköping Thesis, 1994
11) Bezdíčková, D.; Kocna, P.; Schneiderka, P.; Sborník FONS’96 1996; 113
12) Stern, M. ;Serological screening for coeliac disease (CD),1997, 1-119
13) Catassi,C.; Fabiani, E.; Rätsch, I.M.; Coppa, G.V.; Giorgi, P.L.; Pierdomenico, R.; Alessandrini, S.; Iwanejko,G.; Domenici, R.; Mei, E.; Miano, A.; Marani, M.; Bottaro, G.; Acta Paediatrica; 1996; 85: 412S, 29-35
14) Howdle, P.D.; Gastroint.Immunol.and Gluten-sensitive Disease; 1992, 181-190
15) Lewis,H.M.; Renaula,T.L.;Garioch,J.J.; Leonard, J.N.; Fry,J.S.; Collin, P.; Evans, D.; Fry, L.; British Journal of Dermatology; 1996; 135: 3, 363-367