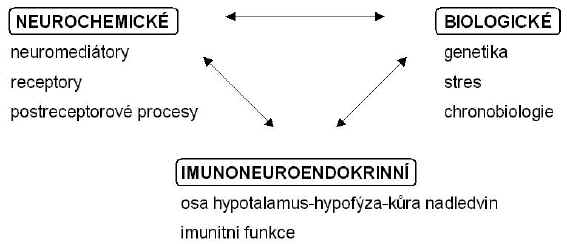
Od počátku byly důkazy pro existenci biochemických základů afektivních poruch hledány a nalézány ve třech hlavních oblastech: ve funkci neuromediátorových systémů, v genetických a v neuroendokrinních změnách (260, 62). Uvedené rozdělení hypotéz afektivních poruch na biologické, imunoneuroendokrinní a neurochemické (Obr. 1) je ale do určité míry formální a je dáno především různými metodickými přístupy k výzkumu podstaty vzniku a léčby těchto onemocnění. Provázanost uvedených přístupů je zřejmá i z účinků psychotropních látek.

Obr. 1: Přístupy biologické psychiatrie ke studiu afektivních poruch
Biologické přístupy vycházejí obvykle z významné úlohy genetických faktorů ve vývoji afektivních poruch (275, 356, 215) a z možnosti ovlivnění průběhu těchto poruch určitými formami stresu. Genetické faktory ovlivňují riziko vzniku těžké depresivní fáze, částečně zvýšením citlivosti osob k událostem indukujícím depresi (147). Dosavadní problémy v přesnějším určení podílu genetických faktorů ve vzniku afektivních poruch mohou být dány heterogenitou onemocnění. Není však vyloučeno, že existuje plynulý přechod od unipolárního depresivního onemocnění, přes bipolární afektivní poruchu a schizoafektivní onemocnění, až k různým formám schizofrenie, přičemž toto kontinuum spočívá na genetickém základě, tj. na proměnách určitého genu (64).
V literatuře jsou diskutovány především tyto biologické modely bipolárních poruch (256, 142): 1) desynchronizace oscilátorů, které regulují spánek a některé neuroendokrinní rytmy, oproti jiným vnitřním cirkadiánním rytmům; 2) náchylnost k afektivním poruchám daná nedostatečnou funkcí nějakých homeostatických mechanismů; 3) zvýšená citlivost daná opakováním určitých událostí.
Pozornost je již dlouhou dobu věnována chronobiologickým teoriím afektivních poruch (112, 337, 331). Těmto hypotézám je společný předpoklad, že v patogenezi afektivních poruch jsou zahrnuty poruchy určitých biologických rytmů. Není však jasný původ těchto poruch. Účinnými faktory, které jsou schopny regulovat kritické biologické rytmy jsou především světlo (cykly světlo-tma) a sociální rytmy. Účinnou biologickou terapií některých forem deprese může být fototerapie nebo spánková deprivace (280, 281, 170, 262, 352, 239). Pro sezónní afektivní poruchy se uvádějí tyto hlavní typy teorií: melatoninová hypotéza, hypotéza fázového posunu, amplitudová hypotéza, nedostatek serotoninu, snížená dopaminergní aktivita.
Předpokládají se především destabilizující účinky stresu na náladu. Mechanismy účinků stresu přitom propojují přístupy biologické, imunoneuroendokrinní a neurochemické (350, 148, 45). Při stresu je např. indukována exprese stresových proteinů (118) a je zvýšena biosyntéza polyaminů (100). Vznikla hypotéza, podle níž polyaminy a změny v jejich metabolismu mohou být zahrnuty v patofyziologii afektivních poruch (101). Biochemické změny indukované opakovaným stresem mohou zahrnovat také změny ve funkci transkripčních faktorů, což může vést k neurobiologickým změnám v limbickém systému a zvyšovat tak náchylnost pacientů k dalším depresivním epizodám. Po chronickém stresu bylo pozorováno např. zkrácení dendritů a úbytek jejich průměrného počtu u pyramidových neuronů v hipokampu.
Neuroendokrinní přístupy zachycují především vztahy afektivních poruch a změn aktivity osy hypotalamus-hypofýza-kůra nadledvin (HPA) nebo změn thyroidních hormonů, tj. aktivity osy hypotalamus-hypofýza-štítná žláza (260, 62, 124, 141). Byla pozorována hypersekrece kortisolu, snížená odezva na podání dexametasonu, zeslabené uvolňování růstového hormonu (zvláště v odezvě na alfa-adrenergní receptorové agonisty), zeslabené vylučování thyrotropinu (hormonu stimulujícího štítnou žlázu) v odezvě na uvolňovací faktor pro thyrotropin, zeslabená prolaktinová odezva k různým látkám, atd. Rovněž neurony uvolňující arginin-vasopresin a oxytocin v hypotalamu jsou zřejmě při depresi aktivovány (264).
Z hlediska vzniku a léčby afektivních poruch může být významný zvláště uvolňovací faktor pro kortikotropin (CRF), o němž je známo, že působí v mozku i v periferii a koordinuje odezvu na stresory. Tomuto faktoru je v neuroendokrinních teoriích afektivních poruch věnována hlavní pozornost; proto je dále podrobněji popsána funkce osy HPA a uvedeny příslušné neuroendokrinní hypotézy.
Z hypotalamu jsou uvolňovány polypeptidové hormony, dostávají se krví do adenohypofýzy a v ní stimulují nebo inhibují vylučování tropních hormonů (tropinů), které zase stimulují vylučování hormonů z určitých žláz s vnitřní sekrecí. Neurony uvolňující CRF tímto způsobem stimulují vylučování adrenokortikotropního hormonu (ACTH) z adenohypofýzy. ACTH stimuluje uvolňování glukokortikoidů a jiných steroidů z kůry nadledvin. Glukokortikoidní účinky spočívají ve zprostředkování řady životně důležitých funkcí, např. v podpoře tvorby glykogenu v játrech, především z aminokyselin, a v brždění periferního využití glukosy. Nejdůležitějšími glukokortikoidy jsou kortisol (znám též jako hydrokortison) a kortikosteron. V metabolismu bílkovin mají glukokortikoidy katabolický účinek - s tím souvisí jejich imunosupresivní a protizánětlivé účinky. V ose HPA se uplatňují především tyto záporné zpětné vazby: 1) ACTH inhibuje vylučování CRF; 2) kortikosteroidy a jiné adrenokortikoidní steroidy inhibují uvolňování jak CRF z hypotalamu, tak ACTH z adenohypofýzy.
Zatímco v klidovém stavu je základní aktivita osy HPA regulována především cirkadiánními rytmy odvozenými ze suprachiasmatických jader, je odezva při stresu komplexní a zahrnuje aferentní vstupy z různých oblastí mozku. Koncentrace kortikosteroidů kolísají během dne od 0,5 do 50 nM, ale v odezvě na stres rostou až nad 100 nM. Zpětnovazebné inhibiční působení kortikosteroidů je uskutečňováno přes odpovídající receptory. Glukokortikoidní receptory se přitom nacházejí ve všech oblastech mozku, zatímco mineralokortikoidní receptory hlavně v neuronech z hippokampu.
Neuroendokrinní hypotéza, podle níž endokrinní abnormality spojené s depresí mohou být výsledkem hypersekrece CRF z hypotalamových a extrahypotalamových neuronů obsahujících tento faktor, vychází především z těchto pozorování (24): 1) u více než 50% depresivních pacientů je mírně zvýšená základní funkce osy HPA indikovaná např. zvýšenými koncentracemi CRF v CSF (230); 2) počet vazebných míst pro CRF ve frontální kůře sebevrahů je snížen, pravděpodobně v důsledku dlouhodobě zvýšené dostupnosti CRF (231); 3) podání CRF zdravým dobrovolníkům vyvolává příznaky depresivní poruchy; 4) byla pozorována snížená odezva (měřená uvolňováním ACTH) na podání CRF depresivním pacientům způsobená pravděpodobně zvýšenými základními hladinami kortisolu.
Zvýšená aktivita osy HPA v těžké depresivní fázi se projevuje také méně výrazným snížením plasmatických koncentrací ACTH a kortisolu po podání dexametasonu (124, 181). Dexametasonový supresní test (DST) byl navržen jako specifický test pro diagnózu těžké depresivní fáze (54). DST není účinný u 25-45% depresivních pacientů (55, 5), přičemž úspěšná léčba antidepresivy vede k obnově normální odezvy na tento endokrinní test (106). Citlivost DST je vyšší při těžké depresivní fázi s psychotickými příznaky a při sebevražedném chování (5). Ukázalo se však, že DST nemusí být dostatečně specifický v odlišení depresivního onemocnění od jiných psychiatrických poruch a že existuje řada podmínek (podávání některých léků, jiné nemoci, metabolické poruchy, těhotenství) dávajících falešné výsledky (334). V kombinovaném dexametasonovém-CRF testu je nejprve podán dexametason a po určité době CRF; ačkoli jsou hladiny kortisolu u depresivních pacientů vyšší, jejich odezva na podání CRF je větší než u kontrol, což ukazuje na porušenou regulaci osy HPA přes zápornou zpětnou vazbu zprostředkovanou kortisolem. Zvýšená odezva osy HPA v tomto testu byla pozorována u více než 80% pacientů v těžké depresivní fázi a byla zjištěna i u zdravých osob s vysokým rodinným rizikem pro vznik afektivní poruchy (123).
V souvislosti s hypotézou o hypersekreci CRF při depresi vznikla hypotéza, podle níž je za určité charakteristiky deprese odpovědná hypersekrece CRF v locus coeruleus (LC), kde CRF může působit jako neuromediátor (65). Společným mechanismem působení antidepresiv by potom mohlo být ovlivnění neurotransmise zprostředkované CRF v LC. Přijatelnější je však hypotéza, že abnormální DST druhotným znakem změněné funkce centrálního nervového systému (CNS), zejména působení neuromediátorů v hypotalamu a v limbickém systému.
Hypotéza o narušené glukokortikoidní zpětné vazbě při depresi (24, 25) předpokládá, že nedostatečné zpětnovazebné působení kortisolu při depresi (a tedy i změněná funkce osy HPA) je způsobeno sníženou hustotou kortikosteroidních receptorů v mozku (v hippokampu a hypotalamu) a tedy zřejmě poruchou v regulaci genové exprese těchto receptorů. Zdá se, že porucha funkce kortikosteroidních receptorů je spíše příčinou, než následkem hypersekrece CRF při depresi. Tato hypotéza je podpořena zjištěním, že různá antidepresiva zvyšují hladiny mRNA pro glukokortikoidní a mineralokortikoidní receptory a zvyšují vazebnou kapacitu mozkové tkáně pro kortikosteroidy, což může podmiňovat např. snížení aktivity osy HPA. Časový průběh působení antidepresiv na kortikosteroidní receptory se shoduje s jejich dlouhodobým působením na aktivitu osy HPA a koreluje s klinickým zlepšením deprese.
Nové poznatky z psychoneuroimunologie ukazují, že různá psychiatrická onemocnění jsou spojena se změnami v imunitním systému (310). Výsledky psychoneuroimunologických studií u pacientů s depresivní poruchou jsou poněkud rozporné. Zatímco dřívější výsledky svědčily spíše o imunosupresi (152, 302, 83), novější studie jasně ukazují aktivaci imunitního systému při depresi (182, 185, 225). Je však možné, že různé typy deprese se ve vztahu k imunitnímu systému projevují opačně. Pozornost je zaměřena na interakce imunitního systému a serotoninergních a katecholaminergních systémů. Zdá se, že antidepresiva a antipsychotika mají inhibiční účinky na některé imunitní funkce.
Těžká depresivní fáze může být doprovázena aktivací imunitního systému nebo zánětlivou odezvou se zahrnutím zvýšeného počtu fagocytujících buněk, aktivace T buněk, proliferace B buněk, změnou hladin proteinů akutní fáze, vyššího titru protilátek (antijaderných, antifosfolipidových), zvýšené sekrece prostaglandinu, poruch u exopeptidasových enzymů, zvýšené produkce cytokinů mononukleárními buňkami v periferní krvi, zvýšeného počtu buněk nesoucích interleukinový(IL)-2 receptor, vyšších hladin rozpustných IL-2, IL-6 a transferinových receptorů, zvýšeného poměru buněk CD4+:CD8+ atd. (182, 183, 185, 188, 189, 225). Změny v těchto parametrech jsou ale menší, než při imunitních poruchách.
Bylo zjištěno, že cytokiny, které mají klíčovou úlohu v imunitní aktivaci, ovlivňují rovněž centrální nervový systém. Předpokládá se, že zvýšená aktivita osy HPA pozorovaná často při těžké depresi je důsledkem přímého stimulačního působení cytokinů na hypotalamus. Bylo zjištěno, že existuje propojení mezi cytokiny a katecholaminy; např. noradrenalin (NA) stimuluje uvolňování IL-6 z astrocytů a vylučování dalších IL vztažených k IL-6. Lze tedy předpokládat, že NA uvolňovaný při stresu aktivuje cytokiny a vede k imunitním jevům spojeným se stresem.
Na základě těchto úvah a zjištění byla formulována interleukinová hypotéza deprese (185), podle níž změny v buněčné a humorální imunitě a v sekreci prostaglandinu při depresi mohou být vysvětleny mechanismy vztaženými k nadměrnému uvolňování IL-1b a IL-6. Tyto interleukiny patří mezi hlavní imunitní a zánětlivé mediátory. Uvedený model zahrnuje tyto možnosti: 1) celková imunitní aktivace může způsobit snížení dostupnosti plasmatického L-tryptofanu (L-TRP), který je prekursorem serotoninu (5-HT); 2) zvýšená sekrece imunitních složek může být vztažena k hyperaktivitě osy HPA a zvýšená aktivita osy HPA může mít záporné zpětnovazebné účinky na imunitní systém; 3) není dosud jasné, zda je primární aktivace osy HPA nebo imunitní aktivace.
Imunoneuroendokrinní a neurochemické přístupy ke studiu afektivních poruch mohou být propojeny přes vzájemné ovlivňování funkcí monoaminergních neuromediátorových systémů a osy HPA. Např. CRF působí jako neuromediátor v LC, hlavním zdroji neuronů obsahujících NA, při stresem indukované aktivaci LC. Bylo zjištěno, že jak katecholaminy, tak kortikosteroidy modulují funkci b-adrenoceptorů (AR) a to zřejmě v opačném smyslu (68). Také byly popsány vzájemné vztahy mezi aktivitou osy HPA a aktivitou centrálních serotoninergních nebo noradrenergních systémů (180, 185, 186, 187). Např. byla zjištěna snížená neuroendokrinní odezva (měřená uvolňováním prolaktinu) po dodání tryptofanu depresivním pacientům (113), přičemž některá antidepresiva zřejmě obnovují normální prolaktinovou odezvu na tryptofan. Další prekursor serotoninu, 5-hydroxytryptofan, zvyšuje hladiny ACTH a kortisolu více u depresivních pacientů, než u kontrol. Hypotermická odezva vyvolaná specifickou aktivací presynaptických 5-HT1A receptorů je při depresi snížená (167, 168). Je také známo, že další monoaminový neuromediátor, dopamin (DA), inhibuje sekreci prolaktinu a stimuluje uvolňování růstového hormonu.
Neurochemické přístupy ke studiu afektivních poruch vycházejí ze sledování změn v molekulárních dějích spojených s narušením synaptického přenosu nervového signálu. V přenosu akčního potenciálu v neuronech (tj. v neurotransmisi) je zahrnut i přenos přes synapsi, kdy dochází k převodu (tj. transdukci) tohoto signálu. V širším slova smyslu se transdukcí rozumí přeměna šířícího se akčního potenciálu na signál s jinou fyzikálně-chemickou podstatou. Tato přeměna umožňuje přenos nervového signálu přes synaptickou štěrbinu pomocí neuromediátorů a excitační či inhibiční působení na postsynaptickou část. Základní transdukční mechanismy byly podrobně popsány v řadě přehledných prací (234, 235, 29, 194, 226). Nejrychlejší je přenos zprostředkovaný typy receptorů, které obsahují vnitřní iontový kanál. U ostatních typů receptorů se uplatňuje transdukční prvek, kterým je obvykle určitý G protein, tj. protein zprostředkující transmembránový přenos a zesílení signálu o navázání neuromediátoru k receptorovému vazebnému místu (103). Transdukční prvek umožňuje převedení signálu na efektorový systém, kterým obvykle je buď iontový kanál řízený G proteinem, nebo enzymový systém katalyzující vznik druhých poslů a následnou aktivaci nebo deaktivaci proteinkinas. Proteinkinasy katalyzují fosforylaci buněčných proteinů (iontových kanálů, receptorových vazebných míst, G proteinů, adenylátcyklas (AC) a jiných enzymů), což vede ke změnám stavu buňky, včetně polarizace a depolarizace membrány.
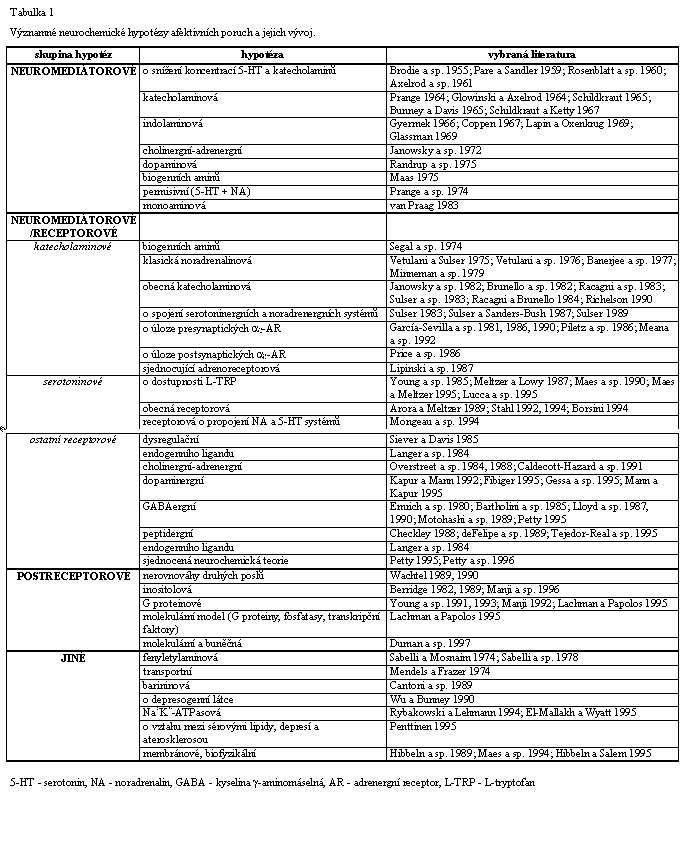
Rozdělení neurochemických hypotéz afektivních poruch (Tabulka 1) na neuromediátorové, receptorové a postreceptorové vychází z časového vývoje jejich formulace a odráží postupné poznávání a zahrnování dalších procesů v neurotransmisi do novějších hypotéz. Každá tato skupina hypotéz je dále členěna podle typu neuromediátoru, receptoru nebo transdukčního systému, jejichž funkce může být narušena při poruchách nálady. V dalších kapitolách jsou uvedeny formulace těchto hypotéz a jsou shrnuty i skutečnosti, které k nim vedly. Vzhledem ke klíčové úloze poznání mechanismů účinků psychofarmak v těchto studiích, uvádím také přehled účinků antidepresiv na receptorové, transportní a enzymové buněčné systémy (kap. 4.5 a 5.1). Na konci kapitoly o postreceptorových hypotézách afektivních poruch jsem se pokusil v „obecném modelu“ (kap. 5.5) integrovat nové poznatky z této oblasti. Z hypotéz, které nelze jednoznačně zařadit mezi neurochemické, považuji za významné a perspektivní „membránové hypotézy“ (kap. 6.2), neboť je nesporné, že vlastnosti lipidové části buněčných membrán ovlivňují většinu procesů spojených s přenosem nervového signálu.