Antidepresiva jsou různorodou skupinou psychofarmak, která mají podobné terapeutické účinky, ale liší se svou chemickou strukturou, metabolismem i farmakokinetikou. Vliv na koncentraci antidepresiv v plazmě, a tedy i na terapeutické účinky nebo toxicitu, má polymorfismus genů kódujících určité izoenzymy cytochromu P450, které metabolizují antidepresiva (58). Molekuly antidepresiv mají amfifilní charakter, mohou se tedy akumulovat v lipidové části membrán nebo membránami procházet a působit nejen na receptory, ale i na jiné proteiny ovlivňující přenos signálu (153, 308, 86, 87). Vzhledem k úloze fosforylace a defosforylace buněčných proteinů v transdukci signálu (347) jsou sledovány účinky antidepresiv i na enzymy zapojené do těchto procesů (267). Byla vyslovena hypotéza (24, 25), že primární působení antidepresiv spočívá ve stimulaci genové exprese kortikosteroidních receptorů, což vede ke zvýšení citlivosti systému HPA na zpětnovazebnou inhibici kortisolem s následným snížením aktivity osy HPA, včetně sníženého uvolňování CRF. Snížení koncentrací glukokortikoidů může druhotně ovlivnit expresi genů enzymů nezbytných pro syntézu neuromediátorů apod.
S terapeutickým působením antidepresiv jsou obvykle spojovány přímé či nepřímé farmakologické účinky na noradrenergní a serotoninergní systémy, ale také na systémy dopaminergní, acetylcholinergní a GABAergní (342, 130, 51, 277, 330). Rovněž N-metyl-D-aspartátové (NMDA) receptory mohou mít úlohu v patofyziologii deprese a v působení antidepresiv, neboť se zdá, že dlouhodobé podávání antidepresiv vede k adaptivním změnám v těchto receptorových komplexech (236, 335, 247). Blokáda acetylcholinových muskarinových, histaminových H1 nebo adrenergních a1/2 receptorů, ale i řada účinků uvedených výše, může způsobovat nežádoucí vedlejší účinky farmakoterapie.
Z hlediska minimalizace vedlejších účinků při léčbě deprese se uvažuje o antidepresivech se selektivním primárním působením jako o vhodných lécích prvního nasazení. Meta-analýzy zkoušek porovnávajících účinnost a rychlost nástupu účinků SSRI s klasickými antidepresivy (tricyklickými a podobnými) nezjistily významné rozdíly v těchto parametrech (311, 77), ale byla potvrzena významně vyšší snášenlivost SSRI (218) a větší bezpečnost při předávkování. Lépe jsou zřejmě tolerovány také selektivní inhibitory reuptake NA (32). Pozornost je věnována také farmakokinetickým a farmakodynamickým interakcím antidepresiv s jinými léky nebo interakcím mezi různými antidepresivy (313).
Z hlediska selektivity primárního působení antidepresiv na buněčné procesy se v současné době používají jak málo selektivní tricyklická a podobná antidepresiva, tak novější selektivní inhibitory reuptake monoaminových neuromediátorů, hlavně SSRI (228, 329, 343). Selektivní účinky mají také nové reversibilní inhibitory MAO-A (RIMA). Rychlejší nástup terapeutických účinků se očekává od kombinace vhodných antidepresiv a od selektivních blokátorů zpětného vychytávání serotoninu i noradrenalinu, popř. i dopaminu (67, 219, 220).
Zatímco synaptické a vedlejší účinky nastávají během hodin nebo několika dnů, terapeutické účinky jsou pozorovány teprve po týdnech podávání antidepresiv. Účinnost antidepresiv tedy spočívá v adaptivních změnách, které vyvolávají. Pokrok lze očekávat spíše od studia jejich postreceptorových účinků a od lokalizace mozkových struktur, které jsou antidepresivní léčbou ovlivněny. Předpokládanými místy působení nové generace antidepresiv jsou tedy nejen různé podtypy membránových receptorů, ale i nitrobuněčné děje na úrovni G proteinů, druhých poslů a proteinkinas; významné může být také ovlivnění aktivity osy HPA (48).
Problém v hledání antidepresiv s rychlejším nástupem účinků spočívá v tom, že není známa vazba mezi různými biochemickými ději a určitým vzorcem chování. Např. kombinace léků, která vede k rychlejší a větší regulaci snížením počtu b-AR, nevykazuje urychlení a umocnění terapeutických účinků. Na druhou stranu nejsou dostatečně známy specifické biochemické procesy odpovědné za rychlou odezvu, např. na spánkovou deprivaci, ECT, vyčerpání 5-HT nebo NA u některých pacientů. Příklady výskytu rychlého klinického zlepšení dávají naději, že budou objeveny léčebné postupy s rychlejším nástupem účinků, než je tomu dosud (259).
Nejrozšířenější látkou podávanou při léčbě bipolární afektivní poruchy zůstává lithium, které také snižuje intenzitu a frekvenci periodických afektivních epizod (20, 303). Byla přitom prokázána významná korelace mezi terapeutickými a profylaktickými výsledky (326). Mechanismy účinku lithia nejsou dostatečně známé, ale je zřejmé, že působí především na postreceptorové úrovni (194). Profylakticky se podává rovněž karbamazepin, valproát sodný a další látky (312, 327, 328).
Často pozorované receptorové změny vyvolané dlouhodobým podáváním antidepresiv jsou regulace snížením počtu b1-AR a/nebo snížení odezvy na agonisty 5-HT2 nebo 5-HT1A receptorů. Regulace snížením počtu b-AR po chronickém podávání antidepresiv je příkladem účinků záporné zpětné vazby zapojené do aktivace těchto receptorů. Zvýšená aktivace b-AR totiž vede ke zvýšení aktivity AC a tedy i k růstu koncentrace cyklického adenosinmonofosfátu (cAMP) a ke zvýšené aktivaci proteinkinas, které fosforylují b-AR a jiné proteiny. Fosforylace vede k desenzibilizaci a pravděpodobně i k odstranění receptorů z plasmatické membrány a ke snížení rychlosti transkripce genu pro tento receptor (108). Řada studií naznačuje, že snížení funkce presynaptických a2-AR může být, alespoň částečně, odpovědné za terapeutické účinky různých antidepresiv včetně tricyklických a lithia (93, 94, 95).
Nejlépe jsou prostudovány účinky TCA, jejichž terapeutické působení se zřejmě uskutečňuje přes změny v noradrenergních a serotoninergních systémech, případně jinými dosud neznámými cestami. Většina TCA inhibuje reuptake 5-HT a/nebo NA. Některá jsou antagonisty postsynaptických 5-HT1 a 5-HT2 receptorů (37, 348). Různá TCA zvyšují senzitivitu postsynaptických 5-HT1A receptorů v hippokampu i v jiných oblastech mozku (38, 129). Rovněž zvýšení transmise zprostředkované a1-AR může přispívat k antidepresivním účinkům TCA. Chronické podávání TCA vede ke zvýšenému počtu a1-AR nebo ke zvýšené afinitě pro agonisty a ke zvýšené senzitivitě postsynaptických buněk k signálům přenášeným a1-AR. Je to vysvětlováno tím, že TCA slabě blokují a1-AR a to brání regulaci snížením počtu a1-AR a následné desenzibilizaci.
Nejspolehlivější údaje byly získány o regulaci snížením počtu nebo o desenzibilizaci b-AR. Snížením transmise zprostředkovaným b-AR ale nelze uspokojivě vysvětlit terapeutické účinky antidepresiv. Pokud by antidepresivní odezva měla být vysvětlitelná desenzibilizací b-AR, potom by např. propranolol, jakožto antagonista b-AR, byl rychle působícím antidepresivem, což neplatí. Dále pro SSRI a některá další antidepresiva buď nebyly pozorovány žádné změny v b-AR, nebo jsou výsledky autorů rozporné (128). Rovněž účinky SSRI na 5-HT2, a1- a a2-adrenergní a jiné receptorové systémy nejsou konzistentní. Klinickou účinnost podávání antidepresiv proto nelze obecně určit pouze z receptorových změn.
Chceme-li zjistit celkovou reakci určitého neuromediátorového systému na podávání antidepresiv může být studium jedné složky neurotransmise poněkud zavádějící. V tomto případě lze použít např. elektrofyziologický přístup, kdy může být měřena jednak senzitivita somatodendritických autoreceptorů a schopnost vzniku a frekvence šíření akčního potenciálu v presynaptickém neuronu, jednak odezva postsynaptického neuronu a terminálních autoreceptorů. Tímto způsobem byly získány např. údaje o odlišných mechanismech zvýšení serotoninergní nerotransmise po dlouhodobém podávání různých antidepresiv: 1) senzitizací postsynaptických neuronů (TCA, ECT); 2) zvýšením dostupnosti uvolnitelného 5-HT (MAOI); 3) desenzibilizací 5-HT autoreceptorů na serotoninergních nervových zakončeních (SRI); 4) desenzibilizací somatodendritických 5-HT1A autoreceptorů a zvýšenou aktivací postsynaptických 5-HT1A receptorů (agonisté 5-HT1A). Je ovšem možné, že 5-HT systém je pouze prostředník ve vzniku odezvy a výsledný terapeutický účinek podávání antidepresiv uskutečňuje jiný systém (38). Navíc tyto elektrofyziologické studie nezachytily další možné inhibiční a excitační vlivy na serotoninergní neuronální aktivitu (119).
Dále jsou uvedeny předpokládané mechanismy účinků antidepresiv vyvozené z pozorovaných primárních a adaptivních změn v přenosových systémech.
Předpokládá se, že inhibice reuptake monoaminových neuromediátorů vede po dostatečně dlouhé době k obnově normální funkce serotoninergního, noradrenergního nebo dopaminergního systému. Největší pozornost byla v poslední době věnována inhibitorům reuptake serotoninu. Snížení počtu vazebných míst pro imipramin lokalizovaných na transportním proteinu pro serotonin na trombocytech bylo dokonce navrženo jako biologický znak endogenní deprese. Rozsáhlé mezinárodní studie tento předpoklad sice nepotvrdily, ale nebyla vyloučena možnost existence rozdílů v počtu těchto vazebných míst mezi podskupinami depresivních pacientů (205).
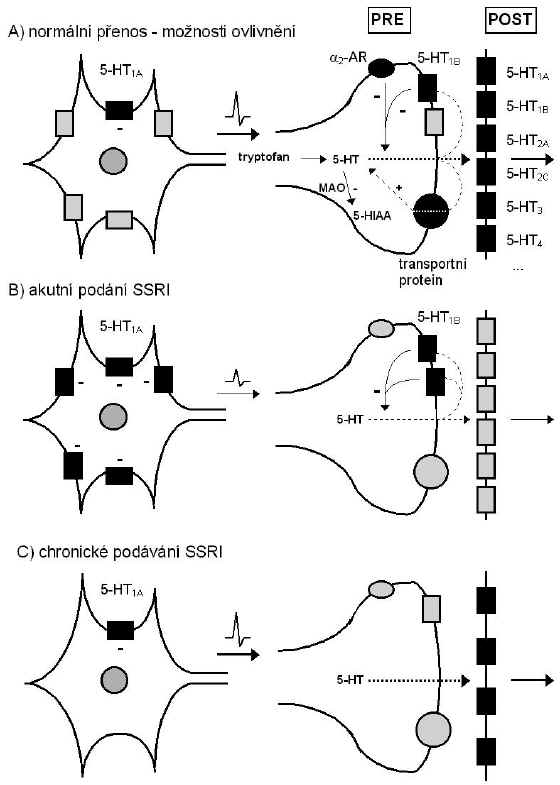
Inhibice reuptake 5-HT sama o sobě neodpovídá za antidepresivní odezvu. Je zřejmé, že terapeutické účinky souvisejí spíše s adaptivními změnami (42, 40). Je proto třeba rozlišovat výsledky akutního a chronického podávání SRI, resp. SSRI (Obr. 3). Akutní podání SSRI vede k přechodnému zvýšení mimobuněčných koncentrací 5-HT v řadě mozkových oblastí (250, 283, 151), zatímco dlouhodobé podávání SSRI způsobuje trvalejší zvýšení koncentrací 5-HT v určitých oblastech mozku (284, 151). Tyto poznatky vedly k formulaci následujících hypotéz o mechanismech účinku SRI.
Po akutním podání SRI se zvýší koncentrace 5-HT v synaptické štěrbině, tím se stimulují více presynaptické 5-HT1B autoreceptory a/nebo somatodendritické 5-HT1A autoreceptory a zvýší se tedy i jejich inhibiční účinky na přenos signálu a obrat 5-HT, což vede k menšímu uvolňování 5-HT do synaptické štěrbiny v místě nervového zakončení (91). Za takových podmínek nevede další blokáda uptake 5-HT v nervových zakončeních ke zvýšení koncentrace 5-HT ve štěrbině. Akutní podání SRI může zvýšit uvolňování 5-HT v některých oblastech, ale v jiných nikoli, v závislosti na hustotě 5-HT1A autoreceptorů na buněčných tělech projektujících neuronů.
Chronické podávání SRI vede ke snížení inhibiční kontroly uvolňování 5-HT přes desenzibilizaci 5-HT1A a 5-HT1B autoreceptorů, tzn. že při zvýšení koncentrace 5-HT není inhibován přenos signálu (šíření akčního potenciálu) a další uvolňování 5-HT. Blokáda uptake tedy může vést ke zvýšení koncentrace 5-HT v synaptické štěrbině v určitých oblastech mozku (7, 151). Desenzibilizace autoreceptorů může být způsobena snížením hustoty receptorů, ale může zahrnovat také odpojení vazebných míst od dalších složek transdukčního mechanismu nebo změny a aktivitě tryptofanhydroxylasy. Dlouhodobá blokáda transportních proteinů pro 5-HT může vést také ke snížení zpětného transportu serotoninu, pravděpodobně přes snížení počtu příslušných transportních proteinů (255). TCA, i když jsou často inhibitory reuptake 5-HT, nemění funkci 5-HT autoreceptorů. Je to zřejmě způsobeno rychlou přeměnou TCA na metabolity, které jsou jen slabými inhibitory reuptake 5-HT (38).
Určitou nestabilitu hypotéz o mechanismech účinků SRI ukazují jednak některá měření hladin 5-HT v mozku mikrodialýzou, kdy nebyla potvrzena desenzibilizace somatodendritických 5-HT1A autoreceptorů po dlouhodobém podávání citalopramu (119), jednak paradoxní účinky tianeptinu. Tianeptin je tricyklické antidepresivum, které in vivo stimuluje uptake 5-HT v mozkové kůře a hippokampu, přičemž nemá vliv na uptake NA nebo DA (209, 84), a které snižuje jevy zprostředkované 5-HT2 receptory. Interakce tianeptinu s SRI a jeho schopnost redukovat serotoninový syndrom ukazují, že in vivo účinky tianeptinu na 5-HT systém jsou pravděpodobně způsobeny zvýšením reuptake 5-HT (69). Opakované podávání tianeptinu vede v určitých oblastech mozku ke snížení exprese mRNA pro serotoninový transportní protein (156) podobně jako je tomu po podávání inhibitorů reuptake 5-HT. Možná vysvětlení antidepresivních účinků tianeptinu zahrnují tyto možnosti (4): 1) při depresi dochází spíše k nadměrné serotoninergní neurotransmisi, než k deficitu 5-HT; 2) inhibice reuptake 5-HT nevysvětluje klinickou účinnost SSRI; 3) tianeptin a SSRI jsou účinné v různých typech depresí charakterizovaných buď nadměrnou, nebo sníženou 5-HT neurotransmisí; 4) deprese je spíše důsledek nestability 5-HT mechanismů, než jejich nadměrné či nedostatečné činnosti; 5) tianeptin je účinný přes jiné systémy, např. dopaminergní (176).

Obr. 3: Ovlivnění přenosu signálu zprostředkovaného serotoninem
V buňce jsou monoaminové neuromediátory deaminovány enzymem monoaminoxidasou typu A. Inhibitory MAO-A jsou účinnými antidepresivy (202, 333). Podobně jako u SSRI vede jejich podávání nejprve ke snížení aktivity neuronů obsahujících 5-HT a během 3 týdnů léčby nastává obnova normálního stavu (38). Tato obnova je důsledkem asi trojnásobného snížení senzitivity somatodendritických 5-HT1A autoreceptorů. Desenzibilizace 5-HT1A nevysvětluje zvýšení transmise zprostředkované 5-HT, neboť inhibice MAO-A sama o sobě nezvyšuje uvolňování 5-HT a navíc dlouhodobé podávání MAOI nevede k desenzibilizaci terminálních 5-HT autoreceptorů. MAOI však zvyšují také mozkové hladiny NA. Proto byla studována funkce a2-AR na zakončeních neuronů obsahujících 5-HT. Aktivace těchto receptorů inhibuje uvolňování 5-HT stejně jako aktivace 5-HT1B autoreceptorů. Bylo potvrzeno, že dlouhodobé podávání MAOI vede k desenzibilizaci a2-AR na zakončeních neuronů obsahujících 5-HT v hippokampu (216, 40).
Podobné závěry jako pro SSRI lze použít i pro antidepresiva, která jsou agonisty 5-HT1A receptorů. Působením na presynaptické 5-HT1A autoreceptory snižují aktivitu 5-HT neuronů a je tedy uvolňováno méně 5-HT do synaptických štěrbin v kůře. Dlouhodobé podávání vede jednak k normalizaci obratu 5-HT, jako výsledku desenzibilizace somatodendritických 5-HT1A autoreceptorů, jednak ke snížení počtu kortikálních 5-HT2 receptorů. Nedochází však k desenzibilizaci postsynaptických 5-HT1A receptorů v hippokampu (38). Předpokládá se, že dlouhodobé podávání agonistů 5-HT1A receptorů vede ke zvýšené aktivaci postsynaptických 5-HT1A receptorů v důsledku normalizace uvolňování 5-HT a současného působení exogenního 5-HT1A agonisty.
a2-adrenergní autoreceptory byly zjištěny v mozkové kůře a jejich blokáda vede ke zvýšenému uvolňování NA. a2-adrenergní heteroceptory existují také na serotoninergních zakončeních v mozkové kůře a jejich blokáda usnadňuje uvolňování 5-HT (268). Podávání antagonistů a2-AR tedy vede k situaci podobné jako po podávání inhibitorů reuptake NA nebo 5-HT. Předpokládá se, že antidepresivní účinky některých antagonistů a2-AR spočívají v této jejich schopnosti zvyšovat uvolňování NA a/nebo 5-HT. Podávají se obvykle samostatně nebo v kombinaci s inhibitory reuptake monoaminů. Přesvědčivé výsledky však zatím existují pouze pro antidepresiva, která nejsou selektivními antagonisty a2-AR a navíc mají a2-AR několik podtypů (171).
ECT je velmi účinná antidepresivní léčba. Způsobuje např. zvýšení prostupnosti hematoencefalické bariéry, průtoku krve a aktivity ATPas a také dlouhodobé snížení aktivity fosfolipasy A2 (PLA2). Terapeutické účinky ECT zřejmě vyplývají z toho, že ovlivňuje všechny neuromediátorové systémy v mozku. Opakovaná ECT vede k relativně rychlé regulaci snížením počtu b-AR v mozkové kůře a v hippokampu, ke snížení počtu a2-AR a acetylcholinových muskarinových receptorů, ale také ke zvýšení počtu 5-HT2 a a1B-adrenergních receptorů, stimulaci dopaminergního systému, ovlivnění GABAergního systému atd. (165, 144, 166, 145, 146, 244). ECT indukuje senzitizaci postsynaptických 5-HT1A receptorů v hippokampu (38, 129), ale neovlivňuje přitom funkci neuronů obsahujících 5-HT v místě buněčných těl a nervových zakončení, včetně senzitivity somatodendritických 5-HT1A autoreceptorů (39). Tzn., že pro danou léčbu nemusí být všechny receptory stejného podtypu (tj. 5-HT1A receptory) v různých oblastech mozku ovlivněny podobným způsobem. Mechanismy terapeutických účinků ECT, stejně jako účinků antidepresiv, nejsou dosud známy.