Receptorové hypotézy afektivních poruch vycházejí z možnosti ovlivnění přenosu nervového signálu nejen dostupností neuromediátorů, ale i počtem, afinitou nebo senzitivitou pre- a postsynaptických receptorů. Podkladem pro vznik těchto hypotéz bylo zjištění časové korelace mezi terapeutickými účinky a adaptivními změnami určitých receptorových systémů po dlouhodobém podávání antidepresiv. Postsynaptické účinky antidepresiv přitom mohou být důsledkem jejich různých účinků presynaptických, jako je inhibice reuptake neuromediátorů nebo inhibice degradace neuromediátorů monoaminoxidasou typu A (MAO-A), které vedou ke zvýšení koncentrací monoaminových neuromediátorů v synaptických štěrbinách.
Vývoj novějších antidepresiv, která neinhibují reuptake neuromediátorů, ani nejsou inhibitory MAO, dále zpochybnil schopnost neuromediátorových hypotéz vysvětlit mechanismy vzniku afektivních poruch. Předpoklad, že za terapeutické účinky antidepresiv jsou odpovědné adaptivní změny vyvolané jejich primárními účinky, vedl k řadě zjištění o změnách v neuromediátorech a jejich metabolitech a především v senzitivitě a hustotě neuromediátorových receptorů při depresi a její léčbě (318, 130). Receptorové hypotézy afektivních poruch vycházejí z údajů o vlivu onemocnění a léčby antidepresivy především na systémy noradrenergní a serotoninergní, ale pozornost je věnována i systémům dopaminergním, GABAergním, cholinergním a peptidergním (51).
Adaptivní změny v aktivitě mozkové tyrosinhydroxylasy pozorované po dlouhodobém podávání TCA se staly podkladem pro modifikaci hypotézy biogenních aminů (294), podle níž dochází při depresi ke zvýšené stimulaci katecholaminových receptorů díky nízkým hladinám katechol-O-metyltransferasy (COMT, enzym katalyzující metylaci katecholaminů v synaptické štěrbině) a tento jev je částečně kompenzován sníženou frekvencí vzniku nervového vzruchu doprovázenou sníženou aktivitou tyrosinhydroxylasy. Snížený metabolismus monoaminů je tedy sekundární vzhledem k hypersenzitivitě postsynaptických monoaminových receptorů, tj. k monoaminergní hyperfunkci. TCA akutně usnadňují transmisi a dlouhodobě vedou k dalšímu kompenzačnímu snížení frekvence šíření vzruchu a aktivity tyrosinhydroxylasy. Výsledkem je snížená centrální katecholaminergní aktivita. Objevily se tak alternativní hypotézy afektivních poruch k dříve formulovaným hypotézám považujícím za primární nedostatek monoaminových neuromediátorů vedoucí k monoaminergní hypofunkci.
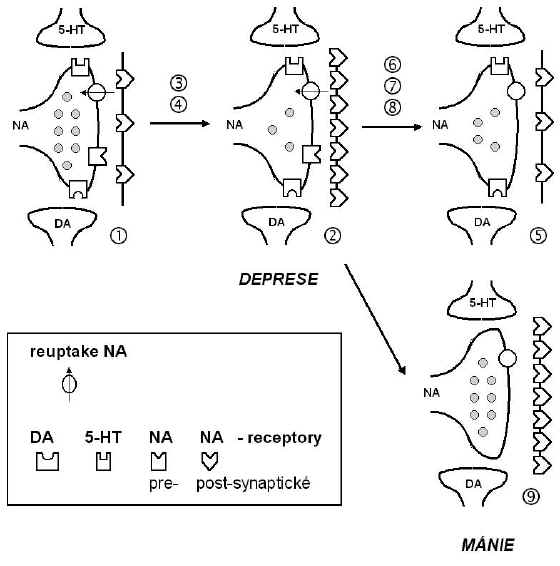
Podobně podle klasické noradrenalinové receptorové hypotézy afektivních poruch může být depresivní porucha spojena se zvýšenou senzitivitou centrálních noradrenergních receptorů, přičemž terapeutické účinky antidepresiv jsou vztaženy k dlouhodobým adaptivním změnám v senzitivitě adenylátcyklasového systému spojeného s postsynaptickými noradrenergními receptory (340, 341). Nižší dostupnost katecholaminů při depresi může být způsobena kompenzačním snížením jejich biosyntézy zprostředkovaném receptory (318). Tato hypotéza byla upřesněna tím, že desenzibilizace AC po chronickém podávání antidepresiv je způsobena snížením počtu (downregulací) b1-AR (22, 213) a/nebo ztrátou či inaktivací příslušných vysokoafinitních vazebných míst (351). Pro kontrolu hustoty b1-AR je přitom důležitá koncentrace neuromediátoru v synaptické štěrbině, ale nemusí to být jediný mechanismus, kterým lze regulovat počet a senzitivitu těchto receptorů (Obr. 2).
Hypotéza, že antidepresiva účinkují přes desenzibilizaci určitých katecholaminových receptorů byla rozšířena o zjištění, že tyto účinky antidepresiv vyžadují normální hladiny serotoninu v mozku (139, 49, 265, 320, 266). Později bylo zjištěno, že intrasynaptické hladiny 5-HT ovlivňují také rychlost obnovy b-AR po regulaci snížením jejich počtu (8).
Regulace snížením počtu b-AR po dlouhodobém podávání antidepresiv podpořila hypotézy, podle kterých účinkují antidepresiva přes snížení noradrenergní neurotransmise. Bylo však také zjištěno, že dlouhodobé podávání TCA nebo opakovaná ECT vedou ke zvýšení aktivace AC guanosin-5’-trifosfátem (GTP), pravděpodobně přes změny v regulačních a katalytických podjednotkách tohoto enzymu (208, 3). Je také možné, že vliv inhibice reuptake překryje regulaci snížením počtu b-AR tak, že výsledným efektem podávání antidepresiv je zvýšení monoaminergní neurotransmise (jak to odpovídá klasickým východiskům teorií afektivních poruch). Toto hledisko podporují též některá neuroendokrinní měření (132).
Obecná katecholaminová hypotéza je formulována takto (276): „Supersenzitivita určitých katecholaminových receptorů při nízkých hladinách 5-HT je biochemickým základem deprese“. Tato hypotéza je elegantní, ale nelze ji považovat za prokázanou, neboť klinické studie dostatečně nepotvrdily přítomnost takových supersenzitivních receptorů u depresivně nemocných (210, 114). U násilných sebevražd bylo sice pozorováno zvýšení počtu 5-HT2 a b-adrenergních receptorových vazebných míst ve frontální kůře (196), jiní autoři však u sebevrahů s diagnózou deprese nalezli pouze významné snížení počtu b-adrenoceptorových vazebných míst v thalamu a Brodmanově aree 38, přičemž nižší počet b-AR ve spánkové kůře byl zjištěn i u sebevrahů, kteří neužívali antidepresiva (73).
Významnou úlohu může mít regulace uvolňování neuromediátorů přes aktivaci presynaptických autoreceptorů, která byla popsána nejprve pro NA a potom i pro další mediátory (159, 160, 162, 317). Zvýšení dostupnosti katecholaminů inhibicí reuptake nebo inhibicí MAO může totiž vést k desenzibilizaci presynaptických autoreceptorů (inhibičních) a tím k dalšímu zvýšení uvolňování NA nebo 5-HT. Je tomu tak v případě a2-AR, které jsou lokalizovány jak postsynapticky, tak na buněčných tělech a presynaptických membránách neuronů. Jejich aktivace agonisty přitom vede k hyperpolarizaci membrány, tj. ke snížení elektrické aktivity buňky v daném místě. Hypotéza o úloze presynaptických a2-adrenoceptorů říká, že při depresi je zvýšená hustota těchto receptorů ve vysokoafinitních stavech. Podkladem pro její formulaci bylo pozorování zvýšeného počtu a odezvy a2-AR na trombocytech nebo v mozcích depresivních pacientů a normalizace stavu léčbou některými antidepresivy (93, 94, 95, 96, 254, 204). Vzhledem k nedostatečné selektivitě použitých ligandů může být toto zvýšení způsobeno jinými typy receptorů např. imidazolinovými receptory, které by rovněž mohly mít úlohu v patogenezi deprese (97).
Oproti tomu se předpokládá snížená senzitivita postsynaptických a2-adrenoceptorů při depresi (263). Tato hypotéza vychází ze zjištění relativně zvýšených hladin kortisolu u depresivně nemocných v odezvě na podání yohimbinu, což je antagonista a2-AR, který zvyšuje obrat NA.
Je třeba mít na vědomí, že dosud není jasné, zda léčba antidepresivy zvyšuje nebo snižuje neurotransmisi přes noradrenergní synapse. V současné době se pozornost věnuje mechanismům zvýšení serotoninergní aktivity vlivem dlouhodobého podávání antidepresiv, na němž se může podílet jak regulace snížením počtu 5-HT2 receptorů (309) a presynaptických a somatodendritických autoreceptorů (5-HT1B, 5-HT1A), tak interakce s noradrenergním systémem přes presynaptické a2-AR na neuronech obsahujících 5-HT.
Sjednocující adrenoreceptorová hypotéza afektivních poruch (173) předpokládá, že onemocnění nebo jeho léčba psychofarmaky jsou určeny primární abnormalitou v některém neuromediátorovém systému (serotoninergním, noradrenergním, GABAergním, peptidergním, cholinergním apod.) ovlivňujícím aktivitu LC, funkci noradrenergních nervových zakončení nebo dostupnost NA v synapsích. Tato hypotéza pokládá za společné a konečné stimulační nebo inhibiční účinky na buňky v LC. Afektivní poruchy potom mohou mít základ v kterémkoli neuromediátorovém systému zasahujícím do LC. Podobnost mánie a deprese lze vysvětlit tím, že obě poruchy se projevují prostřednictvím noradrenergní aktivity LC. Léčba potom může být směrována jak na odstranění primární abnormality (pokud je známa), tak na ovlivnění jiného neuromediátorového systému, který zasahuje do noradrenergní aktivity LC. Uvedená hypotéza vysvětluje odlišné výsledky biochemických měření v CSF, krvi a moči pacientů s podobnou afektivní poruchou. Byla také vyslovena domněnka, že klinická podobnost afektivních poruch, schizofrenie a úzkostných poruch může být dána změnami v adrenergní aktivitě LC.

Obr. 2 Klasická noradrenalinová receptorová hypotéza
Normální
noradrenergní zakončení uvolňuje dostatek neuromediátoru À.
Při depresivní poruše dochází ke zvýšení počtu postsynaptických b-adrenoceptorů
Á. K tomuto zvýšení
může dojít v důsledku sníženého uvolňování NA (+ narušení
interakcí s 5-HT systémem) Â nebo v důsledku
přechodného zvýšení NA (+ narušení interakcí s DA systémem) Ã.
Léčba vede po dostatečně dlouhé době ke snížení počtu receptorů Ä.
Toto snížení může být důsledkem inhibice reuptake NA (zvýšení
koncentrace NA ve štěrbině) Å, nebo
interakcí léčiv s receptory Æ, nebo
regulace přes interagující serotoninergní a dopaminergní systémy Ç.
Zvýšená aktivace b-adrenoceptorů
může vést i při snížení jejich počtu ke zvýšené tvorbě cAMP. Přechodná
obnova dostupnosti neuromediátoru při zvýšené denzitě receptorů může způsobit přesmyk
do manické fáze È.