Mnoho základních buněčných procesů, včetně zpracování informací, nitrobuněčného a mezibuněčného přenosu signálu, se odehrává v plazmatických membránách nebo jiných membránových strukturách. V této kapitole jsou uvedeny pouze základní informace o stavbě a vlastnostech membrán s ohledem na jejich funkci při šíření nervového signálu.
Biomembrány jsou tenké vrstvy oddělující buňku nebo její části od okolního prostředí. Jsou tvořeny vhodně uspořádanými lipidy a proteiny s malým množstvím vázaných cukrů. Jejich funkce spočívá v aktivní regulaci složení nitrobuněčného prostředí. Plazmatická membrána ohraničuje celou buňku, další membrány vymezují řadu organel eukaryot (jádro, mitochondrie, endoplazmatické retikulum, Golgiho aparát, synaptické váčky atd.).
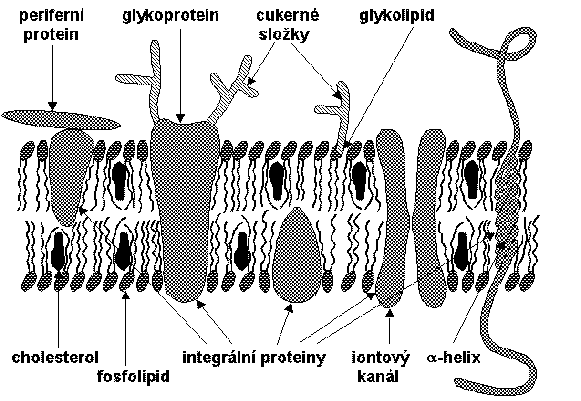
Buněčné membrány jsou tvořeny především lipidy, steroly, proteiny, glykolipidy a glykoproteiny. Mají jednotný organizační princip, tj. uspořádání většiny membránových lipidů do dvojné vrstvy (o tloušťce kolem 6 nm) s více či méně zanořenými proteiny. Poměr lipidů, proteinů a cukrů (vázaných v glykolipidech a glykoproteinech) se u různých membrán velmi liší. Lipidy tvoří 24% (ve vnitřní membráně mitochondrií) až 79% (v myelinové pochvě), proteiny 18% až 76% a cukry 2% až 10% z celkové hmotnosti membránových molekul. Lipidová část membrán je směsí především fosfolipidů, glykolipidů, sfingomyelinu, kardiolipinu a cholesterolu, přičemž zastoupení těchto složek je v různých membránách velmi odlišné.
Značná část buněčných proteinů se vyskytuje pouze v membránách. Membránové proteiny zajišťují řadu specifických procesů spojených s transportními a rozpoznávacími funkcemi membrán (pumpy, nosiče, iontové kanály, receptory, enzymy apod.). Podle spojení s membránou se tyto proteiny rozdělují na integrální (vážou se k membráně poměrně silně hydrofobními vazbami; jsou zanořeny do dvojné vrstvy nebo ji překlenují) a periferní (vážou se k povrchu membrán slaběji, obvykle iontovými nebo vodíkovými vazbami k integrálním proteinům; často jsou v membráně uchyceny pomocí glykosyfosfatidylinositolové kotvy). Integrální proteiny jsou amfifilní, neboť části vystavené vodnému prostředí jsou polární, zatímco části uvnitř membrány jsou na svém povrchu hydrofobní. Není znám protein, který by byl v membráně zcela ukryt a nebyl tedy v interakci s vodným prostředím vně či uvnitř buňky. Základními atributy biomembrán jsou:
propustnost a řízený transmembránový transport látek;
dynamika membránových molekul;
elektrické vlastnosti.
MODEL BUNĚČNÉ MEMBRÁNY

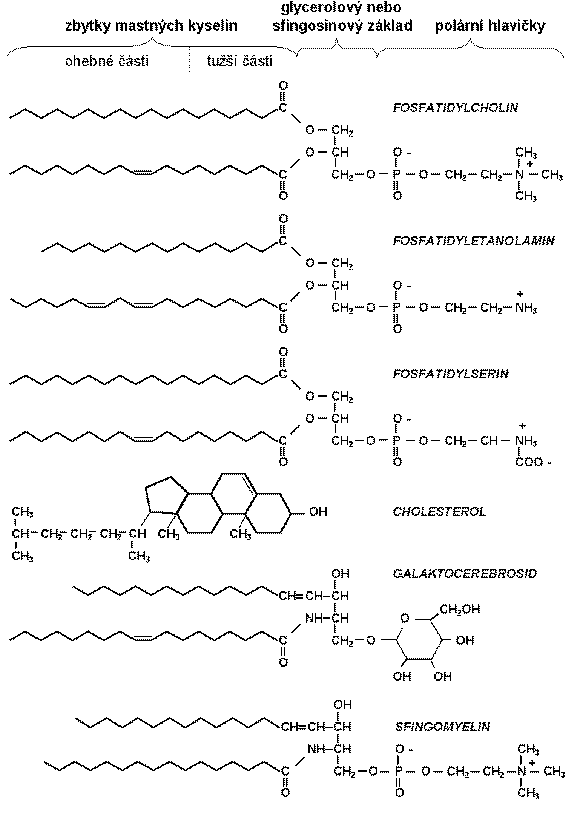
Hlavní lipidové složky biomembrán jsou obvykle glycerofosfolipidy odvozené z sn-glycerol-3-fosfátu, který je na uhlících 1 a 2 esterifikován mastnými kyselinami a na fosforylové skupině je esterifikován různými skupinami. Jedná se tedy o amfifilní molekuly uspořádané v membráně ve dvojné vrstvě se zbytky mastných kyselin směřujícími dovnitř a s polárními fosforylovanými hlavičkami vně. Nejběžněji se vyskytující glycerofosfolipidy jsou fosfatidylcholin (lecitin), fosfatidyletanolamin, fosfatidylserin, fosfatidylinositol, fosfatidylglycerol, difosfatidylglycerol (kardiolipin) a kyselina fosfatidová.
Podstatnou složkou některých biomembrán jsou sfingolipidy odvozené ze sfingosinu, resp. z jeho N-acyl-derivátů, ceramidů. Nejčastější sfingolipidy jsou sfingomyeliny (sfingofosfolipidy), cerebrosidy (jednoduché sfingoglykolipidy, které nemají fosfátovou skupinu a obvykle ani náboj; v mozkových buňkách se hojně vyskytují galaktocerebrosidy) a gangliosidy (sfingoglykolipidy, které obsahují alespoň jeden zbytek kyseliny sialové; tvoří asi 6% mozkových lipidů a jsou lokalizovány v povrchové vrstvě membrány, kde mají receptorovou funkci).
Významnou složkou živočišných membrán je cholesterol, který se vyskytuje hlavně v plazmatických membránách, méně v membránách organel. Nemá náboj, ale díky OH skupině je slabě amfifilní. Významně ovlivňuje strukturu a fyzikální vlastnosti lipidových dvojných vrstev.
U živočichů se v lipidech často vyskytují zbytky mastných kyselin se 16 a 18 uhlíkovými atomy - palmitová (16:0), stearová (18:0), olejová (18:1w-9) a linolová (18:2w-6), ale důležité pro funkci a přenos signálu v buňce mohou být i méně četné mastné kyseliny s 20 až 24 atomy C, jako je kyselina arachidonová (20:4w-6), dokosahexaenová (22:6w-3), lignocerová (24:0), nervonová (24:1w-9) a další.
Biosyntéza membránových lipidů probíhá v membránách; potřebné enzymy jsou většinou integrální proteiny. V eukaryontních buňkách jsou lipidy syntetizovány na cytoplazmatické straně endoplazmatického retikula, odkud jsou transportovány k jiným membránám. Byly popsány různé rychlosti obnovy pro různé části molekul mozkových fosfolipidů; např. biologické poločasy u lecitinové frakce jsou pro glycerol 2,9 dnů, pro cholin 11,7 dnů a pro fosfátovou skupinu (Pi) 18,6 dnů.
MEMBRÁNOVÉ LIPIDY
Lipidové dvojné vrstvy jsou málo propustné pro ionty a polární molekuly. Procesy spojené s přenosem molekul přes membránu jsou dvojího typu:
1. nespecifická permeace (lze ji charakterizovat parametry prosté difúze; s rostoucí rozpustností v lipidech je pasivní difúze látek přes membránu rychlejší);
2. zprostředkovaný transport.
Na zprostředkovaném transportu látek se obvykle podílejí membránové proteiny (přenašeče, transportéry), někdy také pinocytóza nebo exocytóza. Tento transport může být jednak pasivní (tzv. usnadněná difúze), při němž jsou specifické molekuly přenášeny ve směru svého koncentračního gradientu, jednak aktivní, při němž dochází k pohybu určitých molekul proti jejich koncentračnímu gradientu. Pro přenos nervového vzruchu jsou zvláště důležité ionofory, které mění propustnost membrány pro různé ionty. Ionofory jsou dvojího typu:
1. přenašeče - vážou určitý ion na jedné straně membrány a uvolňují jej na straně druhé;
2. iontové kanály - specializované proteinové komplexy překlenující membránu a obsahující hydrofilní póry, jimiž mohou ionty difundovat ve směru svých elektrochemických gradientů.
Hlavní kritéria pro klasifikaci iontových kanálů jsou: vodivost, iontová selektivita, řízení (tj. způsob jejich otevírání a zavírání) a citlivost na blokátory a modulátory vlastností kanálů. Pro studium vlastností těchto membránových proteinů se používá metoda terčíkového zámku („patch clamp“) umožňující měření proudu procházejícího jednotlivými iontovými kanály. Proud procházející jedním iontovým kanálem je typicky 1-20 pA, což odpovídá přenosu 0,6-12.107 iontů za sekundu. Tato rychlost přenosu odpovídá tomu, že ionty přes pór difundují. Aktivní transport iontů zprostředkovaný přenašečem je mnohem pomalejší (102-104 iontů za sekundu).
Vodivost iontových kanálů se pohybuje obvykle v rozsahu 5-400 pS (S - siemens, [W-1]). Vyskytují se kanály propouštějící buď kationy, nebo anionty, nebo obojí, ale existují i kanály selektivní pro jednotlivé ionty (sodíkový, draslíkový, vapníkový, chlorový). Některé kanály jsou stále otevřené, zatímco jiné jsou řízené. Prosakovací („leakage“) kanály jsou tvořeny transmembránovými proteiny a umožňují difúzi polárních molekul (např. vody). Řízené kanály se vyskytují v otevřeném, nebo zavřeném stavu, přičemž dynamická rovnováha těchto stavů může být ovlivněna změnami membránového potenciálu - napěťově řízené kanály, nebo vazbou ligandu - ligandem řízené kanály (ligandem může být např. neuromediátor, hormon, nitrobuněčné Ca2+, cAMP, G protein), nebo fyzikálními vlivy (např. teplotou).
POHYB LÁTEK PŘES MEMBRÁNU
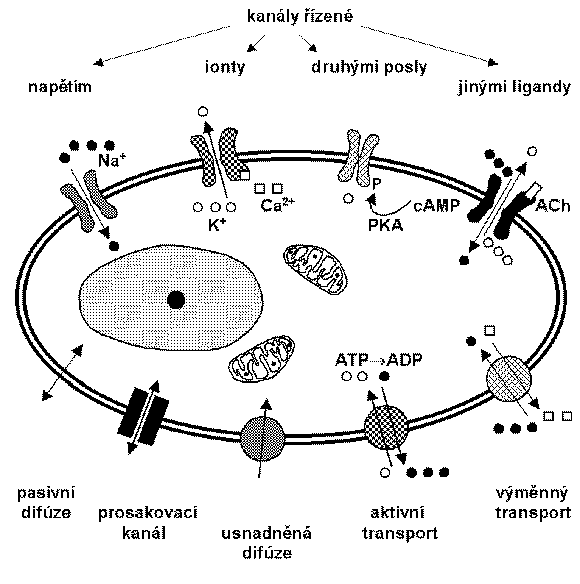
Membránové přenašeče (transportní proteiny, transportéry, bílkovinné nosiče, „carriers“) umožňují jednak usnadněnou difúzi (přenos ve směru chemického nebo elektrického gradientu), jednak aktivní transport (proti gradientu). Tyto proteiny mohou být uniportní (přenášejí jednu látku jedním směrem), symportní (přenášejí více látek jedním směrem) nebo antiportní (vyměňují jednu látku za jinou). Aktivní transport může být primární - využívá volnou energii získanou často hydrolýzou ATP, nebo sekundární - využívá energii uloženou v gradientu elektrochemického potenciálu přes membránu.
K toku iontů přes membránu dochází nejen při aktivaci iontových kanálů, ale i v ustáleném stavu. Vyrovnání iontových gradientů by znamenalo buněčnou smrt, proto jsou průběžně obnovovány pomocí transportních proteinů označovaných jako iontové pumpy (primární aktivní transport). Nejvýznamnější je sodno-draselná pumpa, resp. sodno-draselná ATPasa (Na+K+-ATPasa), která přenáší sodík vně a draslík dovnitř buňky. Energie získaná hydrolýzou jedné molekuly ATP umožňuje současný transport 3 iontů Na+ ven a 2 iontů K+ dovnitř buňky, čímž se udržují nebo obnovují základní iontové gradienty. Jedná se o elektrogenní pumpu, jejíž činnost způsobuje hyperpolarizaci membrány a tedy do určité míry přispívá k nastavení klidového potenciálu.
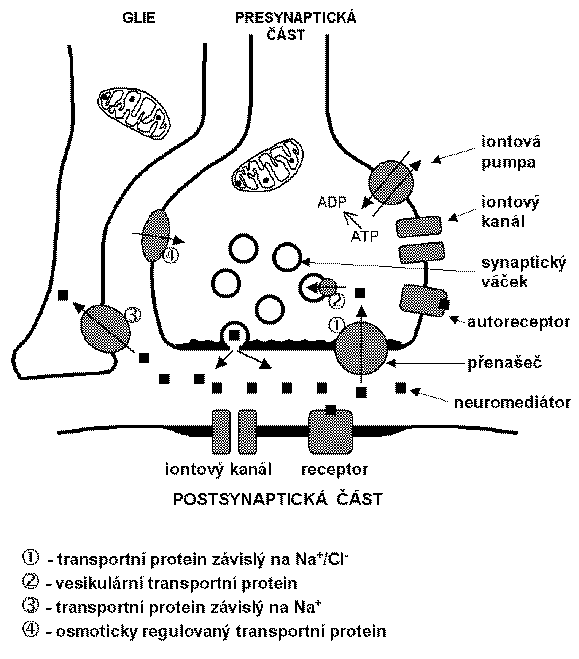
Pro přenos signálu v CNS jsou důležité tyto přenašeče pro neuromediátory:
1. Transportní proteiny závislé na Na+ a Cl-. Uptake neuromediátoru uskutečňovaný těmito přenašeči je závislý na kotransportu Na+ a Cl-. Jejich význam v neuronální aktivitě je odvozován hlavně z účinků některých psychotropních látek (antidepresiv, kokainu, amfetaminu) blokujících zpětný aktivní transport (reuptake) neuromediátorů do presynaptických zakončení. Aktivita těchto transportních proteinů tak ovlivňuje dobu setrvání a koncentraci neuromediátoru uvolněného do synaptické štěrbiny. Jsou lokalizovány v plazmatické membráně a mají 12 transmembránových domén. Slouží k přenosu serotoninu (5-HT), noradrenalinu, dopaminu, GABA, prolinu, glycinu, taurinu, betainu, kreatinu.
2. Vezikulární transportní proteiny. Umožňují akumulaci neuromediátorů v synaptických váčcích závislou na pH. Působí na ně např. reserpin a tetrabenazin.
3. Transportní proteiny závislé na Na+. Používají glutamát a aspartát jako substráty; nacházejí se hlavně v gliových buňkách. Mají 6-12 transmembránových domén; selektivním inhibitorem je např. kainát.
Transportní proteiny regulované osmoticky (osiřelé transportní proteiny, „orphan transporters“); vyskytují se v mozku i v periferii.
MEMBRÁNOVÉ PŘENAŠEČE PRO NEUROMEDIÁTORY
(Podle M.G.Caron: TiPS
Receptor and Ion Channel Nomenclature Supplement 1996.)
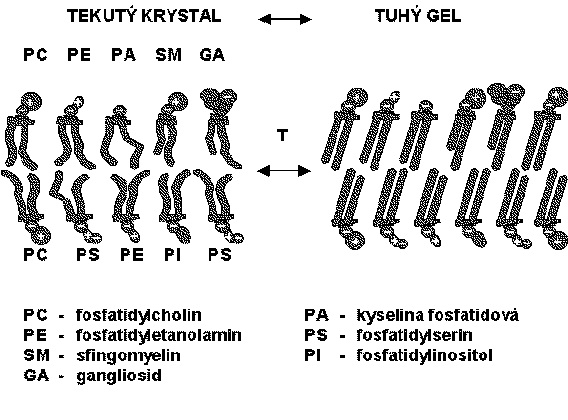
Strukturním základem biomembrán určujícím jejich dynamické vlastnosti je dvojná vrstva tvořená glycerofosfolipidy a sfingolipidy. Představy o těchto vlastnostech membrán vycházejí ze známého, stále upřesňovaného Singerova a Nicolsonova modelu tekuté mozaiky z roku 1972. Tento model popisuje heterogenitu membrán, tekutý stav většiny lipidů za fyziologických podmínek a translační a rotační pohyblivost membránových molekul.
Heterogenita v rovině horizontální se projevuje nerovnoměrným rozdělením jak membránových proteinů (např. tvorbou shluků), tak lipidů (tvorba domén). Výrazná je i asymetrie v rovině vertikální, kterou se rozumí především různé vlastnosti proteinů nebo jejich částí na vnějším a vnitřním povrchu membrány a různé zastoupení tříd lipidů v povrchové a vnitřní části lipidové dvojné vrstvy. Bylo potvrzeno, že lokalizace většiny negativně nabitých fosfolipidů na vnitřním povrchu membrány souvisí s jejich úlohou v přenosu signálu a ve funkci řady membránových enzymů. Glykolipidy a cukerné složky glykoproteinů se nacházejí pouze na vnější straně membrány.
Tekutým stavem membrány se rozumí stav uspořádanosti molekul fosfolipidů do dvojné vrstvy tak, že jejich polární části jsou orientovány vně a hydrofobní zbytky mastných kyselin dovnitř, přičemž je ale umožněn rotační a translační pohyb těchto molekul. Teplota, při níž dochází k přechodu membrány, nebo její části, ze stavu gelového do stavu fluidního se nazývá teplota fázového přechodu.
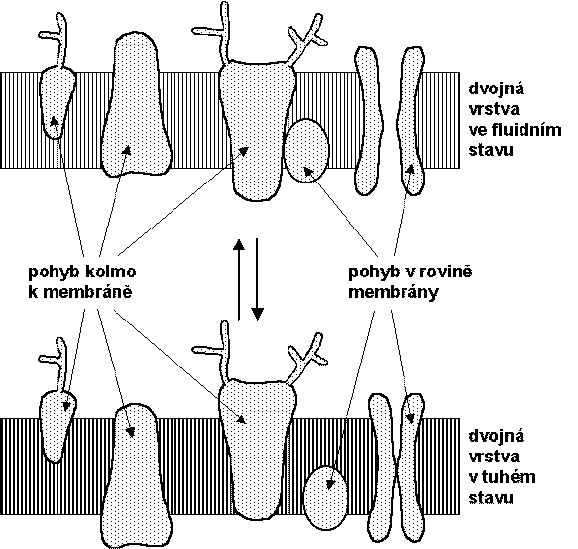
Membránové molekuly jsou za fyziologických podmínek vysoce pohyblivé v rovině dvojné vrstvy (podélná, laterální difúze). Oproti tomu příčná difúze (flip-flop, překlápění), tj. přesmyk lipidové molekuly z vnější části dvojné vrstvy do vnitřní nebo naopak, je velmi pomalá (poločas několik dnů); v buňkách může být toto překlápění katalyzováno flipázami, takže nově syntetizované lipidy se mohou rychle dostat na druhou stranu. Rovněž nepolární zbytky mastných kyselin v lipidech jsou za fyziologických podmínek vysoce pohyblivé, neboť dochází k rotaci kolem vazeb. Dvojné vazby nenasycených mastných kyselin jsou v konformaci cis, což způsobuje ohyb řetězce o 30° a snížení vazebných sil mezi membránovými lipidy. Se snížením teploty dochází k uspořádávání membránových molekul a ke snížení jejich laterální i rotační pohyblivosti. Přechod lipidové dvojné vrstvy z fluidního do zatuhlého stavu je přirovnáván k přechodu ze stavu tekutého krystalu do stavu tuhého gelu. Na tekutost, resp. fluiditu lipidové dvojné vrstvy má kromě teploty vliv také přítomnost cholesterolu (snižuje tekutost membrán), stupeň nenasycenosti zbytků mastných kyselin a dále řada fyzikálních a chemických činitelů.
Základní fyzikální vlastnosti buněčných membrán (model tekuté mozaiky)
heterogenita v rovině horizontální i vertikální
tekutý stav většiny lipidů za fyziologických podmínek
translační a rotační pohyblivost membránových molekul
FÁZOVÝ PŘECHOD LIPIDOVÉ DVOJNÉ VRSTVY
K pozorovatelným změnám v distribuci molekul v rovině membrány dochází během milisekund, k rotační reorientaci malých molekul nebo částí makromolekul dochází během nanosekund. Heterogenita membrán způsobuje, že laterální pohyblivost molekul v rovině membrány je menší, než by odpovídalo jejich rotační pohyblivosti.
Difúzní pohyb molekul v membráně může být sledován řadou spektroskopických metod, především fluorescenčně, elektronovou spinovou rezonancí, jadernou magnetickou rezonancí nebo Ramanovým rozptylem. Tyto metody jsou založeny na měření určitého signálu molekul, skupin, či atomů lokalizovaných v membráně. Často se používá zavedení sond nebo značek do membrány; jedná se o molekuly citlivé na vlastnosti mikrookolí, které samy neovlivňují sledovaný systém, ale umožňují detekovat změny vlastností tohoto systému.
Často měřeným parametrem charakterizujícím rotační pohyblivost a průměrné uspořádání membránových molekul je mikroviskozita (převrácená hodnota fluidity). Obvykle se používá při určování relativních změn v membráně při změnách jejího složení nebo vlivem fyzikálních či chemických faktorů, včetně psychofarmak. Lze ji měřit např. metodou fluorescenčních sond, což je metoda založená na měření intenzity, emisních spekter nebo polarizace fluorescence malých hydrofobních nebo amfifilních molekul, jejichž fluorescenční parametry se mění v závislosti na některých vlastnostech jejich mikrookolí. Po vazbě do membrány mohou tyto sondy poskytovat informace o pohyblivosti membránových molekul nebo jejich částí, o membránovém potenciálu nebo o polaritě místa, v němž se nacházejí. Kvalitativně lze říci, že zvýšení anizotropie fluorescence vhodné sondy znamená zvýšení mikroviskozity (snížení fluidity) a naopak. Interpretace výsledků podobných měření závisí na tom, které změny mikrookolí sonda zachycuje a jaká je její lokalizace v membráně. Kromě sond citlivých na fluiditu membrán jsou i sondy poskytující informace o změnách membránového potenciálu, pH, lipidových domén apod.
Nejpoužívanější fluorescenční sondou pro měření změn mikroviskozity je 1,6-difenyl-1,3,5-hexatrien (DPH). DPH nemá náboj a je lokalizován v hydrofobním vnitřku lipidové dvojné vrstvy a v hydrofobních vazebných místech proteinů. Tyčinkovitý tvar molekul DPH způsobuje jejich částečnou uspořádanost v membránách. Používá se také trimetylamoniový derivát DPH (TMA-DPH), který má podobné fluorescenční vlastnosti, ale vzhledem ke kladnému náboji, který nese, jsou molekuly této sondy lokalizovány v povrchových vrstvách membrán a jsou orientovány podél uhlovodíkových řetězců zbytků mastných kyselin.
Modulátory
fluidity buněčných membrán
1.
zastoupení
nenasycených mastných kyselin (změny
při hydrogenaci cis-nenasycených
zbytků mastných kyselin, při oxidaci nenasycených lipidů, apod.)
2.
poměr
sfingomyelin/fosfatidylcholin
3.
poměr
cholesterol/celkové lipidy
4.
působení
některých biologicky aktivních látek (inzulínu,
lokálních anestetik, etanolu, atd.)
5.
fyzikální
a chemické vlivy (teplota,
tlak, pH, membránový potenciál, koncentrace Ca2+)
Vazebné síly
mezi membránovými molekulami
1.
Van
der Waalsovy síly (interakce mezi elektroneutrálními molekulami nebo jejich
částmi)
2.
Coulombovy
interakce (mezi ionty s určitým výsledným nábojem)
3.
interakce
ion-indukovaný dipól
4.
hydrofóbní
interakce (minimalizace velikosti rozhraní mezi vodou a nepolárními
skupinami)
Je známo, že značná část molekul podílejících se na přenosu signálu je lokalizována v buněčných membránách. Jedná se nejen o receptory, iontové kanály a transportní proteiny, ale i o G proteiny, adenylátcyklasy, fosfolipasy a další enzymy. Na funkci těchto membránových proteinů mají značný vliv vlastnosti lipidové dvojné vrstvy tvořené především fosfolipidy, glykolipidy a steroly. Integrální proteiny jsou v membránách obaleny vrstvou "anulárních" lipidů, na jejichž vazbě k proteinu se podílejí jednak hydrofobní a Van der Vaalsovy síly uvnitř membrány, jednak Coulombovy interakce a interakce ion-indukovaný dipól mezi nabitými a polárními skupinami v povrchové části membrány.
Obecně je vliv lipidů na membránové proteiny dán jednak specifickými interakcemi podmiňujícími aktivitu řady enzymů, jednak nespecifickým ovlivněním dostupnosti vazebných míst (ovlivněním vertikálního pohybu proteinů) nebo vzájemných interakcí jednotlivých podjednotek vícesložkových systémů (změnami rychlosti pohybu těchto složek v rovině membrány). Byla popsána úloha fyzikálního stavu membrány (fluidity) ve funkci řady membránových receptorů, enzymů a iontových kanálů. Např., maximální receptorová odezva závisí nejen na hustotě vazebných míst, ale i na jejich přístupnosti pro agonisty rozpuštěné ve vodné fázi a na rychlosti, s níž může docházet ke vzájemným interakcím mezi jednotlivými membránovými složkami podílejícími se na přenosu signálu. Dostupnost i pohyblivost membránových integrálních proteinů závisí především na fluiditě lipidové dvojné vrstvy. K výrazným změnám v afinitě receptorů tedy vedou rozdíly jak v chemické struktuře receptoru, tak i v lokálním membránovém mikrookolí. Byl popsán také vliv změn fosfolipidového složení plazmatických membrán na aktivitu transportního proteinu pro 5-HT a je známo, že pro dostatečnou funkci membránových enzymů jako je Na+/K+-ATPasa, b-hydroxybutyrátdehydrogenasa, proteinkinasa C a dalších jsou nezbytné jejich interakce s určitými membránovými fosfolipidy.
Membránové fosfolipidy se podílejí na přenosu nervového signálu nejen jako strukturní základ membrány, ale i jako substráty fosfolipas C, D, A2, tj. jako zdroje některých druhých poslů - diacylglycerolu (DG), inositoltrisfosfátu (IP3) a volných mastných kyselin, především kyseliny arachidonové. Předpokládá se např., že poruchy v interakcích lipid-protein způsobené nadměrnou aktivitou fosfolipasy A2 mohou vést ke vzniku afektivních poruch.
VLIV LIPIDOVÉ DVOJNÉ VRSTVY NA FUNKCI MEMBRÁNOVÝCH PROTEINů
(Podle Shinitzky M.:
Membrane fluidity and receptor function. In: Membrane Fluidity (M. Kates, L.A.
Manson, eds.), Plenum Publ. Corp. 1984, pp. 585-601.)
Neurony i jiné buňky vytvářejí a udržují rozdílné koncentrace iontů na obou stranách plazmatické membrány. Jedná se o aktivní procesy, které používají specifické iontové pumpy. Výsledkem této činnosti je vznik membránového potenciálu, tedy napěťového rozdílu mezi vnitřní a vnější stranou membrány. Vnitřek buněk je negativní vůči vnějšku. Klidový membránový potenciál (stálý potenciál) dosahuje v různých buňkách -9 až -100 mV, v neuronech -40 až -90 mV (obvykle -70 mV).
Rychlost toku různých iontů přes membránu je dána jejich: 1. koncentračními gradienty mezi oběma stranami plazmatické membrány, 2. permeabilitou membrány pro jednotlivé ionty, 3. napěťovým rozdílem přes membránu. Pro každý typ iontu lze z rozdílu jeho koncentrací uvnitř a vně buňky určit rovnovážný potenciál (napětí potřebné k vyrovnání toku daného iontu přes membránu, tj. k rovnosti elektrických a difúzních sil pro daný iont) pomocí Nernstovy rovnice. Výsledný membránový potenciál na membráně, kterou může procházet více iontů, lze spočítat pomocí Goldmanovy, resp. Goldmanovy-Hodgkinovy-Katzovy rovnice, pokud známe koncentrace iontů a koeficienty permeability membrány pro jednotlivé ionty.
Při depolarizaci membrány je membránový potenciál méně negativní než klidový potenciál, při hyperpolarizaci je více negativní. K těmto změnám dochází transportem iontů přes membránu. Náboj potřebný pro vytvoření membránového potenciálu je velmi malý a odpovídá přibližně 10-20 molu monovalentního iontu na mm2 membrány. Vzhledem k tomu, že lipidová dvojná vrstva je dobrý elektrický izolátor a je tedy nepropustná pro nabité molekuly, jsou přesuny iontů umožněny především iontovými kanály a aktivním přenosem. Tok nábojů přes membránu se týká především iontů Na+, K+ a Cl-, další ionty jsou přítomny v mnohem nižších koncentracích. Většinu nitrobuněčných aniontů tvoří proteiny a jiné organické molekuly, pro něž je membrána téměř nepropustná. V klidu je permeabilita membrány pro Cl- a Na+ velmi nízká (kanály jsou většinou zavřené), ale permeabilita pro K+ je relativně vysoká (kanály jsou často otevřené). Klidový membránový potenciál je proto velmi blízký rovnovážnému potenciálu pro ionty K+, pouze je v důsledku nenulového toku iontů Na+ poněkud méně negativní. Klidový potenciál je tak veliký, aby vyrovnal toky různých iontů přes membránu (při jejich různých koncentračních gradientech a permeabilitách). Protože se klidový potenciál liší od rovnovážných potenciálů jednotlivých iontů, dochází k jejich průběžnému toku podle koncentračního gradientu, přičemž výsledný proud přes membránu je nulový. Membrána je tedy ve stavu ustáleném, ale nikoli rovnovážném. Koncentrační gradienty se musí udržovat aktivním transportem iontů.
Nernstova
rovnice
Dy
= RT/ZXF . ln ([Xex]/[Xin])
[V]
Dy
- rovnovážný potenciál pro iont X, R - plynová konst. (8,315 J K-1 mol-1),
T - teplota v kelvinech, ZX - náboj iontu X, F - Faradayova konst.
(9,649.104 C mol-1), [Xex] nebo [Xin]
- koncentrace iontu X vně nebo uvnitř buňky (mol).
Pro jednomocný kationt při 37°C je přibližně
Dy
= 0,0267 . ln ([Xex]/[Xin])
[V]
Typické
koncentrace iontů v savčí buňce
|
iont |
konc.
uvnitř Xin |
konc.
vně Xex |
rovnovážný
potenciál Dy,
37°C |
|
|
(mM) |
(mM) |
(mV) |
|
K+ |
120 |
2 |
-109 |
|
Na+ |
10 |
122 |
+67 |
|
Ca2+ |
10-7 |
3 |
+230 |
|
Cl- |
4 |
120 |
-91 |
|
A- |
126 |
10 |
|
(Podle údajů z knihy: Atwood H.L., MacKay W.A.: Essentials of Neurophysiology. B.C. Decker Inc., Toronto, Philadelphia, 1989.)