
Axonální membrána je specializovaná na rychlé šíření nervového signálu na relativně velké vzdálenosti. Podstata tohoto přenosu je elektrická; informace se přenáší podél axonu ve formě akčních potenciálů, což jsou velké reversibilní změny membránového potenciálu.
Dosáhne-li depolarizace membrány spouštěcí úrovně (prahu), tj. dojde-li k dostatečně rychlé depolarizaci o 10 až 20 mV, dochází v axonální membráně k velmi rychlé depolarizaci. Membránový potenciál se změní během cca 0,5 ms na +30 až +50 mV a poté dochází ke stejně rychlé repolarizaci až na asi 70% původní hodnoty membránového potenciálu; tento rychlý vzestup a pokles membránového potenciálu se nazývá hrotový potenciál. Po pomalejší následné depolarizaci (trvající okolo 4 ms nebo méně) dosáhne membránový potenciál původní klidové úrovně a dochází k následné hyperpolarizaci o několik mV pod původní klidovou hladinu a k návratu na hodnotu klidového potenciálu (cca 40 ms).
Existencí spouštěcí úrovně je zajištěno, že malé náhodné depolarizace membrány nezpůsobují vznik akčních potenciálů. Na druhou stranu velikost hrotového potenciálu, tj. amplituda odezvy na dostatečný depolarizační podnět, nezávisí na velikosti tohoto stimulu. Říká se, že akční potenciál se chová podle zákona „vše nebo nic“. Vlastnosti stimulačního podnětu tedy nejsou při jeho axonálním přenosu kódovány v amplitudách akčních potenciálů, ale v jejich frekvenci zažíhání, tj. v počtu jednotlivých akčních potenciálů vygenerovaných v určité časové sérii. Vyplývá to ze závislosti některých vlastností akčního potenciálu na intenzitě depolarizačního podnětu, jako je latence a refrakterní období. Latence je časové zpoždění mezi začátkem podnětu do vzniku píku akčního potenciálu. Její existence vyplývá ze skutečnosti, že pro vyvolání vzruchu je nezbytná určitá minimální intenzita proudu (prahová intenzita) působící po určitou dobu; tato doba může být kratší při silnějším podnětu. Refrakterní období má dvě fáze:
1. absolutní refrakterní období, což je délka období po vzniku akčního potenciálu, během něhož je nemožné vyvolat další akční potenciál (trvá několik milisekund od dosažení spouštěcí úrovně do doby, kdy proběhne repolarizace asi z 1/3); následuje
2. relativní refrakterní období, kdy musí být podnět pro vyvolání dalšího akčního potenciálu větší než normálně (trvá přibližně do uzavření K+ kanálů).
Protože změny koncentrace iontů, které v daném místě vyvolávají změny membránového potenciálu, jsou malé, jsou v axonu generovány akční potenciály tak dlouho, dokud trvá podnět, s frekvencí závislou na velikosti podnětu (frekvenční kódování).
AKČNÍ POTENCIÁL

FREKVENČNÍ KÓDOVÁNÍ
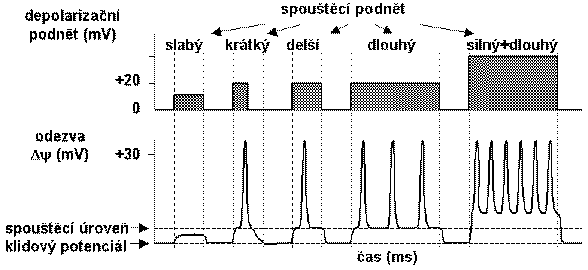
(Upraveno
podle Levitan I.B. a Kaczmarek L.K.: The Neuron. Oxford Univ. Press, New York,
Oxford, 1997; Ganong W.F.: Přehled lékařské fyziologie. Nakl. a vyd.
H&H, 1995.)
Při vzniku změny membránového potenciálu v určitém místě axonu se tato změna pasivně šíří oběma směry, přičemž dochází k přibližně exponenciálnímu poklesu této změny se vzdáleností. Rychlost poklesu velikosti podnětu při tomto pasivním šíření je dána transmembránovým odporem (závislým na hustotě vhodných iontových kanálů a na myelinizaci axonu) a elektrickým odporem vnitřku axonu (závislým především na průměru axonu). Je-li podnět podprahový, potom je v určité vzdálenosti od místa vzniku již neměřitelný. Při nadprahovém podnětu vzniká akční potenciál, což je tak velká změna membránového potenciálu, která je i přes pokles se vzdáleností schopna zažehnout akční potenciál v sousední oblasti axonu, čímž se informace přenáší podél axonu.
Akční potenciály tedy vznikají při nadprahové změně membránového potenciálu s maximální frekvencí 500-1000 impulsů/s. Nevyžadují bezprostřední zdroje buněčné energie a rychlost jejich šíření se zvyšuje s průměrem axonů a u myelinizovaných axonů; při průměru axonu kolem 20 mm může přesáhnout 100 m/s a činí kolem 1m/s u nemyelinizovaného vlákna s průměrem 1 mm. Myelinová pochva vytváří kolem axonu dobrou elektrickou izolaci od mimobuněčného prostředí, tzn. že v myelinizovaných oblastech neprochází přes axonální membránu proud a k výraznému transmembránovému toku iontů může docházet jen v oblasti Ranvierových zářezů. Akční potenciály jsou tedy u myelinizovaných axonů generovány v Ravierových zářezech, kde jsou s vysokou hustotou lokalizovány sodíkové kanály, které mají hlavní úlohu při vzniku akčních potenciálů. Potenciálová změna se pasivně šíří k dalšímu zářezu, kde vzniká další akční potenciál, a tak akční potenciál „skáče“ od zářezu k zářezu (skokové, saltatorní vedení) až dosáhne presynaptického zakončení. Je zřejmé, že vzdálenost Ranvierových zářezů (1 až 2 mm) a vzdálenost, na níž dojde k určitému snížení potenciálové změny (prostorová konstanta axonu), musí být vhodné pro zajištění šíření akčních potenciálů. Myelinová pochva přitom přispívá ke zvýšení prostorové konstanty a umožňuje tedy rychlé šíření vzruchu s minimální spotřebou energie. Rychlost šíření akčních potenciálů u nemyelinizovaných axonů je při stejném průměru axonového vlákna mnohem nižší.
Charakteristiky
přenosu informace axonem
1.
existence prahové hodnoty pro vznik akčního potenciálu
2.
velikost akčního potenciálu nezávisí na velikosti nadprahového podnětu
3.
informace o velikosti podnětu je kódována frekvencí vzniku akčních
potenciálů
4.
pasivní šíření změn membránového potenciálu umožňuje přenos
akčních potenciálů podél axonu
ŠÍŘENÍ AKČNÍHO POTENCIÁLU PODÉL AXONU
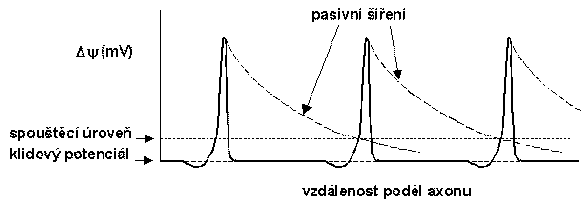
(Podle Levitan I.B. a Kaczmarek L.K.: The Neuron. Oxford Univ. Press, New York, Oxford, 1997.)
Při depolarizaci membrány nad 7 mV se otevírají napěťově řízené Na+ kanály, ale teprve při spouštěcí úrovni se jejich vodivost zvýší natolik, že repolarizace není účinná a dojde k překmitu membránového potenciálu do kladných hodnot směrem k rovnovážnému potenciálu pro Na+. S malým zpožděním a poněkud pomaleji se otevírají napěťově řízené K+ kanály. Vzestup vodivosti pro Na+ je krátkodobý, neboť v píku akčního potenciálu dochází k inaktivaci Na+ kanálů (což je děj jiný, než uzavření kanálů; jedná se o iontový mechanismus vzniku refrakterního období). Tokem iontů K+ z buňky dochází k repolarizaci membrány, Na+ kanály se zavírají a vracejí do klidového stavu. Vzhledem k delší době zvýšené vodivosti K+ kanálů dochází po dosažení klidového potenciálu po určitou dobu k následné hyperpolarizaci, kdy se membránový potenciál blíží rovnovážnému potenciálu K+ iontů. Nakonec se K+ kanály zavírají a vracejí do klidového stavu. Tyto děje trvají u různých buněk jednotky až desítky milisekund.
Děje provázející vznik akčního potenciálu u nemyelinizovaného axonu jsou tedy tyto:
1. otevření napěťově řízeného Na+-kanálu;
2. Na+ teče do buňky (difúze a elektrostatické síly pomáhají vstupu Na+);
3. depolarizace membrány;
4. otevření napěťově řízených K+ kanálů a inaktivace Na+ kanálů;
5. vstup Na+ je překryt výstupem K+;
6. obnovování polarizace membrány, zrušení inaktivace Na+ kanálů a jejich uzavření;
7. relativně pomalejší uzavření K+ kanálů a obnova klidového potenciálu.
U myelinizovaných axonů jsou Na+ kanály koncentrovány v iniciálních segmentech a v Ranvierových zářezech. Procesy spojené s Na+ kanály jsou stejné; protože v Ranvierových zářezech savčích axonů zřejmě nejsou napěťově řízené K+ kanály, uskutečňuje se repolarizace membrány tokem iontů K+ a Cl- přes pasivní (prosakovací) kanály.
Pro elektrickou aktivitu axonu jsou tedy určující různé typy napěťově řízených Na+ a K+ kanálů, uplatňují se však také Ca2+ kanály. Molekulárně klonovací techniky ukázaly, že různorodost iontových kanálů na axonech a zvláště na buněčných tělech a dendritech je ještě větší, než se čekalo z měření jejich činnosti metodou terčíkového zámku. Hranice mezi iontovými kanály řízenými napětím a neuromediátory přitom není ostrá. Různé typy napěťově řízených iontových kanálů lze rozlišit na základě: 1. závislosti na napětí (membránovém potenciálu), 2. kinetických parametrů, 3. vodivosti kanálu, 4. farmakologie, nebo 5. molekulárních struktur.
PERMEABILITA MEMBRÁNY PRO Na+ A K+ BĚHEM AKČNÍHO POTENCIÁLU
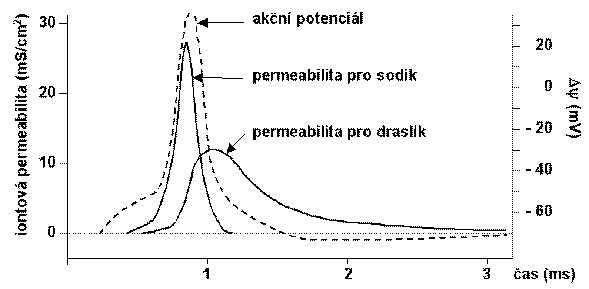
(Podle Voet D., Voetová J.G.: Biochemie. Victoria Publ., Praha, 1995.)
TOKY IONTů BĚHEM AKČNÍHO POTENCIÁLU
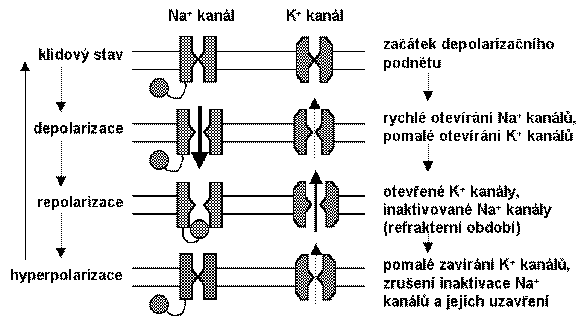
(Podle
Atwood H.L., MacKay W.A.: Essentials of Neurochemistry. B.C. Decker Inc.,
Toronto, Philadelphia, 1989.)
Různé neurony mohou mít různé tvary a amplitudy akčních potenciálů. Některé neurony jsou, z hlediska vzniku akčních potenciálů, za nepřítomnosti podnětů v klidu (tiché, mlčící neurony). Jiné vykazují vlastní aktivitu projevující se vznikem akčních potenciálů v pravidelných časových intervalech („beating“), nebo generují salvy akčních potenciálů („bursting“). Tyto jevy lze vysvětlit na základě aktivace dalších typů iontových kanálů, které umožňují vznik iontových proudů odlišných od proudů uváděných v klasickém popisu šíření akčních potenciálů.
·
Napěťově
řízené Na+ kanály
Z hlediska vlivu na membránový potenciál jsou pro tok iontů dovnitř nejpodstatnější napěťově řízené Na+ kanály (viz předchozí kapitola). Mají dvě hradla (vrátka, „gate“) citlivá na membránový potenciál; jedno kanál otevírá při nadprahové depolarizaci a druhé jej krátce poté uzavírá (inaktivuje). Na depolarizaci se však mohou podílet i kanály pro Ca2+, Cl- nebo neselektivní kationtové kanály umožňující tok jak Na+, tak K+.
·
Napěťově
řízené Ca2+ kanály
Pokud se napěťově řízené Ca2+ kanály podílejí na depolarizaci membrány, mohou způsobovat pomalejší nástup a pokles depolarizačního pulsu. Úloha toku Ca2+ iontů do buňky však může být při vzniku akčního potenciálu druhotná vzhledem k působení Ca2+ jako nitrobuněčného posla, který reguluje nitrobuněčné enzymy, otevírání různých typů iontových kanálů (včetně zpětnovazebné inaktivace svých vlastních kanálů) a uvolňování neuromediátoru v synapsích.
V tomto smyslu lze Ca2+ chápat jako převaděč (transducer) elektrického signálu na chemické signály uvnitř buňky. Existuje řada podtypů Ca2+ kanálů.
·
Napěťově
řízené K+ kanály
Existuje mnoho typů a podtypů K+ kanálů, které zajišťují přenos iontů K+ ven z buňky. Jejich fyziologická funkce spočívá především v repolarizaci membrány po akčním potenciálu a regulaci klidového potenciálu, ale ovlivňují také frekvenci zažíhání a latenci. Kromě K+ kanálů pomalu otevíraných depolarizací a poté uzavíraných (opožděné vyrovnávače) to jsou např. K+ kanály závislé na Ca2+ (k jejich otevření dochází po vstupu iontů Ca2+ dovnitř, nebo po jejich uvolnění z nitrobuněčných zásob; přispívají k repolarizaci membrány a jsou heterogenní), A-proudové kanály (umožňují přechodný draslíkový proud přes membránu, tzv. A-proud; rychle se aktivují a inaktivují zrcadlově k sodíkovému proudu; A-proud snižuje frekvenci zažíhání akčních potenciálů a umožňuje vznik zpoždění mezi příchodem excitačního stimulu a nástupem akčního potenciálu), kanály pro K+ aktivované hyperpolarizací (vyrovnávače dovnitř), kanály modulované muskarinem (M-proudové) nebo serotoninem (S-proudové) a další.
Hlavní
typy iontových kanálů ovlivňujících akční potenciály
|
typ
kanálu |
podnět
k otevření |
poznámka |
|
sodíkový |
depolarizace |
rychle
otevírán a poté inaktivován |
|
draslíkový |
depolarizace |
pomalu
otevírán; opožděný vyrovnávač |
|
hyperpolarizace |
vyrovnávač
dovnitř |
|
|
depolarizace+Ca2+ |
závislý
na cytoplazmatickém Ca2+ |
|
|
depolarizace |
rychlé
otevírán a uzavírán; A-proudový |
|
|
depolarizace |
pomalu
otevírán; M-proudový |
|
|
depolarizace |
uzavírán
přes serotonin; S-proudový |
|
|
kalciový |
depolarizace |
pomalu
otevírán |
|
chlorový |
Ca2+ |
závislý
na cytoplazmatickém Ca2+ |
|
hyperpolarizace |
|
|
|
vodíkový |
depolarizace |
|
(Podle Ganong W.F.: Přehled lékařské fyziologie. Nakl. a vyd. H&H, 1995.)
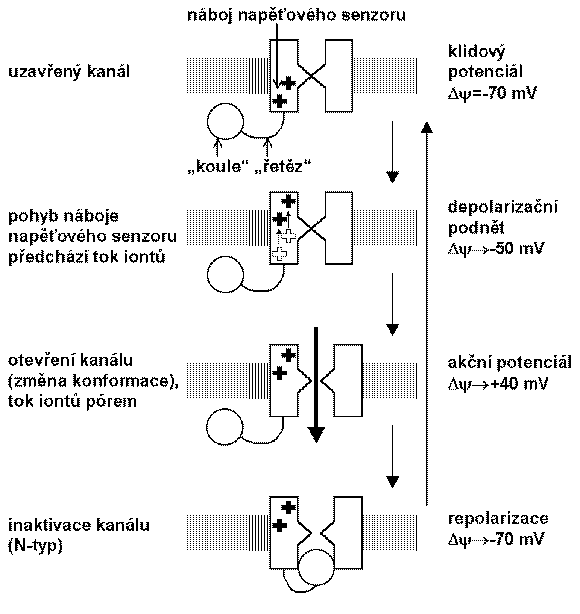
Je zřejmé, že napěťově řízený iontový kanál musí obsahovat nějaký napěťový senzor, nesoucí pravděpodobně náboj. Jedná se zřejmě o část iontového kanálu ve formě a-helixu nesoucí kladné náboje basických aminokyselin argininu nebo lysinu. Při změně membránového potenciálu potom dochází k přesunu tohoto náboje, což vede ke změně konformace proteinu tvořícího iontový kanál a k otevření nebo uzavření jeho póru. Proud vyvolaný pohybem náboje napěťového senzoru je malý a krátce trvající, ale měřitelný.
Molekulární struktury uvedených tří hlavních tříd napěťově řízených iontových kanálů jsou podobné – pravděpodobně mají všechny 24 segmentů překlenujících membránu a doménu, která přispívá ke vzniku póru. Na+ a Ca2+ kanály mají jednu primární podjednotku, která obsahuje 4 homologní domény, každou se 6 segmenty překlenujícími membránu. Napěťový senzor se nachází v S4 segmentech. K+ kanály mají primární podjednotku mnohem menší, podobnou jedné ze čtyř homologních domén u Na+ nebo Ca2+ kanálů; 4 tyto primární podjednotky potom tvoří funkční K+ kanál.
Rychlou inaktivaci některých napěťově řízených iontových kanálů po depolarizaci membrány umožňuje zvláštní složka proteinu tvořícího kanál, označovaná jako inaktivační hradlo. Je to proteinová doména dostupná z cytoplazmatické strany membrány, která je ale odlišná od domény odpovědné za otevření nebo uzavření póru iontového kanálu. Na základě experimentů vznikl pro napěťově řízený Na+ kanál model „koule a řetěz“ („ball-and-chain“), podle něhož část proteinu tvořícího kanál a připojená ke zbytku kanálu aminokyselinovým řetězcem zablokuje otevřený pór z cytoplazmatické strany membrány. Inaktivace tedy neznamená uzavření kanálu, ale určitou formu jeho blokády. Při inaktivaci draslíkových kanálů se uplatňuje kromě N-typu inaktivace ("koule a řetěz") také C-typ, který je pomalejší a zahrnuje rozsáhlejší změny v konformaci kanálu při déle trvajícím depolarizačním podnětu.
Pozn.: Kanály pro Na+ jsou citlivé na řadu neurotoxinů, např. tetrodotoxin nebo saxitonin je blokují, zatímco batrachotoxin (šípový jed) je udržuje v otevřeném stavu.
otevření a inaktivace napěťově řízeného intového kanálu
Použitá a
doporučená literatura
Atwood H.L., MacKay W.A.: Essentials of Neurochemistry. B.C.Decker Inc., Toronto-Philadelphia, 1989.
Caron M.G.: TiPS Receptor and Ion Channel Nomenclature Supplement 1996.
Ganong W.F.: Přehled lékařské fyziologie. Nakl. a vyd. H&H, 1995.
Kotyk A., Janáček K.: Membrane Transport. Academia, Praha, 1977.
Levitan I.B., Kaczmarek L.K.: The Neuron. Oxford Univ. Press, New York, Oxford, 1997.
Němeček S., Lodin Z., Wolf J., Vyskočil F.: Neurobiologie, Avicenum, zdrav. nakl., Praha, 1972.
Voyet D., Voyetová J.G.: Biochemie. Victoria Publishing a.s., Praha, 1995.
Shinitzky M.: Membrane fluidity and receptor function. In: Membrane Fluidity (M. Kates, L.A. Manson, eds.), Plenum Publ. Corp., pp. 585-601, 1984.
Singer S.J., Nicolson G.L.: Science 175, 720-731, 1972.