Monoaminové neuromediátory jsou vytvářeny v buněčném těle, v axonu a v nervových zakončeních. Jsou inkorporovány do váčků syntetizovaných v buněčném těle. Synaptické váčky jsou často elektron-denzní (granulární, „dense-core vesicles“), velikost je různá - kolem 50 nm pro noradrenalin (NA), 80-100 nm pro dopamin (DA) a serotonin. Po uvolnění (exocytóze) jsou monoaminové neuromediátory inaktivovány především vysokoafinitními transportními systémy závislými na Na+ a Cl- v neuronech a přilehlých gliích, dále se uplatňuje difúze a nízko-afinitní systémy. Inaktivace monoaminových neuromediátorů je pomalejší, než je tomu u ACh. Metabolity monoaminů se mohou dostat do mozkomíšního moku (CSF) nebo krve přes gliové buňky.
Hlavními katecholaminy v CNS jsou adrenalin (epinefrin), noradrenalin (norepinefrin) a dopamin. Většina adrenergních synapsí využívá jako neuromediátor noradrenalin, v malém množství byl v CNS zjištěn také adrenalin (hlavně v mozkovém kmeni).
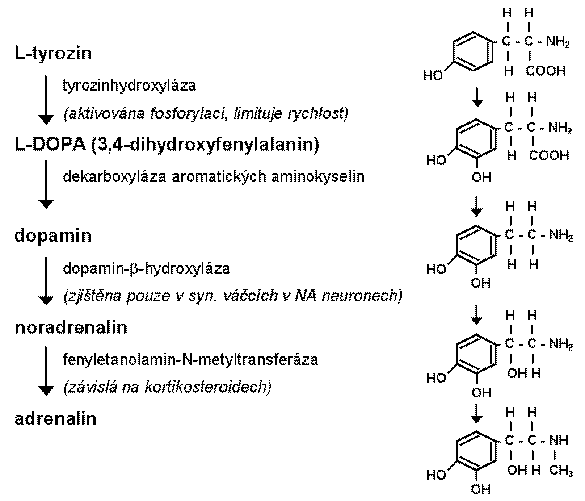
Biosyntéza katecholaminů začíná hydroxylací tyrozinu. Enzymem limitujícím rychlost syntézy katecholaminů je právě tyrozinhydroxyláza. Ukládání katecholaminů do synaptických váčků je aktivní proces, který vyžaduje energii a může být nevratně inhibován např. reserpinem. Kromě neuromediátoru obsahují tyto váčky i vysoké koncentrace ATP a protein chromogranin. Přeměna tyrozinu na L-DOPA a L-DOPA na DA probíhá v cytosolu, DA je potom přenesen do zásobních váčků. Váčky v noradrenergních neuronech obsahují enzym dopamin b-hydroxylázu, který umožňuje vznik NA. V adrenálních žlázách a v malých skupinách neuronů v mozkovém kmeni se v cytoplazmě nachází enzym fenyletanolamin N-metyltransferáza, který přenáší metylovou skupinu z S-adenosylmethioninu na NA za vzniku adrenalinu.
Katecholaminy jsou ze synaptické štěrbiny odstraňovány difúzí a zpětným vychytáváním pomocí specifických přenašečů. Za inaktivaci těchto neuromediátorů jsou primárně odpovědné monoaminoxidáza (MAO) a katechol-O-metyltransferáza (COMT). MAO deaminuje katecholaminy na jejich aldehydy; je lokalizována na vnější membráně mitochondrií a působí především na volné neuromediátory v presynaptických zakončeních. Látky jako reserpin (blokuje přenos neuromediátorů do váčků) nebo amfetaminy (uvolňují katecholaminy z váčků) proto způsobují zvýšení koncentrací deaminovaných metabolitů. COMT inaktivuje katecholaminy přenosem metylové skupiny z S-adenosylmethioninu; nachází se v prakticky ve všech buňkách včetně vnějšího povrchu membrán neuronů; funkce COMT v tranmisi dosud není dobře známa.
Biosyntéza katecholaminů

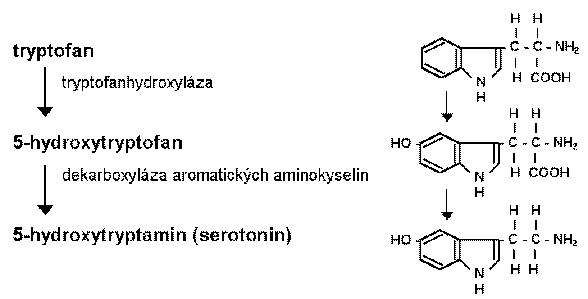
Biosyntéza serotoninu
Mezi indolaminové neuromediátory řadíme tryptamin a především serotonin. 5-HT je za fyziologických podmínek amfifilní molekula, která neprochází snadno hematoencefalickou bariérou; je tedy syntetizován v mozku. Má podobnou chemickou strukturu jako tryptamin, melatonin, dietyltryptamin, dimetyltryptamin a bufotenin (indolalkylaminy).
Biosyntéza serotoninu začíná hydroxylací L-tryptofanu. Enzymem limitujícím rychlost syntézy 5-HT je tryptofanhydroxyláza. Primárním zdrojem tryptofanu jsou potravní proteiny. Do mozku se dostává pomocí přenašeče neutrálních aminokyselin, kdy soutěží s dalšími aminokyselinami, jako je fenylalanin, leucin a methionin. Dietou se sníženým obsahem tryptofanu a zvýšeným vstupem kompetujících aminokyselin lze snížit obsah 5-HT v mozku. Enzym tryptofanhydroxyláza (L-tryptofan-5-monooxygenáza) je v mozku syntetizován pouze v serotoninergních neuronech. Tkáňově specifické rozdíly ve vlastnostech tohoto enzymu získaného z mozku a šišinky jsou zřejmě dány až posttranslačními úpravami. Tryptofanhydroxyláza mění tryptofan na 5-hydroxytryptofan (5-HTP) a z něj vzniká serotonin působením dekarboxylázy aromatických L-aminokyselin. Tento enzym není specifický pro serotoninergní neurony, v katecholaminergních neuronech konvertuje DOPA na dopamin. Protože tato dekarboxyláza není za normálních podmínek saturovaná 5-HTP, lze koncentraci 5-HT v mozku zvýšit také dodáním 5-HTP. Zvýšená syntéza a uvolňování neuromediátorů při zvýšené neuronální aktivitě je v případě 5-HT zajištěna zvýšenou aktivitou fosforylované tryptofanhydroxylázy.
Serotonin je do synaptických váčků ukládán aktivním transportem. Byly klonovány dva přenašeče monoaminových neuromediátorů do synaptických váčků. Váčky obsahující 5-HT se poněkud liší od váčků s katecholaminy - neobsahují ATP a obsahují specifický protein, který váže s vysokou afinitou 5-HT. Uvolňování 5-HT do štěrbiny nastává exocytózou váčků a jeho aktivita je ukončena zpětným vychytáváním (reuptake) specifickým serotoninovým transportním proteinem (SERT) lokalizovaným v plazmatické membráně. Primární katabolickou cestou pro 5-HT je deaminace pomocí MAO.
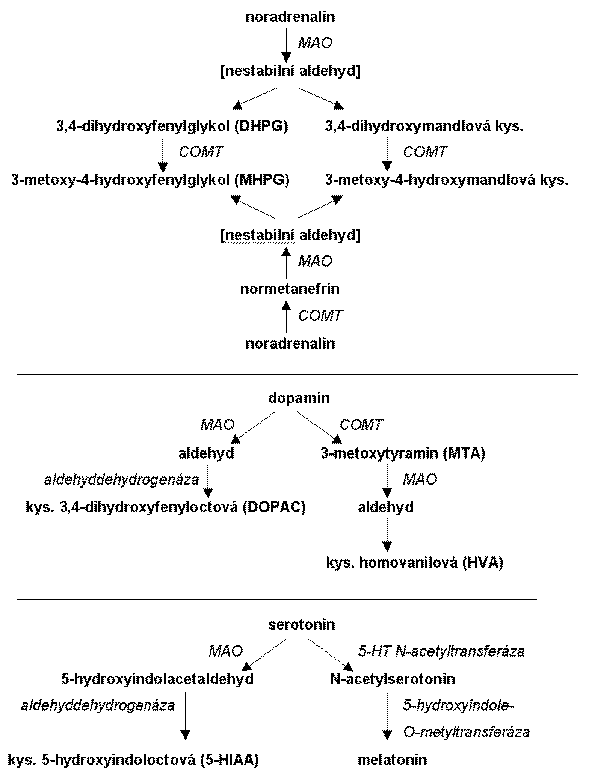
Metabolity monoaminových neuromediátorů z mozku jsou obvykle měřeny v mozkomíšním moku (CSF), neboť jejich podíl v moči je relativně malý. V mozku je hlavním metabolitem serotoninu kyselina 5-hydroxyindoloctová (5-HIAA), v šišince je 5-HT konvertován na melatonin. Hlavní metabolit DA u člověka je kyselina homovanilová (HVA), ale měří se také kyselina 3,4-dihydroxyfenyloctová (DOPAC). Relativně selektivním metabolitem NA v mozku je 3-metoxy-4-hydroxyfenylglykol (MHPG).
Degradace noradrenalinu, dopaminu a serotoninu
Dalšími monoaminovými neuromadiátory odvozenými od aminokyselin jsou taurin a především histamin. Taurin je odvozen z cysteinu, histamin vzniká dekarboxylací histidinu.
Histamin byl jako fyziologický mediátor znám mnohem dříve a lépe mimo CNS – známá je jeho úloha na sekreci kyseliny v žaludku, v regulaci imunitní odpovědi a při zánětech. Teprve později byly poznány také jeho regulační funkce v mozku, kde je vytvářen, ukládán a uvolňován nejen neurony, ale i jinými buňkami. Morfologické a elektrofyziologické vlastnosti histaminergních neuronů jsou podobné jako noradrenergních a serotoninergních a jejich axony projikují do většiny oblastí CNS.
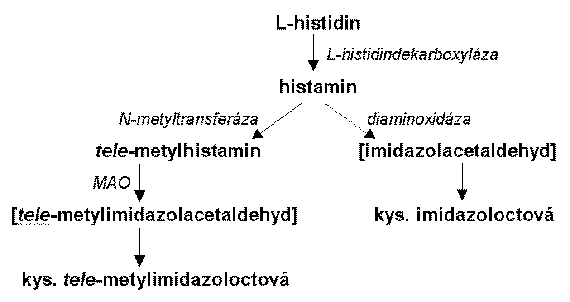
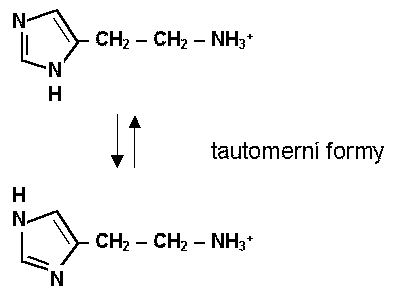
Z chemického hlediska se histamin liší od ostatních neuromediátorů převším imidazolovým kruhem, který mu umožňuje existovat ve dvou tautomerních formách. Za fyziologických podmínek existuje jako monokationt. Jeho biosyntéza vyžaduje L-histidin a enzym L-histidindekarboxylázu. Histamin neprostupuje hematoencefalickou bariéru a je tedy syntetizován v mozku. L-histidin se do mozku dostává aktivním transportem, transportní systém do neuronů není znám. Rychlost syntézy histaminu v mozku je kontrolována dostupností L-histidinu a aktivitou histidindekarboxylázy. Oproti NA a 5-HT není histamin přímým inhibitorem své syntézy, nicméně existuje záporná zpětná vazba přes aktivaci presynaptických H3 autoreceptorů. Vzniklý histamin je uchováván v synaptických váčcích, z nichž je po depolarizaci membrány a vstupu kalcia uvolňován do synaptické štěrbiny a aktivuje postsynaptické i presynaptické receptory. Není znám vysokoafinitní uptake systém pro histamin, který by jej rychle vychytával ze štěrbiny. Předpokládá se transport histaminu do astrocytů, kde potom dochází k jeho metabolismu.
Katabolismus histaminu v mozku probíhá téměř výhradně přes jeho metylaci histamin N-metyltransferázou, následuje deaminace vzniklého tele-metylhistaminu pomocí MAO-B a oxidace nestabilního aldehydu na kyselinu tele-metylimidazoloctovou. Mimo nervový systém probíhá katabolismus histaminu také přes jeho oxidaci diaminoxidázou, kdy vzniká nestabilní aldehyd a poté kyselina imidazoloctová.
Chemická struktura histaminu
Syntéza a katabolismus histaminu