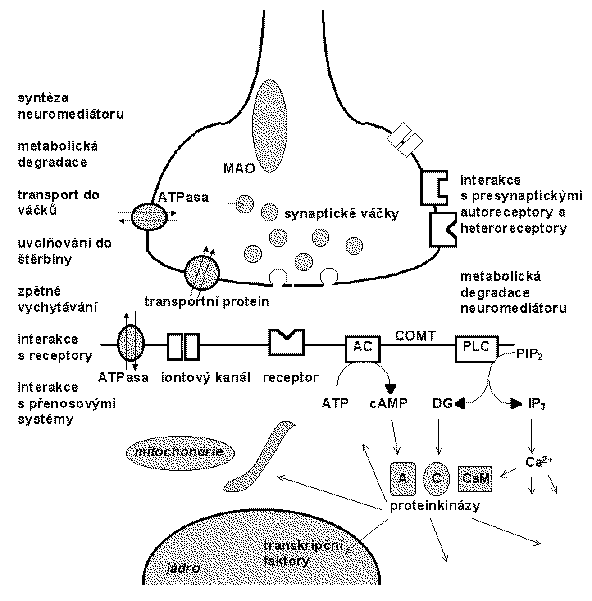
Většina antidepresiv jsou amfifilní molekuly nesoucí za fyziologických podmínek kladný náboj. Mohou se tedy vázat jak ke specifickým proteinovým vazebným místům, tak se mohou nespecificky akumulovat v lipidové dvojvrstvě. Interakce lipid-antidepresivum může ovlivňovat interakce lipid-protein a tak měnit dostupnost receptorových vazebných míst nebo dostupnost fosfolipidů jakožto substrátů fosfolipas. Amfifilní molekuly léčiv nesoucí kladný náboj mohou způsobit fosfolipidosu, tj. akumulaci nadbytečných fosfolipidů uvnitř buňky, s čímž mohou souviset některé vedlejší nebo toxické účinky.
Po vazbě do lipidové dvojvrstvy antidepresiva snadno ztrácejí kladný náboj a jako nepolární se potom akumulují v hydrofobním vnitřku membrány, kde mohou snadno difundovat v rovině membrány a interagovat s případnými hydrofobními vazebnými místy na integrálních proteinech. Snadno procházejí na vnitřní stranu membrány, kde opět získají kladný náboj a mohou interagovat s proteiny a se záporně nabitými fosfolipidy (např. s fosfatidylserinem nebo fosfatidylinositolem) na vnitřní straně membrány. Poté se uvolňují do nitrobuněčného prostředí a mohou ovlivňovat procesy v cytosolu, organelách nebo buněčném jádře. Lze uzavřít, že působení antidepresiv není omezeno jen na části receptorů, transportních proteinů a enzymů nacházejících se na povrchu buněčných membrán, ale že mohou být ovlivněny i procesy probíhající v hydrofobním vnitřku membrán a rovněž nic nebrání případným interakcím antidepresiv se složkami efektorových systémů a systémů druhých a třetích poslů, včetně procesů v jádře.
Možné účinky antidepresív

Antidepresiva jsou chemicky různorodou skupinou psychofarmak. S jejich terapeutickým působením jsou obvykle spojovány přímé či nepřímé farmakologické účinky na noradrenergní, serotoninergní nebo dopaminergní systémy. Blokáda acetylcholinových muskarinových, histaminových H1 nebo adrenergních a1/2 receptorů, ale i řada účinků uvedených v tabulce, může způsobovat nežádoucí vedlejší účinky farmakoterapie.
Terapeutické účinky antidepresiv se projevují až po dvou nebo více týdnech jejich podávání. Tzn., že 1. časné účinky antidepresiv mají malý nebo žádný vliv na klinické zlepšení; 2. pozdější farmakologické účinky antidepresiv odpovídají za jejich klinickou účinnost. Uvedené závěry vedly ke studiu adaptivních účinků způsobených antidepresivy v centrálních monoaminových systémech. Tyto studie pomohly v pochopení regulačních procesů v těchto neuronálních systémech, tj. procesů, které mají fyziologický a snad i patofyziologický význam. Nejčastěji pozorované změny vyvolané dlouhodobým podáváním antidepresiv jsou regulace snížením počtu (down-regulace) b1-adrenergních receptorů a/nebo snížení odezvy na agonisty (desenzitizace) 5-HT1A receptorů. Byly však pozorovány změny i v jiných receptorových systémech.
Podle působení na různé neuromediátorové systémy a podle selektivity tohoto působení lze antidepresiva rozdělit do 5 generací (viz tabulka). Klasické rozdělení antidepresiv je v další tabulce.
Rozdělení
antidepresiv podle primárního biochemického účinku
|
inhibitory
katabolismu neuromediátorů (IMAO) |
|
blokátory
reuptake neuromediátorů (SRI/NRI,
SSRI, SNRI) |
|
agonisté
receptorových systémů (5-HT1A) |
|
antagonisté
receptorových systémů (a2-AR,
5-HT2) |
|
inhibitory
či stimulátory jiných složek transdukce signálu (G proteinů, AC, PL, PK, fosfatas, ATPas, proteinů
závislých na membránových fosfolipidech, enzymů v systémech 2. a 3.
poslů) |
Rozdělení
antidepresiv
(podle
účinků na neuromediátorové systémy)
|
generace |
farmakologický
účinek |
|
I |
zasahují 3 hlavní neuromediátorové systémy:
5-HT, NA, DA; antagonisté a1,2,
H1, M |
|
II |
zasahují 2 hlavní neuromediátorové systémy;
ovlivňují méně a, H1 |
|
III |
zasahují 1 hlavní neuromediátorový systém;
neovlivňují M, a, H1 |
|
IV |
zasahují pouze 5-HT+NA nebo 5-HT+DA systémy |
|
V |
zasahují pouze 5-HT+NA+DA systémy |
(podle Švestka J.: Čs. Psychiat. 90, 1, 3-19, 1994)
Rozdělení
antidepresiv
(klasické
rozdělení)
|
skupina |
podskupina |
příklady
antidepresiv |
|
tricyklická
(tymoleptika) |
aktivující |
desipramin, nortriptylin,
protriptylin, dibenzepin, dosulepin, lofepramin |
|
sedativní, anxiolytická |
imipramin, amitriptylin,
trimipramin, klomipramin |
|
|
II.
a III. generace |
II. generace - aktivující |
viloxazin, bupropion,
buspiron, amineptin, maprotilin |
|
II. generace - sedativní,
anxiolytická |
mianserin, trazodon,
nefazodon, pirlindol |
|
|
III. generace - SSRI |
citalopram, fluvoxamin,
fluoxetin, sertralin, paroxetin |
|
|
zvyšující uptake 5-HT |
tianeptin |
|
|
inhibitory
MAO |
neselektivní ireverzibilní |
|
|
selektivní MAOI-B
ireverzibilní |
selegilin |
|
|
selektivní MAOI-B
reverzibilní |
|
|
|
selektivní MAOI-A
ireverzibilní |
|
|
|
selektivní MAOI-A
reverzibilní |
moklobemid, brofaromin,
toloxaton, amiflamin |
|
|
tymoprofylaktika |
|
lithium, karbamazepin,
valproát sodný, valpromid, klonazepam |
(podle Švestka J. a kol.: Psychofarmaka v klinické praxi. GRADA Publishing, 1995)
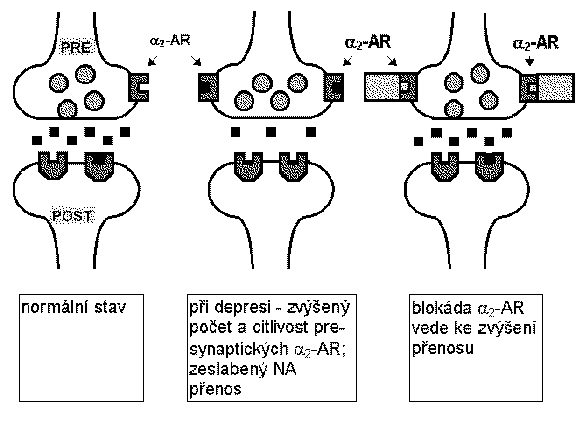
Vychází se z předpokladu, že deprese je způsobena nedostatečným uvolňováním neuromediátoru v oblastech mozku regulujících náladu (jako je limbický systém). K tomuto jevu může dojít např. při zvýšení počtu a senzitivity presynaptických a2-adrenoceptorů. Blokováním těchto receptorů lze potom dosáhnout zvýšení noradrenergního přenosu.
Např.: mianserin hydrochlorid (Lerivon) - tetracyklické antidepresivum, blokátor (antagonista) a2-adrenoceptorů.
Účinky blokátorů a2-adrenoceptorů
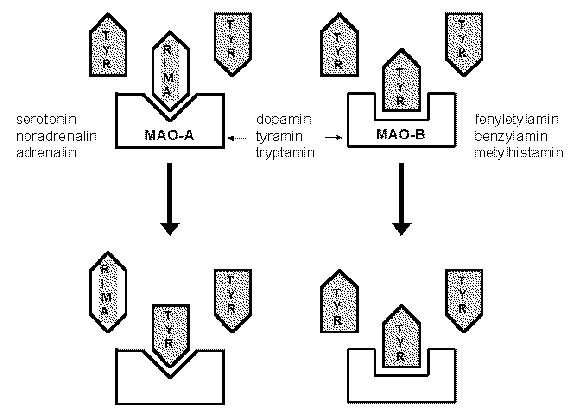
Vychází se z předpokladu, že v patogenezi deprese je obsažen nedostatek určitých neuromediátorů (např. serotoninu a noradrenalinu). Inhibitory enzymu monoaminoxidasy (MAO) zabraňují degradaci neuromediátorů, což vede ke zvýšení přenosu. MAO je v CNS lokalizována uvnitř neuronů na vnějším povrchu mitochondriální membrány. Inhibicí MAO je blokován katabolismus biogenních aminů a zvyšuje se jejich dostupnost v presynaptických zakončeních. Po dlouhodobém podávání inhibitorů MAO dochází k regulaci snížením počtu (down-regulaci) b-adrenoceptorů a ke snížení aktivity adenylátcyklasy, což jsou projevy dlouhodobého působení většiny antidepresiv.
Pozn.: Po uvolnění neuromediátoru do synaptické štěrbiny jsou katecholaminy inaktivovány enzymem katechol-O-metyltransferasou (COMT), který však není ovlivňován inhibitory MAO.
Vzhledem k vedlejším účinkům neselektivních ireversibilních inhibitorů MAO, tj. možnosti vzniku hypertenzní krize (způsobené blokováním schopnosti MAO inaktivovat tyramin) a hepatotoxicitě, bylo jejich použití minimální až do vývoje selektivních reversibilních inhibitorů izoenzymu MAO-A (RIMA, např. moklobemid, toloxaton, brofaromin, amiflavin) nebo MAO-B (např. selegilin).
MAO-A: deaminuje serotonin, noradrenalin a adrenalin
MAO-B: deaminuje fenyletylamin, benzylamin a metylhistamin
MAO-A i MAO-B: deaminují dopamin, tyramin a tryptamin
RIMA jsou:
reversibilní ® substrát (tyramin) může být při nadbytku metabolizován i izoenzymem MAO-A.
Účinky reverzibilních inhibitorů MAO-A (RIMA)
A) Účinnost neurotransmise zprostředkovaná 5-HT je ovlivňována postsynaptickými i presynaptickými faktory, např.:
B) Akutní podání selektivních inhibitorů zpětného vychytávání serotoninu (SSRI) vede k akumulaci mimobuněčného 5-HT v mozku, čímž se aktivují jednak somatodendritické 5-HT1A autoreceptory, jednak presynaptické 5-HT1B/1D. Důsledkem je snížení přenosu signálu.
C) Chronické podávání SSRI vede ke dlouhodobému zvýšení koncentrace volného 5-HT, což způsobuje desenzitizaci 5-HT1A nebo 5-HT1B/1D autoreceptorů a to vede ke zvýšení neurotransmise zprostředkované 5-HT.
Ovlivnění přenosu signálu zprostředkovaného serotoninem
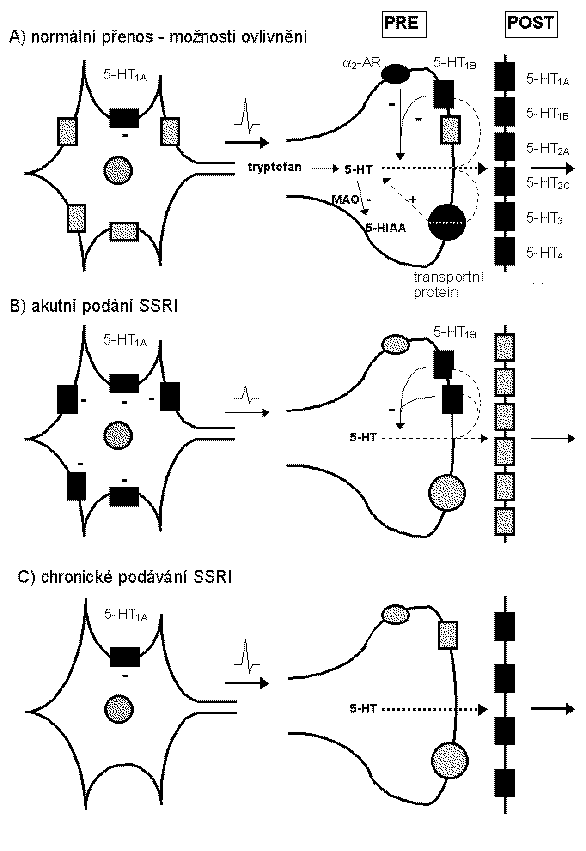
Podobného účinku jako s SSRI lze dosáhnout podáváním agonistů 5-HT1A receptorů, kdy akutní podání vede ke snížení neurotransmise v důsledku aktivace somatodendritických 5-HT1A autoreceptorů a chronické podávání vede ke zvýšení neurotransmise v důsledku desenzitizace 5-HT1A autoreceptorů.
Přímá souvislost mezi receptorovými změnami a terapeutickými účinky antidepresiv nebyla prokázána. Existují problémy s vysvětlením profylaktických účinků lithia a karbamazepinu a s vysvětlením účinků některých novějších antidepresiv. Tyto skutečnosti vedly k zájmu o studium vlivu antidepresiv, resp. vlivu depresivní poruchy na další procesy podílející se na přenosu nervového signálu. Sledovány jsou přitom jak další možné primární účinky antidepresiv (především v případě léčiv s nepříliš selektivním působením, jako jsou tricyklická antidepresiva), tak dlouhodobé adaptivní procesy projevující se např. změnami výskytu a funkce G-proteinů, fosfolipas, ATPas, adenylátcyklasy, guanylátcyklasy, proteinkinas a enzymů podílejících se na syntéze a metabolismu neuromediátorů a na jejich uvolňování z presynaptických zakončení.
Chronické podávání antidepresiv vede obvykle ke změnám počtu vazebných míst a citlivosti u různých receptorových systémů. Předpokládá se např., že snížení odezvy adenylátcyklasového systému spojeného s b-adrenoceptory je důsledkem snížení počtu b1-adrenoceptorů. Existují však měření potvrzující, že tyto změny počtu receptorů nevysvětlují zcela snížení odezvy. Dále existují antidepresiva, jejichž účinek na adenylátcyklasový systém není spojen se změnami počtu b-adrenoceptorů. Snížení citlivosti b-adrenoceptorů může být tedy regulováno více způsoby (Tabulka). Byla pozorována i zvýšená aktivita adenylátcyklasy po podávání antidepresiv.
Dlouhodobé podávání lithia má kromě nejčastějších účinků uvedených v Tabulce i řadu dalších účinků, např. ovlivnění proteinkinasy C, fosfolipasy C, specifické změny ve fosforylaci mozkových proteinů, stimulace 5-HT1A, inhibice guanylátcyklasy atd. Hypotéza: působením na G proteiny může lithium ovlivnit více různých přenosových mechanismů a tak upravovat funkční rovnováhu mezi různými neuromediátorovými systémy.
Postreceptorové účinky antidepresiv
|
odpojení b-AR
od Gs |
|
zvýšení GTPasové aktivity Gao |
|
snížení hladin Gas i Gai |
|
inhibice katabolismu cAMP |
|
změna aktivity proteinkinas závislých
na cAMP |
Postreceptorové účinky lithia
|
inhibice inositolmonofosfatas |
|
zeslabení aktivity některých
adenylátcyklas |
|
zvýšení koncentrací adenylátcyklas
typu I a II a jejich mRNA |
|
zvýšení podílu b-AR
ve vysokoafinitním stavu |
|
zeslabení efektorové odezvy přes
Gs , Gi a Gp |
|
snížení hladin mRNA pro Gas, Gai1 a Gai2 |
|
snížená aktivita některých
izoenzymů PKC |
|
změny ve fosforylaci endogenních
proteinů |
|
zvýšená aktivita Na+K+-ATPasy |
AR - adrenergní
receptory, Ga
- a
podjednotka G proteinu, cAMP - cyklický adenosinmonofosfát, mRNA - messenger
RNA, PKC - proteinkinasa typu C
Vliv na složení a vlastnosti lipidové části buněčných membrán byl sledován hlavně pro léčiva ze skupiny fenothiazinů, butyrofenony a tricyklická antidepresiva. Protože fenothiaziny i TCA si jsou strukturně podobné, ale stereochemicky jsou značně odlišné a mají i odlišné terapeutické účinky, byla srovnávána jejich lokalizace v buněčných membránách a vliv na fázové přechody lipidové dvojvrstvy. Ukázalo se, že fenothiaziny mají vyšší rozdělovací koeficienty než TCA, tj. mají vyšší hydrofobicitu a tedy silnější tendenci být inkorporovány dovnitř membrán. Pravděpodobná lokalizace molekul fenothiazinů v membráně je v hydrofóbním vnitřku membrány s orientací nepolární části podél uhlovodíkových řetězců. TCA jsou vázána více periferně, v povrchových vrstvách lipidové dvojvrstvy s nepolární částí orientovanou v rovině membrány.
Při nižších koncentracích (3 mM) fenothiazinů i haloperidolu dochází k určité stabilizaci membrán ve smyslu snížení jejich fluidity a zvýšení parametrů pořádku. TCA vykazují menší vliv, resp. projevují se výrazněji až při koncentracích řádově vyšších. Teplotu fázového přechodu ovlivňují hlavně látky, které se vážou na povrch dvojvrstvy a které interagují elektrostaticky s polárními skupinami fosfolipidů. Vysoké koncentrace fenothiazinů (50 - 100 mM) vedou k destabilizaci membrán a rozpadu buněk.
Dlouhodobé podávání některých antidepresiv (např. desipraminu) vede ke změnám ve složení membránových fosfolipidů.
Koncentrace nutné pro neuroleptické, antidepresivní a sedativní účinky se pravděpodobně liší.