V této kapitole jsou shrnuty hypotézy vycházející z předpokladu, že vznik afektivních poruch souvisí s primárním narušením funkcí buněčných a molekulárních systémů přímo v oblasti synapsí, tj. s poškozením v systémech odpovědných za přenos a zpracování nervového signálu. Hlavní pozornost je věnována neurochemickým hypotézám, které předpokládají poruchu v dostupnosti neuromediátorů, v afinitě a počtu odpovídajících receptorů nebo v postreceptorových procesech vyvolaných vazbou agonisty ke specifickému vazebnému místu. Významné však jsou také další biochemické hypotézy zaměřené na změny složení a vlastností synaptických plasmatických membrán, na poruchy v transportu iontů nebo na výskyt určitých endogenních látek při depresi.
Z hlediska časového vývoje lze rozdělit neurochemické hypotézy na neuromediátorové, receptorové a postreceptorové. Je ovšem zřejmé, že dochází k jejich prolínání. Ani první neuromediátorové hypotézy totiž nelze považovat za vyvrácené. Často jsou starší hypotézy pouze zahrnuty do šířeji pojatých hypotéz novějších. Tento postup vychází ze skutečnosti, že jsou poznávány další a další procesy související s normálním přenosem nervového signálu, které mohou být narušeny při duševních poruchách.
Neuromediátorové hypotézy formulované do poloviny 70. let vycházely z předpokladu, že primární příčinou vzniku afektivních poruch je zvýšená nebo snížená dostupnost určitých neuromediátorů v synapsích. Značného rozvoje poté dosáhly receptorové hypotézy, které již braly do úvahy také počet, afinitu a senzitivitu pre- a postsynaptických receptorů. Od konce 80. let se rozvíjejí postreceptorové hypotézy zaměřené na děje vyvolané aktivací receptoru ve složkách plasmatické membrány, cytoplasmy a buněčného jádra.
Každá tato
skupina hypotéz může být dále členěna podle uvažovaného typu neuromediátoru,
receptoru nebo transdukčního systému. V dalších kapitolách jsou
uvedeny stručné formulace těchto hypotéz, obvykle bez podrobnějšího
uvedení důvodů, které k nim vedly (viz doporučená literatura).
Neuromediátorové hypotézy předpokládaly, že příčina vzniku afektivních poruch spočívá ve změněné dostupnosti určitých neuromediátorů v synapsích. Jejich rozvoj byl podnícen objevem antidepresivních účinků některých látek, především TCA a IMAO, a poznáním jejich účinků na neuromediátorové systémy. Neuromediátorové hypotézy vycházely ze skutečnosti, že výrazným primárním biochemickým účinkem TCA je blokáda reuptake monoaminových neuromediátorů, která vede k jejich zvýšeným koncentracím v synaptických štěrbinách. Podobně IMAO inhibují katabolismus (deaminaci) monoaminových neuromediátorů v presynaptických zakončeních a zvyšují tak jejich dostupnost.
První neuromediátorové hypotézy předpokládaly, že při depresi dochází k relativnímu snížení hladin NA nebo 5-HT v mozku. Další hypotézy tento předpoklad upřesňovaly.
Katecholaminová hypotéza afektivních poruch: deprese je spojena s absolutním nebo relativním nedostatkem katecholaminů, hlavně noradrenalinu, ve funkčně významných adrenergních receptorových místech v mozku, zatímco mánie je spojena s funkčním nadbytkem těchto neuromediátorů.
Indolaminová hypotéza: deprese je alespoň částečně vyvolána poklesem hladin indolaminů, hlavně 5-HT, v mozku.
Cholinergní-adrenergní rovnovážná hypotéza: deprese je způsobena převahou cholinergního systému nad adrenergním a mánie naopak.
„Permisivní“ hypotéza: nedostatečná centrální indolaminergní transmise „připouští“ afektivní poruchu, ale není postačující pro její vznik. Blízkou příčinou pro vznik afektivního stavu je za této situace změna v centrální katecholaminové transmisi, která je při mánii zvýšená a při depresi snížená. Korekce nízkých hladin 5-HT by tedy měla zmírňovat afektivní onemocnění.
Dopaminová hypotéza: při depresi je nedostatek dopaminu.
Hypotéza biogenních aminů: deprese vzniká buď při poruše funkce noradrenergního, ale ne dopaminergního a serotoninergního systému, nebo při poruše serotoninergního, ale nikoli noradrenergního systému.
Monoaminová hypotéza: nedostatek monoaminových neuromediátorů při depresi je primárním faktorem vedoucím ke snížení serotoniergní a noradrenergní aktivity u některých typů deprese.
Hypotéza biogenních aminů: při depresi dochází ke zvýšené stimulaci katecholaminových receptorů díky nízkým hladinám katechol-O-metyltransferasy (katalyzuje metylaci katecholaminů ve štěrbině) a to může být částečně kompenzováno sníženou frekvencí vzniku akčních potenciálů a sníženou aktivitou tyrosinhydroxylasy. Primární je tedy hypersenzitivita postsynaptických monoaminových receptorů, tj. monoaminergní hyperfunkce.
Pozn.: Dřívější hypotézy pokládaly za primární nedostatek monoaminových neuromediátorů vedoucí k monoaminergní hypofunkci.
Klasická noradrenalinová receptorové hypotéza: depresivní porucha může být spojena se zvýšenou senzitivitou centrálních noradrenergních receptorů. Terapeutické účinky antidepresiv jsou potom vztaženy k adaptivním změnám v senzitivitě adenylátcyklasového systému spojeného s postsynaptickými noradrenergními receptory. Tato hypotéza byla upřesněna tím, že desenzitizace adenylátcyklasy po chronickém podávání antidepresiv je způsobena snížením počtu b1-adrenoceptorů.
Obecná katecholaminová hypotéza: supersenzitivita určitých katecholaminových receptorů při nízkých hladinách 5-HT je biochemickým základem deprese. Tato hypotéza je elegantní, ale nelze ji považovat za prokázanou, neboť klinické studie dostatečně nepotvrdily přítomnost takových supersenzitivních receptorů u nemocných.
Hypotéza o úloze presynaptických a2-adrenoceptorů: při depresi je zvýšená hustota těchto receptorů ve vysokoafinitních stavech.
Hypotéza o úloze postsynaptických a2-adrenoceptorů: při depresi je snížená senzitivita těchto receptorů.
Sjednocující adrenoreceptorová hypotéza afektivních poruch: onemocnění nebo jeho léčba psychofarmaky jsou určeny primární abnormalitou v některém neuromediátorovém systému (serotoninergním, noradrenergním, GABAergním, peptidergním, cholinergním apod.) ovlivňujícím aktivitu locus caeruleus (LC), funkci noradrenergních nervových zakončení nebo dostupnost NA v synapsích. Tato hypotéza pokládá za společné a konečné stimulační nebo inhibiční účinky na buňky v LC. Afektivní poruchy potom mohou mít základ v kterémkoli neuromediátorovém systému zasahujícím do LC. Podobnost mánie a deprese potom lze vysvětlit tím, že obě poruchy se projevují prostřednictvím noradrenergní aktivity LC.
Hypotéza o dostupnosti tryptofanu: dostupnost tryptofanu (prekursoru serotoninu) určuje rychlost syntézy 5-HT v mozku a může být důležitým faktorem v patofyziologii deprese a v účincích antidepresiv.
Obecná serotoninová receptorová hypotéza: deprese je vztažena k těmto abnormalitám serotoninových receptorů:
upregulace 5-HT2;
desenzitizace 5-HT1A;
abnormální transdukce signálu po vazbě 5-HT k receptoru.
Interakce
NA a 5-HT systémů
Sjednocující serotoninová-noradrenalinová hypotéza: b-adrenoceptorový systém v mozku, který je citlivý na podávání antidepresiv, je propojený s 5-HT systémem a je regulován glukokortikoidy, funguje jako zesilovací a adaptační systém pro různé funkce, včetně nálady. Tato hypotéza vychází z předpokladu, že pro terapeutické účinky antidepresiv je podstatná jejich schopnost downregulovat b-AR, přičemž při snížené dostupnosti 5-HT terapeutická účinnost antidepresivní léčby mizí.
Hypotéza o propojení funkcí noradrenergních a serotoninergních systémů: inhibiční presynaptické a2-adrenoceptory na serotoninových zakončeních jsou při těžké depresivní poruše supersenzitivní, což vede ke snížení 5-HT neurotransmise. Léčba některými antidepresivy (MAOI, blokátory uptake NA, a2-adrenergní antagonisté) vede k desenzitizaci a2-adrenergních heteroreceptorů na 5-HT zakončeních.
I když byla pozornost věnována
především neuronům obsahujícím jako hlavní mediátor noradrenalin nebo
serotonin, vznikla řada dalších hypotéz o úloze dalších neuromediátorových
systémů ve vzniku afektivních poruch.
Cholinergní-adrenergní hypotéza: s depresí je spojena supersenzitivita presynaptických acetylcholinových receptorů v mozkové kůře a zvýšený počet postsynaptických muskarinových acetylcholinových receptorů ve striátu a hippokampu.
Dopaminergní hypotéza: u některých podskupin depresivních pacientů dochází pravděpodobně ke snížení dopaminergní aktivity v mozku, u manických dochází zřejmě ke zvýšení. Předpokládá se, že přesmyk z manické fáze do depresivní je způsoben nebo doprovázen výrazným poklesem nadměrného uvolňování dopaminu.
GABAergní hypotéza: snížená funkce GABAergního systému je u některých osob dědičný biologický znak náchylnosti pro vznik afektivní poruchy. Dojde-li vlivem vnějšího prostředí (včetně stresu nebo nadměrného požívání alkoholu) ke zvýšení hladin mimobuněčné GABA, může to vést k symptomům deprese nebo mánie. Po léčbě, nebo po uplynutí určité doby, se GABAergní systém vrací do původního stavu a symptomy mizí.
Peptidergní
hypotéza: porucha funkce CNS při depresi může spočívat
v expresi určitého neuropeptidu v hypotalamu nebo blízkých limbických
strukturách.
Dysregulační hypotéza: afektivní poruchy jsou způsobeny narušením celkové rovnováhy neuromediátorových přenosových systémů.
Hypotéza endogenního ligandu: příčinou vzniku afektivní poruchy je nedostatek nebo nadbytek nějaké endogenní látky, např. látky, která se váže na imipraminové vazebné místo na transportním proteinu pro 5-HT.
Sjednocená neurochemická teorie deprese: tato hypotéza bere do úvahy vzájemné interakce dopaminergního, serotoninergního, noradrenergního, GABAergního a glutamátergního systému.
Neuromediátorová rovnovážná teorie: dopamin, noradrenalin a GABA modulují myšlení, úzkost a náladu, a serotonin je stabilizující látka, která se podílí na návratu mysli do jejího homeostatického stavu.
Rozvoj postreceptorových hypotéz
afektivních poruch koncem 80. let byl vyvolán nahromaděním důkazů o tom,
že snížení odezvy na aktivaci receptorů po chronickém podávání
antidepresiv není nezbytně důsledek downregulace a desenzitizace receptorů,
tzn. důkazů o tom, že psychotropní látky mohou modulovat postreceptorové
zesílení signálu. Pozornost je věnována především úloze G proteinů,
ale i efektorovým enzymům, druhým poslům, proteinkinasám a membránovým
lipidům.
Inositolová hypotéza: vznik afektivních poruch je spojen s poruchami v přenosových systémech, v nichž dochází k hydrolýze inositolových lipidů. Východiskem této hypotézy byly především účinky lithia na fosfoinositidový přenosový systém. Podle hypotézy o vyčerpání inositolu účinkuje lithium přes snížení hladin inositolu a tím způsobenou desenzitizaci receptorů, které pro svou funkci potřebují PIP2. Hypotéza byla upřesněna předpokladem, že Li+ inhibuje fosfoinositidovou přenosovou kaskádu pouze při zvýšené aktivaci tohoto systému a nemá vliv na jeho základní funkci. Příliš stimulované receptorové systémy spojené s aktivací PLC jsou tak lithiem tlumeny, zatímco stabilní systémy ovlivněny nejsou.
Hypotéza nerovnováhy druhých poslů: afektivní poruchy vznikají v důsledku narušení rovnováhy mezi adenylátcyklasovým a fosfoinositidovým systémem. Deprese je výsledek snížené buněčné odezvy zprostředkované cAMP při současné absolutní nebo relativní převaze odezvy zprostředkované IP3 a DG. U mánie je tomu obráceně.
G proteinová hypotéza deprese: dochází buď ke změně koncentrace funkčních podjednotek G proteinů, nebo změně jejich funkce; např. ve specifických oblastech mozku je při depresi zvýšená funkce Gs proteinů, která může vést ke zvýšené aktivitě adenylátcyklasy a k ovlivnění transdukce signálu.
Molekulární model: klinická heterogenita zjištěná u pacientů s bipolární poruchou může být vysvětlena změnami v těch částech přenosu signálu, které regulují dva nebo více neuromediátorových systémů s opačnými účinky na aktivitu neuronu. V tomto modelu jsou uvažovány změny funkce těchto tří postreceptorových složek schopných interagovat s více než jedním receptorovým systémem: 1. G proteinů, 2. fosfatas, 3. transkripčních faktorů. Kromě stimulační a inhibiční přenosové dráhy je v tomto modelu uvažována i stimulační dráha obsahující inhibiční zpětnovazebné působení na sebe samu a/nebo na jinou stimulační dráhu. Tímto způsobem je vysvětlován přesmyk z manické do depresivní fáze.
Molekulární a buněčná teorie deprese: Transkripční faktor CREB (cyclic adenosin-3’,5’-monophosphate response element-binding protein) je možným intrabuněčným cílem dlouhodobé léčby antidepresívy a mozkový neurotrofní faktor BDNF (brain-derived neurotrophic factor) je možným cílovým genem CREB. Náchylnost k depresi může vzniknout v důsledku poškození neuronů po chronickém stresu, který snižuje expresi mozkového neurotrofního faktoru v hippokampu. Přežití neuronů snižuje také dlouhodobé zvýšení hladin glukokortikoidů, hypoglykémie, ischémie, neurotoxiny a některé virové infekce. Dlouhodobé podávání antidepresiv zvyšuje expresi mozkového neurotrofního faktoru i jeho receptoru trkB přes zvýšení funkce 5-HT nebo NA systému.
Pozn.: CREB je regulován receptory, které jsou spojeny s cAMP-PKA kaskádou (5-HT4,6,7, b-AR) nebo přes receptory, které vedou k aktivaci kináz závislých na Ca2+ (5-HT2, a1-AR).
Membránová hypotéza: náchylnost pro depresi může vzniknout v důsledku změn vlastností buněčných membrán v určitých oblastech mozku. Narušení interakcí lipid-protein v buněčných membránách může být způsobeno změnami mikroviskozity membrán v důsledku snížené esterifikace sérového cholesterolu, nebo nadměrnou aktivitou fosfolipas A2, C, D, které jsou hlavními regulátory lipidového složení membrán. Byl vysloven předpoklad, že poruchy v interakcích lipid-protein způsobené nadměrnou aktivitou PLA2 jsou jedním z faktorů předurčujících vznik afektivní poruchy.
Biofyzikální hypotéza: zvýšený poměr mezi příjmem w-6 a w-3 esenciálních mastných kyselin, tedy relativní nedostatek typu w-3, může vést ke zvýšené náchylnosti ke vzniku deprese. Úlohu esenciálních mastných kyselin v patofyziologii afektivních poruch potvrzuje řada dalších měření, podle nichž membránové esenciální mastné kyseliny ovlivňují různé stupně přenosu nervového signálu monoaminovými neuromediátory, včetně tvorby neuromediátoru, jeho degradace, uvolňování, zpětného vychytávání a vazby. Je to dáno závislostí řady enzymů podílejících se na těchto procesech na změnách uspořádání membránových molekul. Poměrně malé změny ve struktuře membrán způsobené cholesterolem a zastoupením w-3, w-6 a dalších nenasycených mastných kyselin potom mohou modulovat nejen metabolismus biogenních aminů, jejich vazbu nebo zpětné vychytávání, ale i transdukci signálu, např. vlivem na aktivitu AC.
Hypotéza o vztahu mezi sérovými lipidy, depresí a aterosklerosou: oxidovaný lipoprotein s nízkou hustotou způsobuje zvýšené uvolňování IL-2 a jiných cytokinů aktivovanými T-buňkami. IL-2 potom způsobuje snížení sérového cholesterolu a zvýšení sérových triglyceridů, což snižuje uvolňování melatoninu a to vede k depresi a sebevražedným náladám.
Transportní hypotéza: u některých podskupin depresivních pacientů existují geneticky určené abnormality v těch vlastnostech buněčné membrány, které regulují pohyb elektrolytů přes plasmatickou membránu. Hypotézy o změněné iontové regulaci při afektivních poruchách vycházejí především ze skutečnosti, že aktivita membránové sodno-draselné pumpy, resp. Na+K+-ATPasy, určuje jak rychlost obnovy, tak velikost klidového membránového potenciálu. Byla popsána snížená aktivita různých typů ATPas (Na+K+-ATPasy, Mg2+-ATPasy, Ca2+Mg2+-ATPasy) v depresivní fázi. Vzhledem ke klíčové úloze ATPas v buněčném metabolismu může být jejich snížená aktivita při depresi doprovodným nebo sekundárním jevem k jiným biochemickým změnám.
Kalciová hypotéza: nitrobuněčná koncentrace Ca2+ je při mánii zvýšena, zatímco při depresi je buď snížena, nebo zvýšena.
Na+K+-ATPasová hypotéza afektivních poruch: snížená aktivita Na+K+-ATPasy může vést jak k mánii, tak k bipolární depresivní poruše v závislosti na stupni inhibice Na+K+-pumpy. Malé snížení aktivity pumpy zřejmě způsobuje celkové zvýšení excitovatelnosti neuronů, ale další snížení aktivity pumpy by mohlo vést ke snížení množství uvolněného neuromediátoru a rychlosti neuronální obnovy. Snížená aktivita ATPas může vést také k narušení funkce transportních systémů zajišťujících zpětné vychytávání neuromediátorů.
Hypotézy afektivních poruch, které nelze
jednoznačně zařadit mezi neuromediátorové, receptorové, či postreceptorové,
vycházejí z předpokladů, že poruchy v přenosu nervového signálu
mohou být způsobeny změnami v metabolismu glukosy, v excitovatelnosti
neuronů, v metabolismu lipidů nebo v metabolismu dosud neznámých
endogenních látek majících schopnost vyvolávat depresi či mánii.
Chronobiologické teorie afektivních poruch: v patogenezi afektivních poruch jsou zahrnuty poruchy určitých biologických rytmů. Není však jasný původ těchto poruch. Kritické biologické rytmy mohou regulovat především sociální rytmy asvětlo, resp. cykly světlo-tma. Účinnou biologickou terapií některých forem deprese může být fototerapie nebo spánková deprivace.
Hypotézy
pro sezónní afektivní poruchy
melatoninová hypotéza,
hypotéza fázového posunu,
amplitudová hypotéza,
nedostatek serotoninu,
snížená dopaminergní aktivita.
Fenyletylaminová hypotéza: 2-fenyletylamin je neuromodulátor, jehož je při depresi nedostatek. Tato hypotéza vycházela ze skutečnosti, že katecholaminy nejsou jediné fenyletylaminy, které mají vliv na náladu. Strukturně je 2-fenyletylamin blízký amfetaminu a katecholaminům.
Barininová hypotéza: endogenní látkou určující vznik onemocnění by mohl být hypotetický akceptor metylové skupiny od S-adenosyl-L-methioninu nazvaný předběžně „barinin“. Metylbarinin by měl mít schopnost zlepšovat náladu nějakým opět blíže neurčeným mechanismem, zatímco samotný barinin nikoli. Důsledkem abnormálního snížení (zvýšení) koncentrace metylbarininu by potom byla deprese (mánie). Jiní autoři však antidepresivní účinky S-adenosyl-L-methioninu vysvětlují zvýšenou metylací membránových fosfolipidů a obnovou vlastností membrán narušených zvýšenou činností PLA2.
Hypotéza o depresogenní látce: při spánku je uvolňována a při bdění metabolizována depresogenní látka. Tato hypotéza byla formulována na základě pozorování, že spánková deprivace vede k rychlému ústupu depresivních symptomů a následný spánek vede ve více než 80% k relapsu.
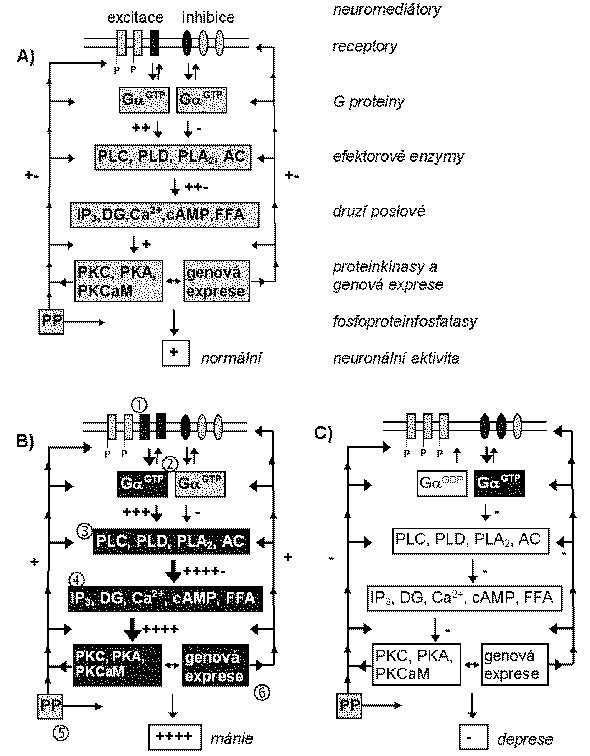
A) Normální přenos signálu: neuromediátor se váže k receptoru a aktivuje tak G protein, který aktivuje či inhibuje efektorové enzymy a iontové kanály; tím dochází k následné změně koncentrací druhých poslů, které jsou schopny aktivovat proteinkinasy. Aktivované proteinkinasy umožňují fosforylaci enzymů, iontových kanálů, G proteinů a receptorů, čímž mění jejich vlastnosti, což vede k depolarizaci či hyperpolarizaci membrány, nebo ke zpětnovazebnému ovlivnění výše popsaného přenosu signálu. Za normálního stavu existuje určitá rovnováha mezi excitačními a inhibičními neuromediátorovými systémy.
B) Manická fáze: předpokládá se, že v manické fázi dochází k poruše této rovnováhy zvýšením excitačního přenosu umožněném
zvýšením počtu a/nebo afinity excitačních receptorů (při dostatku neuromediátoru);
snížením GTPasové aktivity Ga podjednotky stimulačního G proteinu;
zvýšením aktivity efektorových enzymů, např. PLC;
delší dobou života druhých poslů způsobenou snížením aktivity příslušných enzymů, např. fosfodiesterasy štěpící cAMP;
delší dobou života fosfoproteinů (v důsledku nedostatečné funkce fosfatas), které zvyšují neuronální aktivitu
zvýšenou genovou expresí aktivujících složek přenosového systému
Vliv může mít také změněná aktivita proteinkinas a enzymů podílejících se na syntéze, exocytóze a degradaci neuromediátorů apod.
Biochemické děje provázející manickou fázi mohou vést ke zvýšené fosforylaci receptorů aktivovanými proteinkinasami a/nebo ke snížení afinity receptorů v důsledku snížené GTPasové aktivity Ga. Zvýšený excitační přenos však trvá po dobu, kdy přetrvává zvýšená aktivace G proteinů, systémů druhých poslů nebo dalších složek.
C) Depresivní fáze: snížení neuronální aktivity v depresivní fázi lze vysvětlit opačnými změnami v jednotlivých stupních přenosu signálu, než je uvedeno u manické fáze
Střídání manické a depresivní fáze při bipolární afektivní poruše lze vysvětlit např. tak, že je aktivován systém, který způsobuje nejprve zvýšení neuronální aktivity a poté její snížení přes záporné zpětnovazebné mechanismy.
Obecný model pro bipolární afektivní poruchu

Použité zkratky: Ga - alfa podjednotka G proteinu, GTP - guanosin-5’-trifosfát, PLC - fosfolipasa C, PLD - fosfolipasa D, PLA2 - fosfolipasa A2, AC - adenylátcyklasa, IP3 - inositol-1,4,5-trisfosfát, DG - sn-1,2-diacylglycerol, cAMP - cyklický adenosinmonofosfát, FFA - volné mastné kyseliny, PKC - proteinkinasa C, PKA - proteinkinasa A, PKCaM - proteinkinasa závislá na vápníku a kalmodulinu, PP - fosfoproteinfosfatas