2. Fluorofory v biomedicíně
Fluorofory se dělí do dvou obecných tříd:
- vnitřní (vlastní, intrinsic) – vyskytují se přirozeně
- vnější (nevlastní, extrinsic) – jsou přidány ke vzorkům, které nemají vhodné fluorescenční vlastnosti
2.1. Vlastní fluorescence
Vlastní fluorescence buněk je dána především těmito složkami:
- proteiny – fluorescence v ultrafialové oblasti
- redukované formy nikotinamidadenindinukleotidu (NADH), nikotinamidadenindinukleotid fosfátu (NADPH), oxidované formy flavoproteinů, vitamin A – fluorescence ve viditelné oblasti (modrá až žlutá)
- cytochromy, peroxidáza, hemoglobin, myoglobin, chlorofyl – fluorescence ve viditelné oblasti (červená)
Fluorescence proteinů
V proteinech jsou hlavními fluorofory aromatické
aminokyseliny tryptofan (Try), tyrozin (Tyr) a fenylalanin (Phe). Jejich absorpční pás leží mezi
Fluorescence tryptofanu je velmi citlivá na vlastnosti jeho okolí a lze ji proto použít pro sledování konformačních změn proteinů (např. při vazbě ligandů nebo při interakcích protein-protein).
Tabulka 2.1 Fluorescenční parametry tryptofanu, tyrozinu a fenylalaninu
|
fluorofor |
lexmax (nm) |
lemmax (nm) |
kvantový výtěžek |
doba života (ns) |
|
tryptofan |
295 |
353 |
0,13 |
3,1 |
|
tyrozin |
275 |
304 |
0,14 |
3,6 |
|
fenylalanin |
260 |
282 |
0,02 |
6,8 |
(Podle: Lakowicz 1999.)
Existuje několik tříd proteinů, které mají vlastní fluorescenci při delších vlnových délkách:
- fykobiliproteiny (z cyanobakterií a modro-zelených a červených řas), které absorbují od 470 do 650 nm (tj. v oblasti, kde neabsorbuje chlorofyl); jako fluorofory mají řadu výhod:
- intenzivní dlouhovlnná excitace a emise (neinterferují s vlastní fluorescencí jiných biologických molekul)
- relativně velký Stokesův posuv a vysoký kvantový výtěžek emise
- fluorescence není zhášena vnějšími zhášedly
- vysoká rozpustnost ve vodě
- homogenní struktura s definovanou molekulovou hmotností
- vícero míst pro stabilní konjugaci s mnoha biologickými i syntetickými látkami
- zelený fluorescentní protein (green fluorescent protein, GFP) z bioluminiscentní medúzy
- fytofluory – fluorescenční sondy odvozené od fytochromů (proteinů citlivých na světlo, které jsou přítomny ve fotosyntetizujících organismech)
Fluorescence
enzymových kofaktorů
- NADH silně fluoreskuje (lexmax @ 340 nm, lemmax @ 460 nm), zatímco jeho oxidovaná forma NAD+ nikoli; fluoreskující skupinou je redukovaný nikotinamidový kruh. Po vazbě NADH k proteinům se jeho fluorescence obvykle několikanásobně zvyšuje (ale může se i snížit), zřejmě v závislosti na omezení kontaktu fluoreskující nikotinamidové skupiny a adeninu, který fluorescenci částečně zháší.
- Pyridoxal fosfát je rovněž fluorofor; jeho fluorescenční parametry závisí na jeho chemické struktuře v proteinu.
- Flavin adenin dinukleotid (FAD), riboflavin a flavin mononukleotid (FMN) absorbují kolem 450 nm a emitují kolem 525 nm. Fluorescence flavinu je zhášena adeninem. Fluorescenční vlastnosti mají oxidované formy flavinů, nikoli redukované, jako je tomu u NADPH.
2.2. Nevlastní fluorescence
Vnější, neboli nevlastní fluorofory se používají mnohem více
než vnitřní. Přidávají se ke studovanému vzorku a pokud se na něj váží
kovalentně, nazývají se fluorescenční
značky, pokud se váží nekovalentně jedná se fluorescenční sondy.
Nevlastní fluorofory lze dělit do dvou skupin:
1. látky, jejichž kvantový výtěžek fluorescence se nemění po jejich zavedení do biologického systému - jedná se o fluorescenční barviva používaná v klasické fluorescenční cytochemii (např. fluorescein, akridinová oranž, eozin, …)
2. látky, jejichž kvantový výtěžek fluorescence se silně mění při vazbě na buněčné struktury a závisí na bezprostředním okolí fluoroforu (např. 1-anilinonaftalén-8-sulfonát, 1,6-difenyl-1,3,5-hexatrien, …)
Kromě požadavku na specifickou vazbu nevlastního fluoroforu k buněčným složkám a citlivosti emise fluoroforu na změny v okolí, je důležité, aby zavedením fluoroforu do bílkovin, nukleových kyselin, membrán apod. nedošlo k narušení funkce těchto biologických systémů.
2.2.1. Fluorescenční značky
Fluorescenční značky jsou nevlastní fluorofory, které se ke sledovaným biomolekulám (proteinům, peptidům, ligandům, oligonukleotidům a jiným) vážou kovalentní vazbou. Nejčastěji se používají k fluorescenčnímu značení proteinů, kdy se kovalentně vážou na jejich aminové, sulfhydrylové nebo histidinové boční řetězce, thiolové skupiny atd. Různé aplikace v imunologii, histochemii, afinitní chromatografii apod. využívají také vysokou afinitu a specificitu interakcí avidin-biotin a protilátka-hapten, kdy je studovaná molekula (protilátka, lektin, léčivo, polynukleotid, polysacharid, receptor) označena biotinem nebo haptenem a poté detekována fluorescenčně značenou protilátkou k biotinu nebo haptenu.
Mezi významné fluorescenční značky patří:
- fluorescein-5-izothiokyanát (FITC)
- dansyl chlorid (DNS-Cl; 5-dimetylaminonaftalén-1-sulfonyl chlorid)
- 5-jodoacetamidofluorescein (5-IAF)
- tetrametylrhodamin-5(a 6)-izothiokyanát (TRITC)
- 4-chloro-7-nitrobenz-2-oxa-1,3-diazol (NBD-Cl; 4-chloro-7-nitrobenzofurazan)
- 6-akryloyl-2-dimetylaminonaftalén (akrylodan)
Nejznámějšími fluorescenčními značkami jsou fluoresceinizothiokynát (FITC) a tetrametylrhodaminizothiokyanát (TRITC), které se používají v imunofluorescenčních metodách. Jejich fluorescenční parametry jsou uvedeny v tabulce 2.2. Eosin (2´,4´,5´,7´-tetrabromofluorescein) a erytrosin (2´,4´,5´,7´-tetrajodofluorescein) se obvykle používají jako fosforescenční sondy.
Obr. 2.1 Absorpční a fluorescenční spektrum fluoresceinu (pH 9,0)
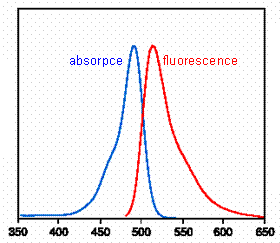
(Podle: Handbook of
Fluorescent Probes and Research Products.)
Obr. 2.2 Fluorescein-5-izothiokyanát
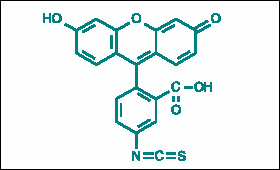
Další často používanou fluorescenční značkou je dansyl chlorid (DNS-Cl), který stejně jako FITC reaguje s volnými aminoskupinami proteinů. Může být excitován při 350 nm (tj. mimo oblast vlastní absorpce proteinů) a emituje kolem 520 nm, přičemž jeho emisní spektrum je silně závislé na polaritě prostředí.
Nová skupina fluorescenčních značek, jejichž fluorofor obsahuje bór, je zavedena pod značkou BODIPY. Jejich výhodou je vysoký kvantový výtěžek fluorescence, možnost použít různé deriváty s emisí v širokém rozsahu 510-675 nm, vysoký extinkční koeficient, nezávislost na polaritě okolí a na pH. Jejich nevýhodou je malý Stokesův posuv. Používají pro značení proteinů, nukleotidů, oligonukleotidů a dextranů, enzymových substrátů, mastných kyselin, fosfolipidů, lipopolysycharidů, receptorových ligandů (viz kap. 3.10.1) a polystyrénových mikrokuliček.
Akrylodan je reaktivní forma prodanu (6-propionyl-2-dimetylaminonaftalénu), jehož fluorescenční vlastnosti jsou vysoce závislé na polaritě okolního prostředí (na rozdíl od FITC, TRITC, BODIPY).
Pro detekci a kvantifikaci nízkomolekulárních aminů (např. řady léčiv) lze použít značky, které fluoreskují poté, co vytvoří konjugát s amino skupinou. Např. fluorescamin nebo NBD chlorid reagují rychle s aminy a teprve poté fluoreskují.
Tabulka 2.2 Fluorescenční parametry vybraných fluorescenčních značek
|
fluorofor |
lexmax (nm) |
lemmax (nm) |
kvantový výtěžek |
doba života (ns) |
|
FITC |
492 |
516-525 |
0,3-0,85 |
4,5 |
|
TRITC |
535-545 |
570-580 |
|
2,0 |
|
DNS-Cl |
340-350 |
510-560 |
0,1-0,3 |
10-15 |
|
NBD |
470 |
550 |
|
|
|
Fluorecamin |
380 |
464 |
|
|
|
Lucifer Yellow |
430 |
540 |
0,2 |
3,3 |
|
Eosin |
524 |
544 |
|
|
|
Erythrosin |
530 |
555 |
|
|
|
Alexa Fluor 350 |
346 |
442 |
|
|
|
BODIPY FL |
505 |
513 |
|
|
|
BODIPY R6G |
528 |
550 |
|
|
|
BODIPY TMR |
542 |
574 |
|
|
|
BODIPY 576/589 |
576 |
590 |
|
|
|
BODIPY TR |
589 |
617 |
|
|
(Podle: 1. Lakowicz 1999;
2. Handbook of Fluorescent Probes and Research Products.)
Další možností je syntéza chemického analogu molekuly, který zachovává chemické vlastnosti původní molekuly, ale na rozdíl od ní vykazuje fluorescenci. Například adenosin trifosfát (ATP) nefluoreskuje, ale jeho analog etheno-ATP je fluorofor, i když některé vlastnosti ATP jsou narušeny. Také byly syntetizovány fluorescenční analogy bazí DNA, adeninu (2-aminopurin) a guaninu (izoxantopterin). Pro studium interakcí steroidů s membránami mohou být využity fluorescenční analogy cholesterolu (dehydroergosterol) nebo estradiolu (azatetrahydrochrysen). Existují i sondy, které fluoreskují pouze ve viskózním prostředí (např. 9-(2-karboxy-2-cyanovinyl)julolidin, CCVJ) a mohou být použity pro studium viskozity membrán a rigidity vazebných míst na proteinech.
2.2.2. Fluorescenční sondy
Fluorescenční sondy jsou nevlastní fluorofory, které se ke sledované struktuře vážou nekovalentně a často přitom mění své fluorescenční vlastnosti. Volba fluorescenční sondy je klíčovou součástí experimentu ve fluorescenční spektroskopii, neboť právě její vlastnosti umožňují získat potřebné informace. Jsou známy tisíce sond, jejichž relativně nejúplnější přehled lze nalézt na webových stránkách firmy Molecular Probes, avšak podrobnější informace jsou dostupné jen v primární literatuře.
Iontové fluorofory, jejichž kvantový výtěžek fluorescence a někdy i spektrální vlastnosti se mění po navázání na bílkoviny, membrány nebo nukleové kyseliny se používají pro studium změn konformace bílkovin, tloušťky membrán, membránového potenciálu, viskozity prostředí apod. Vliv okolního prostředí na emisní vlastnosti takových fluoroforů je dán velkým zvýšením jejich dipólového momentu v excitovaném stavu; během doby života excitovaného stavu potom dochází k reorientaci obklopujících je molekul a tím k posuvu fluorescenčního spektra (viz Obr. 1.4).
Fluorescenční sondy
pro polaritu prostředí
Typickými sondami pro dynamickou polaritu jsou 1-anilinonaftalén-8-sulfonát (ANS) a 2-p-toluidinonaftalén-6-sulfonát (TNS). Z tabulky 2.3, kde jsou uvedeny fluorescenční parametry ANS v různých rozpouštědlech vyplývá, že s rostoucí polaritou rozpouštědla se emisní maximum fluorescence ANS posouvá do červené oblasti a současně klesá kvantový výtěžek a doba dohasínání. Při vazbě ANS k apomyoglobinu se ANS váže do nepolárního vazebného místa pro hem a lemmax se posunuje na 454 nm a kvantový výtěžek fluorescence vzrůstá na 0,98. Tímto způsobem lze studovat strukturu a stupeň polárnosti různých vazebných míst na proteinech včetně případného vytěsňování fluorescenčních sond z této vazby nebo změny vyvolané např. aktivací enzymu apod. ANS bylo použito např. pro studium polarity vazebného místa pro hem v apomyoglobinu a apohemoglobinu, nebo konformačních změn ve svalech a v nervových zakončeních během akčního potenciálu. TNS bylo využito např. pro studium konformačních změn po aktivaci chymotrypsinogenu a změn konformace nervové membrány. Demonstrační příklady vlivu polarity rozpouštědla na fluorescenci sondy 2-p-toluidinonaftalén-6-sulfonátu (TNS) a změna fluorescence ANS po vazbě k albuminu jsou uvedeny v kapitolách 3.1 a 3.2.
Tabulka 2.3 Parametry fluorescence sondy 1-anilinonaftalén-8-sulfonátu (ANS) při různé polaritě rozpouštědla
|
rozpouštědlo |
lemmax (nm) |
kvantový výtěžek |
doba dohasínání (ns) |
|
oktanol |
464 |
0,646 |
12,3 |
|
propanol |
466 |
0,476 |
10,2 |
|
metanol |
476 |
0,216 |
6,05 |
|
voda |
515 |
0,004 |
0,55 |
(Podle: Prosser a kol. 1989)
Membránové
fluorescenční sondy
Membrány obvykle nemají vlastní fluorescenci a jsou proto značeny sondami, které se vážou v oblasti jejich nepolárních uhlovodíkových řetězců (zbytků mastných kyselin). Pomocí řady fluorescenčních sond jsou studovány především tyto vlastnosti biologických systémů související s buněčnými membránami:
- transport a metabolismus lipidů v živých buňkách
- recyklace synaptosomů
- přenos signálu zprostředkovaný lipidy
- membránový potenciál (viz kapitola 3.7)
- interakce léčiv s membránou (viz kapitola 3.10.2)
- transport membránou
- mikroviskozita membrán a teplotní fázové přechody (viz kapitola 3.3)
Membránové sondy lze rozdělit do dvou skupin:
1. fluorescenční analogy přirozených lipidů (fosfolipidy, sfingolipidy, mastné kyseliny, triglyceridy, steroidy)
2. malé amfifilní a lipofilní organické fluorofory
ad 1. Důležitou skupinu membránových sond tvoří lipidové sondy, jejichž hloubku zanoření do lipidových dvojvrstev lze měnit délkou různých řetězců připojených k fluoroforu (např. různé antroyl mastné kyseliny nebo BODIPY mastné kyseliny). Pyrén připojený k lipidům může být použit pro studium difúzních procesů v membránách na základě měření jeho excimerové fluorescence. Rovněž připojením fluoresceinu nebo rhodaminu k dlouhým acylovým řetězcům nebo k celým fosfolipidům lze získat vhodné membránové lipidové sondy. Lze shrnout, že:
- Fluoroforem značícím mastné kyseliny může být např. nitrobenzoxadiazol (NBD), BODIPY, pyrén nebo dansyl. Přirozeně se vyskytující polynenasycená mastná kyselina cis-parinaric acid, jejíž dvojné vazby jsou konjugované, je fluorofor (max. absorpce při 300 a 320 nm, Stokesův posuv kolem 100 nm) vhodný pro řadu měření (peroxidace lipoproteinů, hodnocení antioxidantů, interakce mastná kyselina-protein, fosfolipid-přenašeč, shlukování lipidů, …).
- Fosfolipidy mohou být značeny řadou fluoroforů jak v oblasti polárních hlaviček (dansyl, NBD, BODIPY, fluorescein, tetrametylrhodamin, Oregon blue, Oregon green, Texas red a dalšími), tak zbytků mastných kyselin (DPH, NBD, pyrén, BODIPY). Rovněž byly připraveny fluorescenční analogy sfingolipidů, steroidů, triglyceridů, lipopolysacharidů.
Tabulka 2.4 Vlastnosti některých lipidových sond
|
fluorofor |
lexmax (nm) |
lemmax (nm) |
vlastnosti |
|
Pyrén |
340 |
376 |
citlivost na zhášení kyslíkem;
nefluoreskuje ve vodě; excimerová emise (470 nm) při vysokých koncentracích |
|
DPH |
360 |
430 |
nefluoreskuje ve vodě;
samozhášení při vyšších koncentracích |
|
NBD |
470 |
530 |
nefluoreskuje ve vodě;
samozhášení při vyšších koncentracích |
|
BODIPY FL |
507 |
513 |
fluoreskuje ve vodě i
v membráně; excimerová emise (620 nm) při vysokých koncentracích |
(Podle: Handbook of
Fluorescent Probes and Research Products.)
ad 2. Malé amfifilní a lipofilní organické fluorofory podávají informaci o charakteristikách svého mikrookolí, jako je polarita, viskozita a uspořádání lipidů. Pro značení membrán se nejčastěji používá nepolární sonda DPH (1,6-difenyl-1,3,5-hexatrien), která je ve vodě prakticky nerozpustná, takže veškerá fluorescence pochází z nepolárního prostředí biologických membrán kam se nekovalentně váže. Příklad jejího použití je popsán např. v kap. 3.3. Připojením trimetylamoniové skupiny k molekule DPH byly získána fluorescenční sonda TMA-DPH (1-(4-trimetylamoniumfenyl)-6-fenyl-1,3,5-hexatrien p-toluénsulfonát), která je v membránách lokalizována v blízkosti rozhraní membrána-voda. Mezi membránové fluorescenční sondy citlivé na prostředí patří např. 1,8-ANS (1-anilinonaftalén-8-sulfonová kyselina), bis-ANS (4,4'-dianilino-1,1'-binaftyl-5,5'-disulfonová kyselina), 2,6-TNS (2-(p-toluidinyl)naftalén-6-sulfonová kyselina), prodan (6-propionyl-2-dimetylaminonaftalén), laurdan (6-dodecanoyl-2-dimetylaminonaftalén) a další.
Obr. 2.3 Fluorescenční sondy difenylhexatrien (DPH) a jeho trimetylamoniový derivát (TMA-DPH); 1-anilinonaftalén-8-sulfonová kyselina (ANS) a 4,4'-dianilino-1,1'-binaftyl-5,5'-disulfonová kyselina, dvojdraselná sůl (bis-ANS)
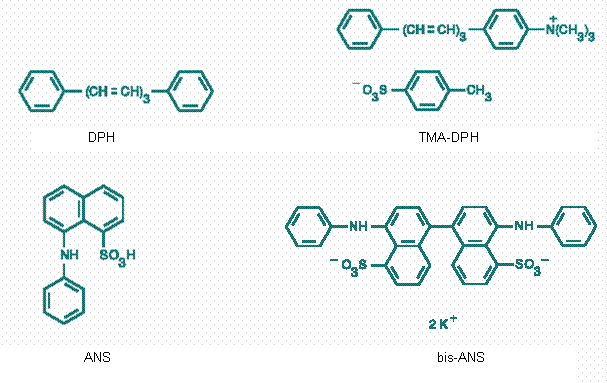
Tabulka 2.5 Některé membránové fluorescenční sondy
|
fluorofor |
lexmax (nm) |
lemmax (nm) |
MW |
rozpustné |
rozpouštědlo |
|
DPH |
350 |
452 |
232,32 |
DMF, MeCN |
MeOH |
|
TMA-DHP |
355 |
430 |
461,62 |
DMF, DMSO |
MeOH |
|
ANS |
372 |
480 |
299,34 |
pH>6, DMF |
MeOH |
|
bis-ANS |
395 |
500 |
672,85 |
pH>6 |
MeOH |
|
TNS |
318 |
443 |
335,35 |
DMF |
MeOH |
|
Prodan |
361 |
498 |
227,31 |
DMF, MeCN |
MeOH |
|
Laurdan |
364 |
497 |
353,55 |
DMF, MeCN |
MeOH |
DMF – dimetylformamid, MeCN –
acetonitril, DMSO –dimetylsulfoxid, MeOH - metanol
(Podle: Handbook of
Fluorescent Probes and Research Products.)
Sondy pro membránový
potenciál
Významnou skupinu membránových sond tvoří sondy citlivé na membránový potenciál. Patří se např. merocyanin 540, karbocyaniny (např. 3,3'-dihexyloxakarbocyanin jodid, DiOC6(3), viz kap. 3.7) a styrylové sondy (kap. 2.3.7).
Fluorescenční sondy
pro nukleové kyseliny
Nukleotidy a nukleové kyseliny obecně nefluoreskují. Výjimkou je kvasinková tRNAPE, která obsahuje vysoce fluorescentní bázi známou jako Yt-báze (lemmax @ 470 nm). DNA je tedy jen slabě fluorescentní nebo nefluorescentní. Pro vizualizaci a identifikaci chromozomů se proto používá řada fluorescenčních sond jako jsou akridinová oranž, ethidium bromid, propidium jodid, Hoechst 33342, 4',6-diamidino-2-fenylindol dihydrochloride (DAPI) a další. Kromě těchto klasických barviv se používají také cyaninová barviva pro stanovení nukleových kyselin v roztocích, gelech a blotech, procházející či neprocházející membránou živých buněk (Tabulka 2.6)
Tabulka 2.6 Některé fluorescenční sondy pro nukleové kyseliny
|
fluorofor |
lexmax (nm) |
lemmax (nm) |
použití |
|
Akridinová oranž (DNA) |
500 |
526 |
prostupuje; RNA/DNA; průtoková
cytometrie |
|
Akridinová oranž (RNA) |
460 |
650 |
|
|
Ethidium bromid |
518 |
605 |
neprostupuje; vmezeřování do
dsDNA; barvení mrtvých buněk; elektroforéza; průtoková cytometrie; … |
|
Propidium jodid |
535 |
617 |
neprostupuje; barvení mrtvých
buněk |
|
DAPI |
358 |
461 |
částečně prostupuje; buněčný
cyklus; AT-selektivní; … |
|
Hoechst 33342 |
350 |
461 |
prostupuje; AT-selektivní; selektivní
vazba k dsDNA; buněčný cyklus; … |
|
PicoGreen |
502 |
523 |
ultracitlivá kvantifikace
roztoků dsDNA |
|
OliGreen |
498 |
518 |
ultracitlivá kvantifikace
roztoků ssDNA a oligonukleotidů |
|
RiboGreen |
500 |
520 |
ultracitlivá kvantifikace
roztoků RNA |
|
TOTO-1 |
514 |
533 |
neprostupuje membránu; vysoká
afinita pro nukleové kyseliny |
|
SYTO 85 orange |
567 |
583 |
prostupuje membránou |
(Podle: Handbook of
Fluorescent Probes and Research Products.)
Po vazbě k dvouřetězcovým nukleovým kyselinám se silně zvyšuje např. kvantový výtěžek fluorescence sondy 2,7-diamino-10-etyl-9-fenylfenanthridium bromid (ethidium bromid, EB) s lemmax = 605 nm. Výraznou červenou fluorescenci této sondy vázané do buněčných jader lze velmi dobře pozorovat ve fluorescenčním mikroskopu i měřit na spektrofluorimetru (viz experiment popsaný v kapitole 3.5). Další často používanou sondou pro stanovení nukleových kyselin je akridinová oranž, která v monomerní formě fluoreskuje s lemmax = 530 nm, v dimerní formě (při vyšších koncentracích) s lemmax = 640 nm. Zelená monomerová fluorescence pochází z komplexů monomerů s dvouřetězcovými DNA nebo RNA, zatímco oranžová fluorescence pochází od komplexů dimerů sondy s jednořetězcovými nukleovými kyselinami. Spektrální parametr daný poměrem intenzit oranžové a zelené fluorescence (I640/I540) akridinové oranže charakterizuje stupeň spirálnosti nukleových kyselin. Např. ve zralých diferencovaných buňkách lymfocytů z periferní lidské krve je možno zanedbat podíl jednořetězcových DNA na oranžové fluorescenci a parametr I640/I540 charakterizuje poměr RNA/DNA v buňkách.
Obr. 2.4 Fluorescenční sondy pro nukleové kyseliny
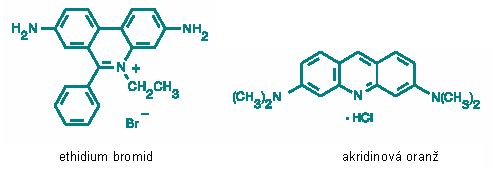
Fluorescenční sondy
pro přenos energie
Pomocí fluorescenčních sond lze studovat přenos energie od absorbujícího donoru k emitujícímu akceptoru, který se nalézá ve vzdálenosti RDA od donoru (viz kapitola 1.4). Lze tak ze změny spekter fluoroforu určovat vzdálenost mezi skupinami (v oblasti 1,5-6,5 nm) a studovat přenos energie v proteinech. Vhodné je pro tato měření použití časově rozlišené fluorescence.
2.2.3. Fluorescenční indikátory (chemické sondy)
Jako fluorescenční indikátory jsou označovány fluorofory jejichž spektrální vlastnosti jsou citlivé na určitou látku. V současné době jsou dostupné fluorescenční indikátory pro řadu látek, včetně vápníku, hořčíku, sodíku, chlóru, kyslíku, fosfátu, aminů a pro pH. Obvykle tyto indikátory buď
- vykazují spektrální posuv v závislosti na přítomnosti dané látky, jejíž koncentrace se potom určuje z poměru intenzit při různých vlnových délkách excitace nebo emise,
- nebo se jedná o indikátory, které vykazují zvýšení intenzity fluorescence v přítomnosti dané látky, aniž by docházelo ke spektrálnímu posuvu.
Příklady:
· N-(etoxykarbonylmetyl)-6- metoxyquinolinium bromid (MQAE) je srážkovým mechanismem zhášen chlórem a tuto sondu lze tedy použít pro měření změn koncentrací Cl-
· PBFI je fluorescenční indikátor citlivý na draslík
· Fura-2 je indikátor vykazující spektrální posuv v přítomnosti Ca2+
· Calcium green vykazuje zvýšenou intenzitu fluorescence v přítomnosti Ca2+, aniž by docházelo ke spektrálnímu posuvu
·
SNARF-
Pro studium živých buněk jsou užitečné acetoxymetylové (AM) a acetátové estery fluorescenčních indikátorů, protože zatímco původní indikátor neprochází buněčnou membránou, jeho AM nebo acetátový ester tak snadno činí (nenabitá molekula). Uvnitř buňky vzniká působením nespecifických esteráz původní indikátor. Příkladem je fluorescein diacetát, Quin-2 AM, Fura-2 AM a další.
2.3. Příklady použití
Některé příklady použití fluorescenčních sond a značek byly uvedeny již v předchozí kapitole. V oblasti neurověd se nejčastěji jedná o využití fluorescenční spektroskopie při sledování změn nitrobuněčných iontů a pH, membránového potenciálu, polarity okolí, „fluidity“ membrán, přenosu energie mezi molekulami, sledování enzymových reakcí, analýze DNA a při použití imunochemických (značené protilátky) a radiochemických (scintilační roztoky) metod.
2.3.1. Testování životnosti buněk, jejich proliferace a funkcí
Testování životnosti buněk, jejich proliferace a funkcí (včetně apoptózy, adheze buněk, chemotaxe, multidrug rezistence, endocytózy, sekrece a přenosu signálu) lze provádět pomocí fluorescenčních testů, které jsou mnohem citlivější než testy kolorimetrické a bezpečnější a levnější než testy využívající radionuklidy.
Testování životnosti a cytotoxicity je založeno na měření podílu živých a mrtvých buněk v populaci. Jako sondy životnosti buněk slouží:
- Fluorogenní substráty esteráz, které mohou pasivně pronikat do buněk a měří jednak zachování enzymatické aktivity buněčných esteráz, které je převádí na fluoreskující produkt, jednak membránovou integritu, která zajišťuje nitrobuněčnou retenci jejich fluoreskujících produktů. Obecně se postupuje tak, že acetátový nebo acetoxymetylový ester vhodného fluoroforu se rozpustí v DMSO (dimetylsulfoxid) v koncentraci 1-10 mmol/l a poté se přidá k buňkám v konečné koncentraci 1-25 mmol/l. Jednou z prvních sond pro toto použití byl fluorescein diacetát (FDA). Mezi nejlepší indikátory životnosti buněk patří calcein AM (díky vysokému záchytu v živých buňkách a silné fluorescenci). Dalšími vhodnými indikátory životnosti jsou např. 2',7'-bis-(2-karboxyetyl)-5-(a 6)- karboxyfluorescein, acetoxymetyl ester (BCECF, AM), karboxyeosin diacetát, karboxyfluorescein diacetát, …
- Barviva pro nukleové kyseliny, která neprostupují membrány živých buněk (viz Tab. 2.6) a lze je proto použít pro detekci mrtvých buněk. Mezi takové indikátory patří např. ethidium bromid, ethidium homodimer-1, propidium jodid, SYTOX Green, cyaninová barviva, jako TOTO, a další. Používají se často v kombinaci s nitrobuněčnými substráty esteráz, membránově propustnými barvivy nukleových kyselin, sondami citlivými na membránový potenciál, sondami pro organely nebo indikátory propustnosti membrán.
- Sondy, které jsou aktivními buňkami oxidovány nebo redukovány a umožňují tak měřit redox potenciál buněk jako znak jejich životnosti; např. resazurin, tetrazoliové soli.
- Sondy citlivé na transmembránový potenciál, pH nebo Ca2+ (viz kap. 2.3.5-7).
Tabulka 2.7 Fluorescenční sondy pro měření životnosti buněk
|
fluorofor |
MW |
rozpustné |
vlastnosti v buňkách |
lex/lem (nm) (po reakci, pH 9) |
|
Fluorescein diacetát (FDA) |
416,39 |
DMSO |
slabě udržován v buňkách;
pH citlivá fluorescence; nenákladný |
490/513 |
|
Calcein AM |
994,87 |
DMSO |
velmi dobře udržován;
uvolňován při cytolýze; fluorescence závislá na pH |
494/514 |
|
BCECF AM |
~615 |
DMSO |
velmi dobře udržován;
uvolňován při cytolýze; fluorescence závislá na pH |
501/527 |
|
Karboxyfluorescein diacetát (CFDA) |
460,40 |
DMSO |
středně dobře zadržován;
fluorescence závislá na pH |
492/518 |
|
Karboxyfluorescein diacetát, acetoxymetyl ester (CFDA,
AM) |
532,46 |
DMSO |
snadněji se dostává do buněk
než CFDA; středně dobře zadržován; fluorescence závislá na pH |
492/518 |
|
Chlorometyl SNARF-1, acetát |
499,95 |
DMSO |
dobře zadržován reakcí
s thioly; neúplně uvolňován při cytolýze; fluorescence dlouhovlnná a
závislá na pH |
576/639 |
(Podle: Handbook of
Fluorescent Probes and Research Products.)
Testování proliferace buněk je založeno na měření růstové rychlosti buněčné populace nebo na detekci dceřiných buněk v rostoucí populaci. Běžně neexistuje fluorofor, který by se specificky inkorporoval do buněk během dělení. Proliferační testy obvykle určují počet buněk z inkorporace [3H]-thymidinu nebo 5-bromo-2´-deoxyuridinu (BrdU, thymidinový analog). Fluorescenčně lze měřit např. změny v obsahu nukleových kyselin pomocí fluorescenčních sond (viz kap. 2.2.2) nebo pomocí fluorescenčně značených protilátek (např. anti-BrdU).
Apoptóza (programovaná buněčná smrt) je geneticky kontrolované odstraňování buněk během vývoje. Apoptóza je odlišná od nekrózy jak biochemickými, tak morfologickými změnami, které ji charakterizují. Fluorescenčně lze apoptózu testovat např.:
- s použitím sond pro nukleové kyseliny
- s použitím konjugátů annexinu V
- měřením aktivity specifických proteáz
- měřením změn mitochondrií, peroxidace lipidů, změn nitrobuněčného pH a iontů
2.3.2. Studium neurotransmiterových receptorů a iontových kanálů
Funkce neurotransmiterových receptorů a iontových kanálů je klíčová v transdukci nervového signálu studovaného v neurovědách. Existuje řada fluorescenčně značených ligandů (agonistů i antagonistů) pro tyto receptory (Tabulka 2.8) a iontové kanály nebo iontové přenašeče (Tabulka 2.9). Fluoroforem jsou např. fluorescein, tetrametylrhodamin, Alexa Fluor 488, BODIPY FL, Oregon Green 514, Alexa Fluor 594 a Texas Red, které jsou obvykle fotostabilní a poskytují silnou fluorescenci (Tabulka 2.10). Fluorescenční metody lze při studiu membránových receptorů využít také pomocí imunohistochemických metod (značené protilátky) – viz. kap. 2.2.1.
Tabulka 2.8 Příklady receptorů, k nimž jsou dostupné fluorescenčně značené ligandy
|
typ receptoru |
značený ligand |
účinky na receptor |
|
nikotinové acetylcholinové
receptory |
a-bungarotoxin |
antagonista |
|
muskarinové acetylcholinové
receptory |
pirenzepin |
antagonista M1 |
|
a1-adrenoceptory |
prazosin |
antagonista |
|
b-adrenoceptory |
CGP 12177 |
agonista |
|
GABAA receptory |
muscimol |
agonista |
|
neurokininové receptory |
látka P, neuromedin C, angiotensin II |
agonisté |
|
mí opioidní peptidové receptory |
naloxon, naltrexon |
antagonisté |
Tabulka 2.9 Příklady iontových kanálů, k nimž jsou dostupné fluorescenčně značené ligandy
|
typ iontového kanálu |
značený ligand |
účinky na kanál |
|
L-typ Ca2+ kanálů |
dihydropyridiny, verapamil |
blokáda |
|
Ca2+ kanály
necitlivé na IP3 |
ryanodinové sondy |
aktivace (ryanodinového
receptoru) |
|
Ca2+ kanály |
eosinové deriváty |
blokáda |
|
napěťově řízené Na+
kanály |
tetrodotoxin |
blokáda |
|
Na+/K+
ATPáza |
ouabain, dogoxigenin |
blokáda |
|
K+ kanály |
glibenklamid |
blokáda |
|
Cl- kanály
otevírané glutamátem |
ivermecin |
zvýšená propustnost |
|
transport anionů |
stilbene disulfonáty |
blokáda |
Tabulka 2.10 Fluorofory vázané k ligandům pro receptory a iontové kanály
|
fluorofor |
lexmax (nm) |
lemmax (nm) |
poznámka |
|
Fluorescein |
494 |
518 |
|
|
Tetrametyrhodamin |
553 |
577 |
často používaný |
|
Alexa Fluor 488 |
495 |
519 |
fotostabilní; intenzivní
fluorescence |
|
Oregon Green 514 |
512 |
530 |
velmi fotostabilní |
|
BODIPY FL |
507 |
513 |
|
|
Alexa Fluor 594 |
590 |
617 |
vhodné pro kombinaci se zeleně
fluoreskujícími značkami |
|
Texas Red |
593 |
613 |
vhodné pro kombinaci se zeleně
fluoreskujícími značkami |
(Podle: Handbook of
Fluorescent Probes and Research Products.)
2.3.3. Transdukce signálu
Nitrobuněčným přenosem nervového signálu se rozumí všechny procesy v postsynaptické nebo presynaptické buňce následující po aktivaci membránového receptoru neuromediátorem nebo jiným agonistou. Kaskáda těchto procesů obvykle zahrnuje aktivaci G-proteinů, efektorových enzymů, proteinkináz a fosfatáz a je zakončena změnou membránového potenciálu cílové buňky nebo změnou funkce a aktivity určitých buněčných proteinů (Obr. 2.5).
Vzhledem ke složitosti procesů zapojených do transdukce signálu existuje mnoho možností jak je sledovat pomocí fluorescenčních sond a fluorescenčně značených látek. Pozornost je věnována především
- regulaci
koncentrací nitrobuněčného kalcia
- sledování
aktivace a inhibice proteinkináz a fosfoproteinfosfatáz
- lipidovému metabolismu
Obr. 2.5 Mezibuněčný a nitrobuněčný přenos signálu
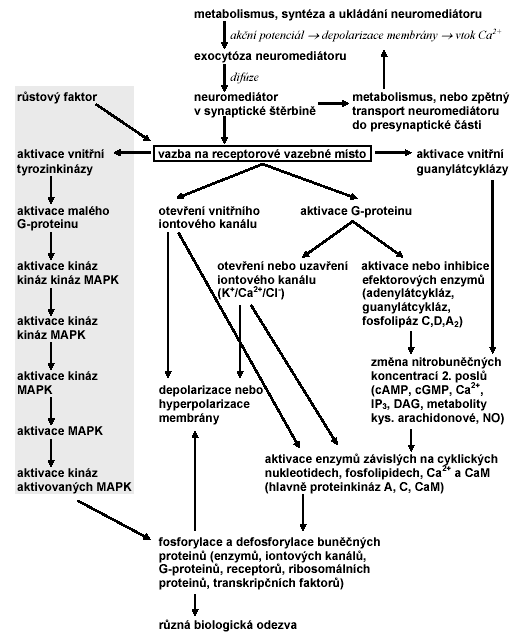
MAPK – proteinkinázy
aktivované mitogenem, cAMP – cyklický adenosinmonofosfát, cGMP – cyklický
guanosinmonofosfát, IP3 – inositol-1,4,5-trifosfát, DAG –
diacylglycerol, CaM - kalmodulin
2.3.4. Reaktivní kyslík
Existuje řada fluorescenčních sond umožňujících detekovat nebo generovat různé druhy reaktivního kyslíku, včetně singletového kyslíku, superoxidu, hydroxy radikálů a peroxidů (Tabulka 2.11). Tyto formy reaktivního kyslíku jsou fyziologicky produkovány v procesech jako je Alzheimerova choroba, apoptóza nebo fagocytóza a oxidují různé buněčné složky, jako NADH, NADPH, histidin, kyselinu askorbovou, tryptofan, tyrozin, cystein, glutathion, proteiny a nukleové kyseliny, a rovněž cholesterol a nenasycené mastné kyseliny (peroxidace lipidů).
Tabulka 2.11 Druhy reaktivního kyslíku
|
druh reaktivního kyslíku |
struktura |
příklady detekčních látek |
|
|
Peroxid vodíku |
H2O2 |
Dihydroxycalcein AM,
Dihydrorhodamin 6G, Luminol, Lucigenin |
|
|
Hydroxylový radikál |
HO× |
Proxyl fluorescamin,
TEMPO-9-AC, CM-H2DCFDA |
|
|
Kyselina chlorná |
HOCl |
Dihydrorhodamin 123, Luminol |
|
|
Oxid dusnatý |
NO |
DAF-FM, DAA, Luminol |
|
|
Peroxylový radikál |
HOO× |
BODIPY FL EDA, Luminol, cis-Parinaric acid |
|
|
Peroxynitritový anion |
ONOO- |
H2DCFDA,
Coelenterazine, Dihydrorhodamin 123, Luminol |
|
|
Singletový kyslík |
1O2 |
trans-1-(2´-metoxyvinyl)pyrén |
|
|
Superoxidový anion |
×O2- |
Coelenterazine,
Dihydroethidium, Lucigenin, Luminol, TEMPO-9-AC |
|
(Podle: Handbook of
Fluorescent Probes and Research Products.)
2.3.5. Indikátory pro Ca2+, Mg2+, Zn2+ a jiné kovové ionty
Fluorescenční měření změn nitrobuněčných iontů je možně díky sondám, které mění své spektrální vlastnosti po vazbě daného iontu. Nejčastěji se měří Ca2+, kterému je věnována řada knih. Indikátory jsou obvykle deriváty chelátorů Ca2+, Mg2+, Na+ nebo K+ jako je EGTA, APTRA a BAPTA, které mají vhodnou afinitu pro studovaný iont. Při výběru vhodného indikátoru bereme v úvahu:
- formu indikátoru (sůl, acetoxymetyl ester, dextranový konjugát), která ovlivňuje způsob, jakým se dostává do buňky (mikroinjekce, elektroporace, infúze z patch-pipety, pasivní difúze) a nitrobuněčnou distribuci
- způsob měření – některé indikátory vykazují po vazbě iontu spektrální posuv absorpce nebo emise (měří poměr intenzit při různých vlnových délkách excitace nebo emise), jiné změnu intenzity fluorescence
- disociační konstantu – musí být srovnatelná s měřenou koncentrací kationu (koncentrace menší než desetina nebo věší než desetinásobek disociační konstanty způsobují příliš malé změny v pozorovaném signálu)
Koncentrace sondy je v těchto měřeních mnohem menší, než koncentrace stanovované látky (analytu), neboť jinak by docházelo ke zkreslení koncentrací volného analytu. Pro sondy, které vykazují změnu intenzity fluorescence, ale nikoli spektrální posuv (jako je Calcium Green, Fluo-3, Rhod-2, Quin-2) je koncentrace analytu ca dána vztahem:
(2.1) ca = Kd (I-Imin)/(Imax-I)
kde je Kd – disociační konstanta vazebného místa pro analyt na indikátoru, Imin – intenzita fluorescence indikátoru, když není navázán žádný analyt, Imax – intenzita fluorescence plně obsazeného indikátoru, I – intenzita fluorescence ve vzorku, kde je jen část vazebných míst indikátoru obsazena analytem. Změny v intenzitě fluorescence jsou typicky způsobeny změnou kvantového výtěžku fluorescence po navázání analytu, spíše než změnou v absorpci. Měření Imax a nitrobuněčná kalibrace indikátorů se dělá pomocí ionoforů nebo uvolněním indikátoru do media o známé koncentraci analytu lýzou buněk.
Pro sondy, které vykazují spektrální posuv v absorpčním nebo emisním spektru po vazbě analytu se koncentrace analytu určuje z poměru intenzit nezávisle na celkové koncentraci sondy. Při měření poměru intenzit fluorescence při dvou různých excitačních vlnových délkách, je koncentrace analytu určována ze vztahu:
(2.2) ca = Kd (SF(l2)/SB(l2)) (R – Rmin)/(Rmax – R)
kde R=I(l1)/I(l2) je poměr intenzit pro dvě excitační vlnové délky l1 a l2, Rmin a Rmax jsou poměry pro sondu volnou a plně obsazenou analytem, SF(l2)/SB(l2)=eFFF/eBFB, e - extinkční koeficienty, F - kvantové výtěžky sondy excitované při l2.
Při měření poměru intenzit fluorescence při dvou různých emisních vlnových délkách lze použít rovnici analogickou rovnici (2.2), přičemž SF(l2)/SB(l2)=IF/IB je poměr intenzit volné a vázané formy.
Vybrané fluorescenční indikátory pro Ca2+ jsou uvedeny v Tabulce 2.12. Fluorescenčním indikátorem pro Mg2+ je např. Mag-Fura-2 nebo Mag-Indo-2; pro zinek FuraZin-1, IndoZin-1, FluoZin-1, pro Na+ je to sodík vázající benzofuran izoftalát (SBFI) a sodík vázající benzofuran oxazol (SBFO), pro K+ např. draslík vázající bezofuran izoftalát (PBFI).
Tabulka 2.12 Vybrané fluorescenční indikátory Ca2+
|
Ca2+ indikátor |
excitace lF(lB) (nm) |
emise lF(lB) (nm) |
způsob měření |
disociační konstanta (nmol/l) |
|
Fura-2 |
362(335) |
518(510) |
Ex 340/380 |
145 |
|
Fura- |
|
|
Ex 340/380 |
400 |
|
Fura- |
|
|
Ex 340/380 |
5300 |
|
Fura-FF |
|
|
Ex 340/380 |
5500 |
|
Indo-1 |
349(331) |
482(398) |
Em 405/485 |
230 |
|
Indo- |
|
|
Em 405/485 |
470 |
|
Fluo-3 |
504 |
526 |
Em 525 |
390 |
|
Fluo-4 |
|
|
Em 520 |
345 |
|
Fluo- |
|
|
Em 520 |
2300 |
|
Fluo-5N |
|
|
Em 520 |
90000 |
|
Quin-2 |
356(336) |
500(503) |
Em 495 |
60 |
|
Rhod-2 |
550 |
581 |
Em 580 |
570 |
|
Rhod-FF |
|
|
Em 580 |
19000 |
|
Rhod-5N |
|
|
Em 580 |
320000 |
|
Oregon Green BAPTA-1 |
494 |
523 |
Em 520 |
170 |
|
Oregon Green BAPTA-2 |
494 |
523 |
Em 520 |
580 |
|
Oregon Green BAPTA- |
|
|
Em 520 |
3000 |
|
Oregon Green BAPTA-5N |
494 |
521 |
Em 520 |
20000 |
|
Calcium Green-1 |
506 |
534 |
Em 530 |
190 |
|
Calcium Green-2 |
506 |
536 |
Em 535 |
550 |
|
Calcium Green-5N |
506 |
536 |
Em 530 |
14000 |
lF – vlnová délka pro volnou formu sondy, lB – vlnová
délky pro vázanou formu sondy; Ex – značí měření při uvedené vlnové délce excitace,
Em – značí měření při uvedené vlnové délce emise, dvojice čísel oddělená
lomítkem značí poměrné měření při dvou různých vlnových délkách
(Podle: 1. Handbook of
Fluorescent Probes and Research Products; 2. Lakowicz 1999.)
2.3.6. Indikátory pH
Fluorescenční sondy citlivé na pH umožňují měření pH uvnitř buněk s velkou citlivostí.
Nitrobuněčné pH je obecně v cytosolu mezi
Tabulka 2.13 Fluorescenční indikátory pH
|
fluorofor |
rozsah pH |
způsob měření |
|
SNAFL indikátory |
7,2-8,2 |
Ex 490/540 nebo Em 540/630 |
|
SNARF indikátory |
6,0-8,0 |
Em 580/640 |
|
HPTS (pyranin) |
7,0-8,0 |
Ex 450/405 |
|
BCECF |
6,5-7,5 |
Ex 490/440 |
|
Fluoresceiny a karboxyfluoresceiny |
6,0-7,2 |
Ex 490/450 |
|
LysoSensor Green DND-189 |
4,5-6,0 |
Em 520 |
|
Oregon Green indikátory |
4,2-5,7 |
Ex 510/450 nebo Ex 490/440 |
|
LysoSensor Yellow/Blue DND-160 |
3,5-6,0 |
Em 450/510 |
Ex – značí měření při uvedené
vlnové délce excitace, Em – značí měření při uvedené vlnové délce emise, dvojice
čísel oddělená lomítkem značí poměrné měření při dvou různých vlnových délkách
(Podle: Handbook of
Fluorescent Probes and Research Products.)
Fluorescein byl použit jako jeden z prvních indikátorů pH, především pro měření nitrobuněčných hodnot. Protože fluorescein se poměrně snadno z buněk uvolňuje jsou často používány jeho vysoce nabité deriváty, jako 5(6)-karboxyfluorescein nebo 2',7'-bis-(2-karboxyetyl)-5-(a 6)-karboxyfluorescein (BCECF). Do živých buněk se tyto sondy snadno dostávají jako acetoxymetylové (AM) nebo acetátové estery.
Fluorescein samotný je středně vhodná sonda. Poměr intenzit fluorescence změřené při dvou excitačních vlnových délkách (l1=450 nm, l2=495 nm) se zvyšuje se zvyšujícím se pH. Nevýhodou fluoresceinu je skutečnost, že jeho pKa je kolem 6,5, tedy mimo optimální rozsah běžných fyziologických pH.
Jako sonda pro poměrné měření fluorescence při dvou různých vlnových excitačních vlnových délkách je vhodnější sonda 8-hydroxypyrén-1,3,6-trisulfonát (HPTS; pyranin), kdy se měří poměr intenzit fluorescence při buzení l1=420 nm a l2=450 nm. Zdánlivá pKa této sondy je kolem 7,5.
Novější skupinou pH sond jsou seminaftofluoresceiny (SNAFL) a seminaftorhodafluory (SNARF). Vyznačují se tím, že mají velký posuv jak v absorpčním, tak v emisním spektru a mohou být tedy použity pro poměrná měření jak pro dvojici excitačních, tak pro dvojici emisních vlnových délek.
Obr. 2.6 Absorpční a fluorescenční spektra fluoresceinu při různých hodnotách pH
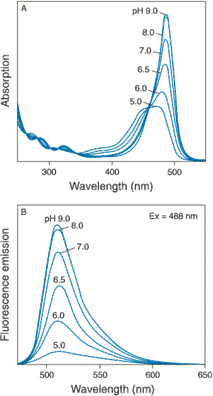
(Podle: Handbook of
Fluorescent Probes and Research Products.)
2.3.7. Membránový potenciál
V důsledku nerovnoměrného rozdělení iontů, především Na+, K+ a Cl- mají buněčné plazmatické membrány transmembránový potenciál kolem -70 mV (negativní uvnitř buňky). Depolarizace a hyperpolarizace membrán má klíčovou úlohu v řadě buněčných procesů, především v přenosu nervového signálu. Potenciometrické sondy umožňují měřit membránový potenciál i v organelách a buňkách, které jsou příliš malé pro zavedení mikroelektrod.
Potencimetrické sondy lze rozdělit do dvou skupin:
- Sondy s rychlou odezvou: vlivem změny okolního elektrického pole dochází ke změnám intramolekulární distribuce jejich náboje, což se projeví v rychlé změně jejich fluorescenčních parametrů (spektra nebo intenzity) - velikost této změny je často malá (2-10% na 100 mV). Jsou dostatečně rychlé pro měření potenciálových změn v excitovatelných buňkách.
- Sondy s pomalou odezvou: jsou to lipofilní aniony nebo kationy, které se přemísťují přes membránu elektroforetickým mechanismem a vykazují potenciálově závislé změny ve své transmembránové distribuci, která je provázena fluorescenčními změnami – velikost změny je typicky 1% na 1 mV. Patří sem kationtové karbocyaniny a rhodaminy a aniontové oxonoly. Jsou vhodné na měření změn průměrného membránového potenciálu neexcitovatelných buněk, způsobených respirační aktivitou, propustností iontových kanálů, vazbou léčiv a jinými faktory.
Tabulka 2.14 Potenciometrické fluorescenční sondy
|
sonda |
struktura |
odezva |
použití |
|
Di-4-ANEPPS Di-8-ANEPPS Di-2-ANEPEQ Di-8-ANEPPQ Di-12-ANEPPQ |
styryl |
rychlá; Ex 440/505 se snižuje při
hyperpolarizaci membrány |
· mapování membránového potenciálu podél
neuronů a svalových vláken · kombinace potenciometrických a Ca2+
nebo elektrofyziologických měření · detekce změn membránového potenciálu
v odezvě na farmaceutický stimul |
|
RH 237 RH 414 RH 421 RH 795 |
styryl |
rychlá; fluorescence se snižuje při
hyperpolarizaci membrány |
· zobrazování membránových potenciálů · funkční sledování neuronů · detekce synaptické aktivity |
|
RH 155 |
hybrid oxonol |
rychlá; mění se absorbance při cca 720
nm |
· neurony bezobratlých · membránové potenciály v svalové a
nervové tkáni · napěťově řízené Ca2+ kanály |
|
DiOC2(3) DiOC5(3) DiOC6(3) DiSC3(5) DiIC1(5) |
karbocyanin |
pomalá; fluorescenční odezva na
depolarizaci závisí na koncentraci a detekční metodě |
· kalciové kanály · aktivita mitochondrií · neurony a mozková tkáň · průtoková cytometrie · membránový potenciál v kvasinkách |
|
JC-1 JC-9 |
karbocyanin |
pomalá; Em 585/520 se zvyšuje při
hyperpolarizaci membrány |
· apoptická mitochondriální depolarizace · Ca2+ regulace
mitochondriemi · mitochondriální odezva na glutamátovou
excitotoxicitu |
|
Tetrametylrhodamin metyl a etyl estery |
rhodamin |
pomalá |
· membránový potenciál
v mitochondriích · Ca2+ regulace mitochondriemi |
|
Oxonol V Oxonol VI |
oxonol |
pomalá; fluorescence se snižuje při
hyperpolarizaci membrány |
· rostlinná fyziologie · iontové kanály a elektrogenní pumpy · liposomy |
|
DiBAC4(3) B-24570 DiBAC2(5) DiSBAC2(3) |
oxonol |
pomalá; fluorescence se snižuje při
hyperpolarizaci membrány |
· kalcium a membránový potenciál · životnost buněk průtokovou cytometrií · konfokální mikroskopie |
|
Merocyanin 540 |
merocyanin |
rychlá/pomalá (dvoufázová
odezva) |
· membránový potenciál
v mitochondriích a svalech · membránový povrch · asymetrie membránových lipidů · fotodynamická terapie |
Ex – značí měření při uvedené
vlnové délce excitace, Em – značí měření při uvedené vlnové délce emise, dvojice
čísel oddělená lomítkem značí poměrné měření při dvou různých vlnových délkách
(Podle: Handbook of
Fluorescent Probes and Research Products.)
2.3.8. Dynamika a uspořádání buněčných membrán
Biologické membrány jsou heterogenní systémy charakterizované přítomností fyzikálních rozdílností a topologicky nepravidelných lipidových a proteinových domén. Není proto možné úplně analyticky popsat distribuci a pohyb jejich molekul a makromolekul. Vychází se vždy z určitých modelů a přibližných vztahů, jejichž parametry lze experimentálně určit. Laterální pohyblivost molekul v rovině membrány je charakterizována laterálním difúzním koeficientem, pro rychlost reorientace určitých molekul v membráně se používají parametry pořádku a rotační korelační časy nebo rotační difúzní koeficient. Pomocí fluorescenční spektroskopie lze tyto parametry měřit za použití vhodných sond a časově rozlišené fluorescence (viz kap. 1.3). Nicméně i při měření anizotropie fluorescence za použití metody ustálené fluorescence, která je v současné době dostupnější, lze získat určité informace o relativních změnách dynamiky a uspořádání membránových složek. Používají se membránové fluorescenční sondy popsané v kap. 2.2.2. Konkrétní příklady této aplikace jsou uvedeny v kapitolách 3.10.2 a 3.10.3.
Parametry pro popis
dynamických vlastností membrán, jako izotropních systémů
V prvním přiblížení se lze dívat na vnitřek lipidové dvojvrstvy biologické membrány jako na homogenní neasociovanou izotropní nestlačitelnou kapalinu, jejíž vlastnosti jsou charakterizovány jedinou konstantou. V analogii s mechanikou kontinua je tato konstanta označována jako viskozita nebo fluidita, resp. tekutost. V případu lipidových dvojvrstev bylo zavedeno označení mikroviskozita. Protože viskozitu vnitřního prostředí dvojvrstvy nelze měřit přímo, je experimentálně určován parametr, který je s ní v přímé souvislosti. Je jím obvykle difúzní konstanta D, korelační čas tc nebo relaxační čas s. Převodní vztah mezi těmito parametry je tento
(2.3) D = 1/6tc = 1/2s
Difúzní koeficient látky rozpuštěné v nekonečném izotropním kontinuu je určen klasickým Stokesovým-Einsteinovým vztahem
(2.4) D = kT/f
kde je k – Boltzmannova konstanta, T – absolutní teplota, kT – tepelná energie, f – viskózní tření. Pro kouli o poloměru r je rotační viskózní tření dáno vztahem
(2.5) fr = 8phr3
a translační viskózní tření vztahem
(2.6) ft = 6phr
kde je h - koeficient viskozity. Fluidita je definována jako převrácená hodnota viskozity.
V konečném neizotropním prostředí je viskózní tření odlišné od izotropní kapaliny. Pro difúzi molekul proteinů v lipidové dvojvrstvě bylo zjištěno, že viskózní tření pro rotační pohyb se podstatně neliší od hodnoty pro izotropní prostředí splňující Stokesův-Einsteinův vztah, zatímco translační viskózní tření je podstatně menší, než pro izotropní systém. Translační i rotační difůzi v membránách lze souhrnně popsat pomocí difúzivity. Experimentálně je však často sledován jen jeden typ difúzního pohybu molekul v membráně. Nejčastěji se pro tato měření používají spektroskopické metody (elektronová spinová rezonance, jaderná magnetická rezonance, fluorescence, Ramanův rozptyl). Tyto metody jsou založeny na měření určitého signálu (rezonanční absorpce energie vysokofrekvenčního magnetického pole, fluorescenční nebo rozptýlené záření apod.) molekul, skupin či atomů lokalizovaných v membráně. Tyto zpravodajské skupiny jsou buď membráně vlastní, nebo jsou do ní vneseny (spinové sondy, radionuklidem značené molekuly, fluorescenční sondy a značky, rezonanční značky pro Ramanův rozptyl atd.) a musí splňovat základní podmínky:
- jsou to částice citlivé na mikrookolí, které po zavedení do určité oblasti systému dávají informace o změnách svého mikrookolí prostřednictvím odpovídajícího detektoru;
- fyzikální vlastnosti, které umožňují detekovat zpravodajskou skupinu se musí výrazně odlišovat od vlastností sledovaného systému;
- při zavedení sondy smí dojít jen k malému (lépe žádnému) ovlivnění biologického systému.
Měření ukázala, že rotační pohyb membránových molekul je velmi rychlý a při jeho sledování se pohybujeme v nanosekundovém oboru. Oproti tomu se při detekci translačních pohybů dostáváme až do oboru milisekund. Podle rychlosti sledovaného pohybu je nutno vybrat vhodnou metodu a sondu. Fluorescenční měření postihují oblast 10-7-10-10 s, fosforescence 10-3-102 s, metoda spinových sond 10-7-10-10 s, metoda elektronové spinové rezonance s přenosem nasycení prodlužuje škálu do 10-4 s. V dalším textu bude vysvětlován význam a možnosti stanovení difúzních koeficientů, korelačních časů a parametrů pořádku pomocí metod fluorescenční spektroskopie.
Rotační difúze
v izotropním systému
Měření koeficientu viskozity, resp. mikroviskozity biologických membrán fluorescenčními metodami spočívá obvykle v měření rotační depolarizace fluorescence vhodných molekul (sond) vázaných v membráně. K depolarizaci fluorescence těchto molekul buzených polarizovaným zářením dochází rotací molekul (tepelným Brownovým pohybem) v době mezi absorpcí a emisí. Tato doba je pro každou sondu jiná, pohybuje se však vesměs v oblasti nanosekund, a je jí určen rozsah rychlostí detekovaných jevů v membráně.
Experimenty jsou prováděny dvěma základními způsoby:
- stacionární metodou (ustálená fluorescence) s kontinuálním buzením a snímáním fluorescence;
- kinetickou metodou (časově rozlišená fluorescence) s pulzním buzením fluorescence a měřením průběhu jejího dohasínání .
Obvyklé uspořádání těchto experimentů je na Obr. 1.5 v kapitole 1.3, kde jsou také definice základních pojmů, které zde nicméně zopakuji:
stupeň polarizace
(2.7) p = (III - I^)/((III + I^) = 3 r/(2 + r) = (1 - d)/(1 + d)
anizotropie
fluorescence
(2.8) r = (III - I^)/((III + 2 I^) = 2 p/(3 – p) = (1 - d)/(1 + 2 d)
depolarizační faktor
(2.9) d = I^/III
kde III a I^ jsou složky světelné intenzity rovnoběžné nebo kolmé ke směru polarizace budícího záření.
V kinetické metodě jsou měřeny zvlášť dvě křivky dohasínání III(t) a I^(t) a anizotropie fluorescence je časově závislá. Pro sférickou molekulu v izotropním prostředí je tato časová závislost popsána jednoduchou exponenciálou
(2.10) r(t) = (III(t) - I^(t))/((III(t) + 2 I^(t)) = r0 exp(-t/tr)
(2.11) I(t) = III(t) + 2 I^(t) = I0 exp(-t/t)
kde je r0 – limitní hodnota anizotropie při vyloučení tepelného pohybu molekuly, I0 – počáteční hodnota intenzity fluorescence, t - doba života fluorescence (doba dohasínání), tr - rotační korelační čas (tr = 1/6Dr) zavedený pomocí rotační difúzní konstanty Dr, pro kterou v případě sférické částice platí Stokesův-Einsteinův vztah (viz rovnice 2.4 a 2.5)
(2.12) Dr = kT/6Vh
kde je V – objem částice, h – viskozita prostředí, k – Boltzmannova konstanta (=1,380662.10-23 J.K-1), T – absolutní teplota.
Při určování rotačního korelačního času sférické molekuly v izotropním prostředí z měření ustálené fluorescence lze použít Perrinovu rovnici, kterou dostaneme jednoduchým zprůměrováním r(t) přes čas a intenzitu
(2.13) r0/r = 1 + t/tr = 1 + 6Drt = 1 + kTt/Vh = 1 + C(r)Tt/h
kde je C(r) – parametr rotující molekuly, který je slabě závislý na r a pro nesférické molekuly se musí experimentálně určit. Měřené hodnoty anizotropie ustálené fluorescence r tedy mohou sloužit ke sledování kvalitativních změn fluidity nejbližšího okolí (kolem 10 nm) fluoreskující molekuly. Vyšší hodnota anizotropie znamená nižší fluiditu a naopak. Závislost r na h je však nelineární a pouze kolem hodnoty r0/2 lze dostatečně přesně detekovat změny h. Ve většině případů jsou změny C(r) a t v závislosti na r malé a působí proti sobě. Perrinův vztah (2.13) potom lze při konstantní teplotě zjednodušit
(2.14) ((r0/r)-1))-1 = K.h
kde K je konstanta. Pro sledování relativních změn mikroviskozity tedy není nezbytné měření dob dohasínání fluorescence, které vyžaduje složitější aparaturu.
Stanovení změn fluidity buněčných membrán na základě měření anizotropie ustálené fluorescence vhodné sondy je pro svou jednoduchost velmi rozšířeno. Problém spočívá v tom, že Perrinův vztah byl odvozen pro sondu v izotropním prostředí, což lipidová dvojvrstva buněčných membrán v žádném případě není. Pojem fluidity či mikroviskozity buněčných membrán potom ztrácí fyzikální význam a v těchto měřeních se jedná pouze o kvalitativní postižení změn uspořádání mikrookolí sondy a její pohyblivosti v membráně. Pomocí časově rozlišené fluorescence bylo potvrzeno, že anizotropie fluorescence určená stacionární metodou v sobě obsahuje jak informaci o pohyblivosti membránových molekul, tak informaci o jejich průměrném uspořádání. Kvantitativní zastoupení těchto dvou informací nelze z měření ustálené fluorescence určit.
Parametry pro popis
dynamických vlastností membrán, jako anizotropních systémů
Vztahy uvedené výše platí pouze pro izotropní prostředí a sférickou molekulu sondy. V druhém přiblížení bereme biologické membrány jako částečně anizotropní – tj. pohyb v membráně je omezený a rozlišujeme pohyb v rovině lipidové dvojvrstvy a kolmo k ní. Anizotropie fluorescence r(t) v tomto kapalně-krystalickém prostředí nedohasíná k nule, jako je tomu u izotropní tekutiny (viz vztah 2.10), ale k určité limitní hodnotě r(¥)
(2.15) r(t) = r(¥) + (r(0)- r(¥)) exp(-t/tr)
Hodnota r(¥) je vztahována k průměrné orientaci podélné osy molekuly sondy vzhledem k určitému směru (kolmici k rovině membrány). Pro interpretaci r(¥) tyčinkovité molekuly membránové sondy 1,6-difenyl-1,3,5-hexatrienu (DPH) byl vytvořen tzv. model kolísání v kuželu a byly zavedeny parametry orientačního pořádku. Pro r(0) i r(¥) byly odvozeny obecné vztahy, zde neuváděné. Zatímco počáteční hodnota r(0) je závislá pouze na úhlu mezi absorpčním a emisním pásem (viz vztahy 1.13, 1.14), limitní hodnota pro dlouhé časy r(¥) obsahuje informace o uspořádání lokálního mikrookolí sondy. Z obecných vztahů lze získat výrazy pro speciální případy, např. pro sondu s válcovou symetrií, jako je DPH.
Výrazy pro časovou závislost anizotropie fluorescence r(t) v anizotropním systému byly získány jen aproximativně, např. pro sondu s válcovou symetrií s momenty přechodu rovnoběžnými s podélnou osou molekuly při použití různých modelů pohybu částice v membráně (difúzního modelu, modelu silných srážek). Obvykle se ale pro r(t) používá fenomenologický výraz
(2.16) r(t) = r(¥) + (r(0)- r(¥)) exp(-t/ta)
který často vyhovuje pro krátké časy a kde je ta – určitý druh korelačního času charakterizující anizotropní rotační pohyb (zdánlivý rotační korelační čas). Zprůměrováním r(t) přes čas a intenzitu dostaneme výrazy pro anizotropii ustálené fluorescence r (měřenou při kontinuálním buzení vzorku), kdy jsou hodnoty r závislé jak na molekulárním uspořádání mikrookolí sondy, tak na jejím molekulárním pohybu.