1. Definice funkce a význam sledování
"Dřívější pohled na jeho definici dával vyniknout anatomickému vymezení extracelulárního prostoru. Dnes hluboce oceňujeme i závěr definice, který prozíravě a od začátku správně definuje stálost vnitřního prostředí jako funkci všech základních změn". Toto ocenění uvádí ve své knize z r. 1980 "Vnitřní prostředí, klinická biochemie a praxe" prim. MUDr. B. Nejedlý,
který se jako první z našich klinických biochemiků touto problematikou zabýval a stal se tak učitelem jak
klinických biochemiků, tak anesteziologů a intenzivistů řady dalších lékařských oborů.
Organizmus představuje polootevřený systém, který komunikuje prostřednictvím vnitřního prostředí s prostředím zevním. Tato komunikace spočívá v transportu a příjmu kyslíku, živin, minerálů a dalších nezbytných látek, ve výdeji energie,
CO2, H2O a dalších odpadních produktů. Vnitřní prostředí umožňuje migraci buněk. Od zevního prostředí je odděleno kůží, sliznicemi a alveolární výstelkou. Vnitřní prostředí má spoluúčast na zajištění stability objemu
a průtoku tělesných tekutin, stability osmolality a iontového složení, stability aktivity H+ a stability teploty. Sledování
změn vnitřního prostředí má význam pro včasnou diagnostiku chorobných stavů, sledování kritických stavů, posuzování vhodnosti terapeutických postupů.
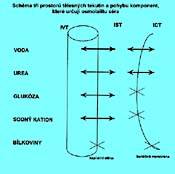
Tělesné tekutiny jsou krystaloidní a koloidní roztoky organických a anorganických látek. Tvoří jednak hlavní část buněčné fáze organizmu, intracelulární tekutinu, jednak tzv. extracelulární tekutinu. Tyto fáze jsou odděleny buněčnými membránami. Obě složky extracelulární tekutiny, tj. složka intravazální a intersticiální, jsou odděleny kapilární stěnou. Detailněji o rozdělení vody v organizmu - viz část 2. - Tělesná voda.
Při definování iontového a molekulového složení tělesných tekutin se rozeznává:
Koncentraci a hotovost je třeba chápat jako dynamickou rovnováhu mezi příjmem (input, I) a výdejem (output, O) látky. Stálost koncentrace je podmíněna vztahem I = O. V praxi disponujeme údajem o koncentraci, obrat odhadujeme z rozdílu mezi přísunem a odsunem látky, tj. z bilance.
Při sledování změn vnitřního prostředí, diagnostice jeho jednoduchých i smíšených poruch a sledování jejich léčby je zapotřebí používat komplexní přístup.
Sledujeme tyto tři skupiny informací:
Klinická biochemie vnitřního prostředí
Autor kapitoly: prof.MUDr.Antonín Kazda DrSc., Ústav klinické biochemie VFN a 1.LF UK Praha
"Co je vnitřní prostředí? Je to krev, ve skutečnosti však nikoli celá krev, nýbrž tekutá část krve, krevní plazma, všechny intersticiální tekutiny, zdroj a výslednice všech základních změn". Tuto definici napsal již v r. 1878 Claude Bernard.
1. Látková koncentrace (látkové množství rozpuštěné látky dělené objemem roztoku, jednotka mol/l), hmotnostní koncentrace (hmotnost rozpuštěné látky dělená objemem roztoku, jednotka kg/l, užívá se tam, kde Mr látky není známa), molalita (látkové množství rozpuštěné látky dělené hmotností samotného rozpouštědla, jednotka mol/kg) a některé další méně časté veličiny koncentrace.
2. Hotovost (zásoba, pool) látky, buď v celém organizmu nebo v jednotlivých oddílech tělesných tekutin.
3. Obrat (turnover), což je množství látky, které proteče distribučním prostorem za časovou jednotku.
1. Anamnézu. Je zaměřená na zdravotní stav především z hlediska předchozího postižení kardiovaskulárního aparátu, respiračních, renálních a jaterních funkcí, na metabolická onemocnění, především diabetes mellitus a na medikamentózní léčbu, především steroidy a diuretiky. Dále nás zajímá příjem živin, tekutin, změny tělesné hmotnosti. Délka nynějšího onemocnění, teploty, patologické ztráty tekutin a iontů (zvracení, průjmy) a jejich úhrada. Údaje o žízni, pocení a zejména a diuréze.
2. Somatické vyšetření. Je zaměřeno na stav hydratace (turgor kůže, sliznice, tonus bulbů), retenci tekutin (edémy, ascites a pod.), TK, puls, oběhové poměry, náplň krčních žil, centrální žilní tlak.
3. Laboratorní parametry
glykémie |
glykémie |
aniontová mezera* reziduální anionty* |
celk. bílk., albumin osmolalita, Na, K, Cl, ev. Ca laktát, amylázy dle potř. |
Ca, P, Mg |
index moč/krev pro ureu, kreatinin, osmolalitu |
glykozurie osmolalita Na, K, Cl amylázy dle potřeby |
glykozurie osmolalita Na, K, Cl odpady |
index Na/K moč clearance kreat. osmol., bezsol. vody frakční exkrece Na, K, vody, osm. |
Optimální je, můžeme-li koncentrace iontů ve ztrácených tělesných tekutinách měřit. Pokud je to vzhledem k jejich povaze obtížné nebo je to z jiných technických důvodů neproveditelné, spokojujeme se s odhady. Koncentrace elektrolytů a možné objemy ztrát gastrointestinálních a dalších tekutin jsou uvedeny v tab. 2.1. (pH žaludeční šťávy se pohybuje od hodnot 1 až 2 k vyšším, při anaciditě je pH nad 6).
mmol/l | mmol/l | mmol/l | mmol/l | ml/d |
|
|---|---|---|---|---|---|
silně kyselá | (10-30) | (5-40) | (80-150) | ||
málo kyselá | (70-140) | (5-40) | (40-120) | ||
(115-180) | (3-8) | (55-95) | (60-110) | ||
(130-160) | (3-12) | (90-120) | (30-40) | ||
drenáž | (80-150) | (2-8) | (60-125) | (20-40) | |
střevo, cékum | (40-135) | (5-30) | (20-90) | (20-40) | |
stolice | (20-160) | (10-40) | (340-120) | (30-50) | |
2. Tělesná voda
Průměrný podíl celkové tělesné vody (CTV) na tělesné hmotnosti (CTH):
Korekce na obezitu: u obézních tvoří tuková tkáň relativně větší podíl na CTH, u hubených relativně menší. Proto je nutno počítat u obézních s nižším podílem CTV na CTH, u hubených naopak s vyšším podílem. Např. u velmi obézních mužů je to 54%, u hubených až 68%. V praxi počítáme CTV nejčastěji jako 60% CTH.
CTV je rozdělena do těchto prostorů tělesných tekutin:
Intracelulární tekutina (ICT). Obecně se předpokládá, že tvoří 40% CTH, z toho asi množství odpovídající 30 až 35% CTH je v měkkých tkáních, především svalů. Zbytek, tj. množství odpovídající 8 až 10% CTH, je v pojivu, v chrupavkách a v kostech.
Extracelulární tekutina (ECT) tvoří 20% CTH. Její objem se u kriticky nemocných může velmi rychle měnit. Dělí se na intersticiální a intravaskulární tekutinu.
Intersticiální tekutina (IST) tvoří 10 až 15% CTH. Zajišťuje výměnu látek mezi buňkou a zevním prostředím. Buňky trpí při jejím nedostatku i nadbytku zhoršením této výměny. Iontové složení je podobné jako v plazmě, s výjimkou malé koncentrace bílkovin a větší koncentrace Cl-.
Intravazální tekutina (IVT). Plazma obsahuje vodu, představující 3,5-5% CTH.
Transcelulární tekutina. Patří k ní cerebrospinální mok, kloubní tekutina a tekutina v trávicím ústrojí. Nelze ji počítat k žádné ze složek ECT (tj. ani k IST ani k IVT). Celkové množství zpravidla nepřesahuje 500 ml, ale po jídle stoupá na 2 až 3 litry.
Tekutiny ve třetím prostoru. Vyskytují se jen za patologických situací, funkčně je nelze řadit ani k ECT ani k ICT. Patří sem např. patologické hromadění tekutin při ileu, kdy se může v lumen střev nahromadit 8 až 10 litrů tekutin. Při peritonitidě se může jednat o uložení 5 až 8 litrů tekutin v peritoneu. Patří sem i traumatický edém nebo ascitická tekutina.
Iontové složení IVT a IST je téměř shodné - viz tabulku 2.2. IST představuje ultrafiltrát krevní plazmy s minimem bílkovin. Aby byla i v IST zachována elektroneutralita v nepřítomnosti bílkovin, musí se ustavit nová (tzv. Gibbsova-Donnanova) rovnováha. Proto je koncentrace aniontů (Cl-, HCO3-) v IST vyšší než v plazmě a koncentrace Na+ naopak lehce nižší. To se v tab. 2.2 neprojevuje, protože koncentrace Na+ (141 mmol/l) je uvažována v plazmě s obsahem cca 6% bílkovin. Vodní fáze, v níž je Na+ rozpuštěn, zde tvoří 94%. Ve vodní fázi samotné by pak jeho koncentrace byla vyšší. Koncentrace Na+ v IST (143 mmol/l) která představuje fakticky jen vodní fázi, je pak proti IVT ve skutečnosti nižší (Tab. 2.2).
mmol/l | mmol/l | mmol/l |
|
|---|---|---|---|
Složení intracelulární tekutiny je v jednotlivých tkáních odlišné, tabulka předkládá její nejčastěji uváděnou iontovou skladbu a umožňuje posoudit základní rozdíly proti extracelulární tekutině.
Hodnocení diurézy má pro posuzování vnitřního prostředí základní význam. Jako oligurii označujeme objem moči 50-500 ml/d, jako polyurii označujeme objem nad 3000 ml/d. Většina hypermetabolických nemocných má diurézu kolem 3000 ml/d a vyšší. Je to dáno hyperkinetickým oběhem např. v sepsi, který intenzivista větším příjmem tekutin respektuje. Navíc se může uplatnit časté forsírování diurézy, nutnost vyloučit vysokou katabolickou nálož, a to někdy za podmínek, kdy ledvina není schopna adekvátně koncentrovat např. pro poškozený dřeňový gradient po hypoxických stavech nebo po intenzívní léčbě diuretiky. O adekvátnosti diurézy se přesvědčujeme nejen hodnocením stavu hydratace a oběhových poměrů, ale i osmolality tělesných tekutin. Je-li diuréza vzhledem k osmotické náloži a stavu renálních funkcí nedostatečná, nemocný se stává hyperosmolálním, přestože podle běžných kritérií močí dostatečně nebo více než dostatečně.
Při oligoanurických stavech je diuréza sledována v hodinových intervalech. Polyurie nekrytá dostatečným přívodem tekutin ohrožuje nemocného nedostatkem vody a bezprostředně ohrožuje i základní životní funkce. Současně s objemem moči je nutno kontrolovat hustotu moči a v indikovaných případech její osmolalitu. Zjišťují se denní ztráty iontů, především Na+ a K+, v indikovaných případech i Cl, s menší frekvencí i Mg, Ca a P. Při současné acidobázické poruše je vhodné I vyšetření pH moči. Informace o chemickém vyšetření (proteinurie, glykozurie a další) a o mikroskopickém vyšetření moče jsou u oligurických nemocných samozřejmé. Vyšetření ledvin doplňuje denní sledování S-urey a S-kreatininu. V akutních stavech je vhodné je doplnit sledováním některých clearancových vyšetření (clearance kreatininu, clearance bezsolutové vody) a frakčních exkrecí (natria, kalia, vody, osmolální).
3. Osmolalita
Někdy jsou uváděny rozdíly pro hodnoty v séru mezi oběma pohlavími, pro ženy v dolní, pro muže v horní polovině normy. Rozdíly ve vylučování osmoticky aktivních látek močí jsou uvedeny dále. Osmolalita séra je udržována v poměrně úzkých mezích. Při jejím zvýšení nad 278 (variace 277 až 282) se začíná zvyšovat sekrece vasopresinu. Ta pak stoupá plynule až do osmolality 296 až 298 mmol/kg, kdy je sekrece maximální. Současně se progresivně zvyšuje osmotická koncentrace moči. Další patologické zvyšování osmolality už sekreci vasopresinu nezvyšuje. Jinou stimulací sekrece vasopresinu je pokles cirkulujícího objemu o 10 až 20% nebo pokles krevního tlaku nejméně o 5%. Antidiuréza se pak uplatňuje i u stavů normo- či hypoosmolálních. Vylučování denní osmotické málože močí může někdy i za fyziologických okolností překročit výše uvedený interval. U zdravých osob se zvýšeným příjmem soli a bílkovin a s vysokou fyzickou aktivitou mohou být hodnoty vyšší než je nahoře uvedeno a mohou přesáhnout i 1500 mmol/d. Při nízkém příjmu bílkovin a v tělesném klidu u hospitalizovaných nekatabolických osob jsou naopak uváděny ztráty pod 600 mmol/d.
Pro ilustraci uveďme typické průměrné hodnoty koncentrací močí a rozsahy
vylučování osmoticky aktivních látek:
Referenční interval
sérum: 275 - 295 mmol/kg H2O
moč: 600 - 1200 mmol/d
mmol/kg H2O | mmol/d |
|
|---|---|---|
O osmolalitě séra (plazmy) rozhoduje především Na+ a jemu odpovídající anionty, dále urea, glukóza a v malé míře bílkoviny. Podíl urey se stává významnějším až s její retencí, podíl glykémie roste s dekompenzací diabetika nebo při intoleranci glukózy u kriticky nemocných. Podíl bílkovin, tzv. koloidně osmotický tlak, je významný pro udržení cirkulujících tekutin v cévním řečišti. Obr. 2.1 znázorňuje schématicky 3 prostory tělesných tekutin, oddělených membránami (kapilární stěna, buněčná membrána). Je znázorněn průnik komponent, podílejících se na osmolalitě plazmy, těmito membránami.

Kromě sledování vylučovaného množství osmoticky aktivních látek je užitečné sledovat i jejich koncentraci v moči. Umožňuje to posoudit současné koncentrační úsilí ledvin v porovnání s osmolalitou séra (plazmy). Je to jeden ze základních parametrů, sloužících k diferenciální diagnóze prerenální nebo renální příčiny oligoanurického stavu. Poměr U-osm/P-osm při prerenálním selhání je nad 1,5 a při renálním pod 1,1. Při hodnocení osmotické koncentrace moči je samozřejmě nutno respektovat i pokles koncentrační schopnosti v závislosti na věku nemocných. Sledování močové a plazmatické osmolality za podmínek dehydratace s následným podáním vasopresinu slouží k diferenciální diagnóze příčin hypotonické polyurie. Její příčinou může být diabetes insipidus centrální, psychogenní (dypsogenní) nebo nefrogenní.
Efektivní osmotický tlak
Tím, že urea prochází volně oběma membránami (obr. 2.1), nevede její zvýšení např. v intravazálním prostoru ke tvorbě trvalejšího gradientu mezi prostorami tělesných tekutin, který by způsobil přesun vody mezi nimi za účelem opětného dosažení rovnovážného stavu osmolality. Jestliže se ale zvýší v ECT glykémie (ať u diabetika nebo rychlou infúzí nekrytou adekvátně inzulínem), zvýší se efektivní osmotický tlak v tomto prostoru. To vede k přesouvání vody z ICT tak dlouho, až je opět dosaženo osmotické rovnováhy mezi ECT a ICT. Samozřejmě, že v ECT se přitom ředí další komponenty, např. natrémie klesá o 1,5 mmol/l na každé zvýšení glykémie o 5,5 mmol/l.
Podobná situace s uplatněním efektivní osmolality nastává i při přívodu solí natria při korekci hyponatrémie. Našim cílem je zvýšení koncentrace Na+ v ECT. Přesto se ve výpočtech (viz níže) pracuje s tím, jako bychom Na+ přidávali do CTV. Jeho přidání do IVT resp. ECT vede ke vzniku osmotického gradientu oproti ICT. Reakcí je částečný přesun vody do ECT.
Bílkoviny a polysacharidy (obr. 2.1) membránami neprocházejí, a proto budou i polysacharidové náhradní koloidní roztoky (dextran, hydroxyetylškrob) distribuovány rovněž jen v prostoru IVT. Do něj se bude po jejich infúzích přesouvat voda jak z IST, tak z nitrobuněčného prostoru.
Měření a výpočet osmolality, osmolal gap
Osmolalitu v laboratořích měříme na osmometrech. Jednotkou je mmol/kg H2O. Lze ji také odhadnout výpočtem z koncentrací Na, urey a glykémie (v hranatých závorkách):
osmolalita mmol/kg H2O = 2 [Na] mmol/l + [urea] mmol/l + [glykémie] mmol/l.
Obě hodnoty se běžně shodují, resp. liší pouze v intervalu do 5, maximálně 10 mmol/kg H2O. Porovnání výpočtu s měřením je užitečné tam, kde je podezření na přítomnost látek o malé molekule, s nimiž výpočet samozřejmě nepočítá. Měření potom může být vyšší než výpočet třeba o 50 až 100 mmol/kg H2O. Hovoříme potom o osmolální mezeře (osmolal gap). Např. 1o/oo alkoholu v plazmě zvýší naměřenou osmolalitu o cca 23 mmol/kg H2O.
4. Hyperosmolální a hypoosmolální stavy
Poněkud jinak je tomu v akutním katabolismu, tj. v šoku. Příčinou hyperosmolality je zde nahromadění metabolických meziproduktů v buňkách. Pro poruchu energetiky nemohou být metabolizovány na konečné produkty ani uvolňovány z tkání. Výsledkem je hyperosmolalita v ICT proti ECT, vedoucí k přesunu vody do buněk. Snížení objemu ECT zhorší oběhové poměry často již dříve primárně postižené.
V intenzívní péči může vzniknout akutní hyperosmolalita i iatrogenně. Mezi příčinami je např. špatné dávkování parenterální výživy, dialýza hyperosmolálním roztokem, vysoké dávky NaHCO3 při kardiální resuscitaci, transdermální absorpce propylenglykolu při léčbě popálenin nebo osmoterapie glycerolem či dalšími látkami o malé molekule. V posledně uvedených situacích vzniká výrazný rozdíl mezi měřenou a vypočítanou osmolalitou (osmolal gap), který se může pohybovat mezi 100 až 150 mmol/kg!
Klinicky vedou hyper- i hypoosmolalita bez ohledu na příčiny k příznakům metabolické encefalopatie, jejíž patofyziologický základ je v difuzních neuronálních funkčních poruchách s event. ložiskovým maximem. Jde o stavy od mírných neuropsychických poruch spojených s nespecifickými motorickými symptomy až k deliriu a nakonec kómatu. Vývoj hyperosmolálního stavu provázejí zmatenost a halucinace, které jsou někdy u starších lidí mylně považovány za projevy sklerózy mozkových cév. Typická je žízeň a bolesti hlavy. U starších osob jsou i za normálních okolností patrně změněny některé faktory, kontrolující vodní bilanci. Je snížen pocit žízně, zvyšuje se osmoregulační sekrece vasopresinu, ale renální odpověď na něj je otupena.
Při hypernatrémii může vzniknout hemorhagická encefalopatie. V likvoru je počet buněk normální, koncentrace bílkovin je nad 0,5 g/l, zbarvení CSF je xanthochromní nebo krvavé při hemorhagiích. EEG prokazuje nespecifické změny nebo ložiskové změny při krvácení, počítačová tomografie ukáže zmenšení objemu mozku, event. hemorhagii. Při přetrvávání akutně vzniklé hyperosmolality zvyšují mozkové buňky jako kompenzační mechanismus obsah osmoticky aktivních částic. To jim umožní doplnit objem na původní. Povaha těchto částic byla dlouho zčásti neznámá, byly nazývány idiogenní milimoly. V poslední době bylo zjištěno, že jde o více organických sloučenin (polyoly, aminokyseliny, aminy, cholinové sloučeniny, fosfokreatinin). Již dříve bylo uváděno i zvýšení obsahu anorganických iontů a glukózy při hyperglykémiích. V experimentu k tomuto vývoji dochází při hyperglykémii a hypernatrémii již během prvních hodin, dle jiných při hypernatrémii až během týdne. Klinické příznaky vznikají při akutním zvýšení natrémie nad 150 mmol/l a osmolality nad 310 mmol/kg H2O. Při chronickém stavu je to až při natrémii nad 160 mmol/l a při osmolalitě nad 330 mmol/kg H2O.
4.2 Hypoosmolalita
Klinicky je vývoj hypoosmolálních stavů provázen slabostí, nevolností, apatií a opět bolestmi hlavy. Vzniká difuzní edém mozku a nebezpečí herniace kmene mozkového, bílkovina v likvoru je nízká pod 0,1 g/l. EEG prokáže nespecifické, event. epileptiformní změny, počítačová tomografie prokáže difuzní edém mozku.
Pokles natrémie a osmolality se klinicky manifestuje v akutních stavech při hodnotách natrémie pod 125 mmol/l, resp. osmolality pod 265 mmol/kg H2O. Při chronických stavech jsou odpovídající hodnoty opět extrémnější, pro natrémii pod 120 mmol/l a pro osmolalitu pod 250 mmol/kg H2O. Při přetrvávání akutně vzniklé hypoosmolality se kompenzačně snižuje počet osmoticky aktivních částic v mozkových buňkách, což brání jejich edému. Jde o částice popisované již v případě hyperosmolality, v tomto případě se ale jejich počet naopak snižuje.
Extrémní hodnoty osmolality. Nejnižší publikované hodnoty vůbec byly pod 200 mmol/kg H2O při léčbě thiazidovými diuretiky a neslanou dietou. Nejnižší osmolalita séra, kterou jsme sami naměřili, byla 213 mmol/kg H2O u nemocného s morbus Addison. Měl průjmy léčené zpočátku nesprávně roztoky glukózy. Jeho natrémie klesla na 98 mmol/l. Hyperosmolality nad 500 mmol/kg H2O byly popsány u dvou nemocných s kombinovanou otravou etyl- a metylalkoholem.
4.3 Korekce poruch osmolality
V důsledku hypoosmolálních stavů je popisována demyelinizace v CNS, původně v oblasti mostu, později i jinde. Jejími následky jsou pseudobulbární ochrnutí, chabé kvadruplegie, zhoršení citlivosti. Dosud není jasné, zda za stav je zodpovědná samotná hypoosmolalita nebo rychlost její úpravy. Proto se u hypoosmolality doporučuje postupovat zvlášť opatrně. Nahoře uvedená rychlost úpravy platí jen u akutně vzniklých stavů vzápětí léčených. Po dosažení natrémie 120 mmol/l je nutno zmírnit rychlost na 0,5 až 0,6 mmol/kg.hod-1. Důvodem k opatrnosti a k monitorování biochemických nálezů jsou výše uvedené změny v oblasti mozku, kdy se při prudší úpravě může právě pro kompenzační změny mozkových buněk jejich velikost prudce měnit a klinický stav nemocného zhoršit. Např. zvýšení počtu osmoticky aktivních částic za stavu hyperosmolality s dehydratací vede při poklesu osmolality ECT během léčby k prudkému přesunu vody do mozkových buněk a k příznakům nitrolební hypertenze. Při odstranění hypoosmolality je tomu zcela naopak. Počet částic v mozkových buňkách se kompenzačně snížil. Zvyšování osmolality ECT vede pak k prudkému poklesu objemu buněk CNS.
Ke každému nemocnému je nutno přistupovat individuálně a pouze monitorování jak biochemického, tak i klinického stavu je směrodatné pro posouzení úměrnosti léčby.
5. Poruchy vodního a iontového hospodářství
Referenční meze:
Celková zásoba Na+ u muže vážícího 70 kg činí asi 3700 až 4000 mmol. Z toho asi 30 % ( 1100 - 1200 mmol ) je nesměnitelný podíl uložený v kostech a v buněčných strukturách. Extracelulární zásoba je 1800 až 2000 mmol, směnitelná celulární zásoba je kolem 1000 mmol. Interpretaci nálezů natrémie a úvahu o vhodné korekční dávce Na+ nebo/a vody může usnadnit rozdělení poruch vodního a solného metabolismu, předložené v dalším textu. Jsou uváděna schematická znázornění jednotlivých poruch, která vždy vycházejí z fyziologických poměrů jak objemu ECT, tak i zásoby Na+ v ní. Schémata upozorňují i na přesuny vody mezi prostorami tělesných tekutin, k nimž dochází při vzniku osmotického gradientu při zvýšení nebo snížení osmolality v některém z těchto prostorů.
Předpoklady hodnocení poruch vodního a iontového metabolismu
Dělení poruch vodního a iontového hospodářství
V dalším textu budou předložena schémata základních poruch vodního nebo solného hospodářství. Jsou uspořádána tak, že vlevo je vždy fyziologická situace velikosti ECT a zásoby Na, v dalších sloupcích potom patologická situace, event. její alternativy a konečně korekce. Tam, kde dochází v důsledku změn efektivní osmolality k přesunu vody mezi ICT a ECT, je to vyznačeno.
5.1.1 Fyziologická hydratace s natrémií v referenčních mezích.
5.1.2 Fyziologická hydratace s hyponatrémií (obr. 2.2a).
Akutní stavy
Korekce: u asymptomatických stavů stačí zpravidla izotonické solné roztoky. U symptomatických hyponatrémií se přivádí Na+ formou hyperosmolálních roztoků podle výpočtu:
(rovnice 1)
4.1 Hyperosmolalita
Příčinou hyperosmolality může být ztráta prosté vody, akutní katabolismus, diabetické kóma, hyperosmolální kóma bez acidózy, popáleniny, často selhání ledvin, těžké sepse, akutní intoxikace látkami o malé molekule, diabetes insipidus, nefrogenní diabetes insipidus a tonutí ve slané vodě. Patobiochemicky je u většiny těchto stavů v popředí zvýšení efektivní osmolality v ECT a přesun vody z IC do EC prostoru.
Příčinami hypoosmolality jsou metabolická odpověď na trauma, nadbytek celkové vody, úhrada ztrát izotonické tekutiny vodou, chronický katabolismus, tonutí ve sladké vodě, nepřiměřená sekrece ADH.
Korekce poruch osmolality má obecně probíhat pomalu tak, aby se osmolalita neměnila prudčeji než o 2 až 4 mmol/kg.hod-1 resp. natrémie o 1 až 2 mmol/hod. a aby celková změna za 24 hodin nebyla větší než 20 až 30 mmol/kg H2O.
5.1 Natrium
plazma 132 - 142 mmol/l
moč 120 - 140 mmol/l.
1. Znalost aktuální tělesné hmotnosti a její porovnání s běžnou (standardní) hmotností nemocného. Protože nemocné na většině jednotek intenzívní péče a resuscitačních stanic vážit nelze, je nutno se spokojit s odhadem běžné hmotnosti. Posouzení akutně vzniklé změny: při klinicky zřejmé dehydrataci se uvažuje deficit tekutin v rozsahu 2,5 až 5,0 % běžné tělesné hmotnosti, při hyperhydrataci je to nadbytek tekutin v rozsahu 2,5 až 7,5 % hmotnosti. Takže, když např. u 70 kg dehydratovaného nemocného odhadneme úbytek tělesné hmotnosti na 5 %, počítáme s deficitem 3,5 litru, který nutno korigovat. Kritériem správnosti tohoto odhadu je klinická reakce nemocného na léčbu (stav hydratace, diuréza) i úprava laboratorních parametrů.
Příznaky dehydratace: snížený turgor kůže, suché sliznice, "hadrovité" bulby, snížená náplň žil, oligurie, nízký centrální žilní tlak.
Příznaky hyperhydratace: zvýšený turgor kůže, i lehké kabely od monitorů zanechávají otisk na kůži, je zvýšená náplň žil i centrální žilní tlak, stoupá hmotnost, začínají otoky.
2. Výpočty terapeutických dávek Na+, které vycházejí z natrémie, je nutno posuzovat v širších souvislostech. Jejich validita závisí nejen na absolutní koncentraci Na+, ale i na jeho zásobě a na vztahu mezi touto zásobou a velikostí ECT a sekundárně i ICT.
Stav hydratace se hodnotí klinicky a podle toho se nemocní dělí na tři skupiny: s hydratací fyziologickou, s dehydratací a s hyperhydratací. Ve všech těchto skupinách může být zjištěná natrémie jak v referenčním intervalu, tak i hyponatrémie nebo hypernatrémie.
Terapeutické dávky vody a solí jsou tvořeny dvěma složkami: korekční a substituční.
Korekční: Jedná se o dávky, které upravují stávající deficity v organizmu. Následující popisy jednotlivých situací jsou zakončeny výpočty nebo úvahami právě o dávkách korekčních.
Substituční: Jde o dávky, kterými hradíme měřitelné i neměřitelné ztráty z organismu. Jde o logické součty, které při určení celkové dávky přičítáme k dávkám korekčním. Nevyžadují žádné zvláštní výpočty a další text se jimi nezabývá.
U nemocných s nálezy natrémie v referenčních mezích a s fyziologickou hydratací se provádí pouze substituce renálních a extrarenálních ztrát.
Hmotnost je nezměněná, klesla zásoba Na+ v ECT. Situace vzniká jednak u akutních, jednak u chronických stavů.
Ztráty vody a iontů byly hrazeny infúzemi glukózy nebo pitím vody. Vznikající hypoosmolalita ECT vedla k přesunu části vody z ECT do ICT.
Na+cílové = hodnota na poloviční vzdálenosti mezi zjištěnou hyponatrémií a referenční hodnotou 137 mmol/l. Úprava natrémie nemá být rychlejší než o 0,5 až 0,6 mmol/l hod. Pouze u akutně vzniklé hyponatrémie může být rychlejší do hodnoty 120 mmol/l (viz nahoře - část o korekcích poruch osmolality).
F = faktor pro výpočet distribučního prostoru, u mužů F = 0,6, u žen 0,55.
CTH = standardní (běžná) hmotnost nemocného v kg.
Po podání natria dochází ke změnám distribučního prostoru natria, část vody se vždy přesune z ICT do ECT. Při extrémních hyponatrémiích jsou takto určené dávky značně vysoké. Potom volíme s ohledem na klinický stav hodnoty faktoru nebo cílové natrémie nižší (např. jen o 5 vyšší než je zjištěná) a dle laboratorní kontroly po podání dávky Na potom korekci doplníme.
Chronické stavy
Vleklý katabolismus vede k atrofii buněčných struktur, a tím k poklesu tonicity buněk. Část vody se přesune z ICT do ECT. Bývá hypoosmolalita, hyponatrémie, hypoproteinémie.
Korekce: přísun Na+ situaci neřeší, zvýší pouze jeho vylučování. Terapie musí být kauzální + zajištění energetického příjmu. Na+ resp. jeho soli podávat pouze při symptomatické hyponatrémii a s ohledem na klinický stav!
Poznámka:
U metody plamenové fotometrie, která se někde používá ke stanovení natria, je změřená natrémie závislá na obsahu bílkovin a lipidů v plazmě. Tam, kde se jejich hodnoty patologicky zvyšují, se změřená natrémie falešně snižuje. Hovoří se o tzv. pseudohyponatrémii.
Korekce: je možno provést dva výpočty, ale oba mají hodnotu pouze teoretickou. Je to výpočet nadbytku natria a "deficitu" tekutin:
(rovnice 2)
 5.1.3 Fyziologická hydratace s hypernatrémií (obr. 2.2b)
5.1.3 Fyziologická hydratace s hypernatrémií (obr. 2.2b)
Hmotnost je nezměněná, zvýšila se zásoba Na+ v ECT. Dochází k přesunu vody z ICT do ECT.
| nadbytek natria (mmol/l) = CTH . F . ( 1 - | 137 | . 137 |
| ---------- ) | ||
| Na+zjištěné |
(rovnice 3)
| "deficit" H2O (litry) = CTH . F . ( | Na+zjištěné | - 1) |
| ---------- | ||
| 137 |
Symbolika - viz rovnice 1, hodnota faktoru F je v tomto případě vždy 0,2. Podání vypočteného množství tekutin by vedlo sice k úpravě natrémie, ale zároveň k hyperhydrataci. Podávají se diuretika a infúze 5 % glukózy.
Korekce: nálezy natrémie nelze užít k výpočtům potřebného množství tekutin. Podává se takové množství izotonických solných roztoků, které je úměrné rozdílu hmotnosti běžné a aktuální. Protože se podaná tekutina bude distribuovat prakticky jen v ECT, podává se s ohledem na možné zatížení oběhu v indikovaných případech pouze 2/3 vypočteného množství, zbytek se doplňuje podle reakce nemocného.
Pozor! Zde jde často o stavy s trvající značnou ztrátou víceméně izotonické tekutiny (žaludeční šťávy, průjmy). Proto zde bude i substituční dávka solných roztoků vysoká.
Korekce: úplná náhrada deficitu vody a Na+ má dvě části. První je doplnění chybějících tekutin solnými roztoky. Pro jejich množství je určující pokles hmotnosti nebo jeho odhad. Také v tomto případě se při úvaze o iniciální korekční dávce uvažují zpravidla 2/3 chybějícího množství izotonických tekutin. Druhou je úprava zjištěné hyponatrémie s určením cílového Na+ a výpočtem dle rovnice 1. Patologické mechanismy se ale upravují většinou izotonickými solemi a korekce koncentrovanými solemi není potom nutná.
5.1.6 Dehydratace s hypernatrémií (obr. 2.4 A)
Ve všech případech vzniká přesun vody z ICT do ECT, úměrný osmotickému gradientu. Korekce musí mít dva kroky.
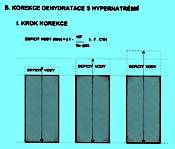
První z nich je na obrázku 2.4 B a znázorňuje, jak se liší vypočítané množství deficitu prosté vody od skutečného deficitu hmotnosti.
Výpočet deficitu prosté vody:
(rovnice 4)
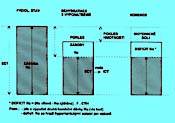
 5.1.4 Dehydratace s natrémií v referenčním intervalu (obr. 2.3a)
5.1.4 Dehydratace s natrémií v referenčním intervalu (obr. 2.3a)
Hmotnost je snížená, stejně tak klesla i zásoba Na+. Nedochází k přesunu vody mezi ICT a ECT. Tento stav je zvlášť nebezpečný tím, že celá ztráta postihuje jen ECT, hrozí brzy oběhový kolaps, oligurie a metabolická acidóza.
 5.1.5 Dehydratace s hyponatrémií (obr. 2.3b)
5.1.5 Dehydratace s hyponatrémií (obr. 2.3b)
Hmotnost je snížená, zásoba Na+ v ECT relativně ještě více. Dochází k přesunu vody z ECT do ICT. Tím více hrozí klinické a metabolické komplikace popsané v situaci předcházející.
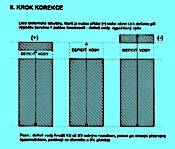

Obr. 2.4 A ukazuje tři možné situace, u nichž je klinický nález dehydratace provázen hypernatrémií. Pokles hmotnosti může být provázen:
a) relativně menším snížením zásoby natria (chybí prostá voda, ale současně i izotonická tekutina), levý sloupec
b) nezměněnou fyziologickou zásobou natria (chybí pouze prostá voda), prostřední sloupec
c) zvýšenou zásobou natria (chybí prostá voda při současném nadbytku natria), pravý sloupec
| deficit H2O (litry) = CTH . F . ( 1 - | 137 |
| ---------- ) | |
| Na+zjištěné |
Jsou tři možnosti vztahu vypočítaného deficitu prosté vody ke zjištěnému úbytku hmotnosti:
a) K úhradě zbývá ještě ta část tekutin, kterou určuje vztah:
chybějící množství izotonických tekutin = hmotnost běžná - (hmotnost aktuální + vypočítaný deficit H2O).
b) Je souhlas:
hmotnost běžná = hmotnost aktuální + vypočítaný deficit H2O.
c) Pomocí zjištěné natrémie vypočítáme takový deficit vody, že její dodání by převýšilo běžnou tělesnou hmotnost:
hmotnost běžná < hmotnost aktuální + vypočítaný deficit H2O.
Proto korekce vyžaduje ještě druhý krok, při němž uvedené rozdíly respektujeme - obr. 2.4 C.
ad a) Je dodáno množství izotonických tekutin chybějící do dosažení běžné hmotnosti.
ad c) Je dodáno jen takové množství, aby nebyla překročena běžná hmotnost.
Deficit vody je hrazen 1/2 až 2/3 solným roztokem, ale čím vyšší je natrémie, tím opatrněji je nutno postupovat. V těch případech jsou i izotonické roztoky z hlediska osmolality vnitřního prostředí hypotonické a poruchu nenásilně korigují. Pouze v případě, kdy po zajištění adekvátní hydratace a dosažení běžné hmotnosti přetrvává hypernatrémie (ad c), se doporučuje podat infúze 5 % glukózy s diuretiky při kontrole natrémie resp. osmolality.
5.1.7 Hyperhydratace s normonatrémií (obr. 2.5)
Korekce: jedině znalost rozdílu mezi běžnou a aktuální hmotností objektivizuje množství tekutin, které je nutno vyloučit. Jinak je třeba se řídit stavem hydratace. Zastavuje se příjem solných roztoků, podávají se diuretika a kardiotonika.
Ve všech případech vzniká přesun vody z ECT do ICT úměrný osmotickému gradientu. Situace vzniká jednak u akutních, jednak u chronických stavů.
U akutních stavů hovoříme o intoxikaci vodou. Kromě vlastního převodnění se jako podpůrné vlivy mohou uplatnit léky s antidiuretickým účinkem a endokrinní vlivy (oxytocin, ADH).
Korekce: zastavení příjmu vody. U symptomatických stavů se určí cílová natrémie a provede výpočet dávky Na+ podle již známé rovnice č. 1. Potřebné dávky Na+ zde budou ovšem zpravidla vyšší. Korekce poruchy za dobu kratší než 12 až 24 hodin je příliš rychlá. Nebezpečí oběhového přetížení je zvýšeno zejména u starých osob a při kardiovaskulárním onemocnění.
U chronických stavů se jedná nejčastěji o edematózní nemocné - buď kardiaky, cirhotiky, pacienty s nefrotickým syndromem nebo v těžké malnutrici.
Korekce: posuzuje se závažnost hyponatrémie, která je asymptomatická do nižších hodnot než u akutních stavů (viz nahoře). Užití hypertonických solí proto prakticky nepřichází v úvahu. Terapie usiluje především o dosažení negativní vodní bilance, forsírované jak snahou o zlepšené prokrvení ledvin, tak diuretiky.
Korekce: je možno vypočítat nadbytek Na+. Výpočet zachytí ovšem jen tu část zvýšení zásoby Na+, která není kryta zvýšením zásoby vody:
(rovnice 5)
Hmotnost je zvýšená. Došlo ke zvýšení zásoby vody i iontů v poměru, v němž jsou fyziologicky v ECT. Nevzniká osmotický gradient mezi ECT a ICT a není důvod k přesunu tekutin mezi těmito prostorami.
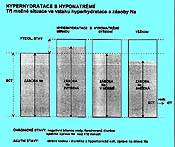 5.1.8 Hyperhydratace s hyponatrémií (obr. 2.6)
5.1.8 Hyperhydratace s hyponatrémií (obr. 2.6)
Podobně jako u dehydratace s hypernatrémií mohou i zde vznikat tři možné situace, u nichž je klinický nález hyperhydratace provázen hyponatrémií. Zvýšení hmotnosti může být provázeno
a) relativně menším zvýšením zásoby Na+ (nadbytek hypotonických tekutin),
b) nezměněnou, fyziologickou zásobou Na+,
c) zmenšením zásoby Na+ (ztráty ECT hrazeny nadbytkem hypotonických tekutin).
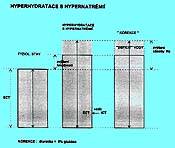 5.1.9 Hyperhydratace s hypernatrémií (obr. 2.7)
5.1.9 Hyperhydratace s hypernatrémií (obr. 2.7)
Hmotnost je zvýšená, zásoba Na+ se zvýšila relativně více než zásoba vody. Dochází k přesunu vody z ICT do ECT.
Tento výpočet slouží jen k orientaci o tíži poruchy, stejně tak jako výpočet "deficitu" vody, kterým lze určit jaký objem vody by bylo třeba dodat, aby se hypernatrémie upravila. Užívá se rovnice č. 3. Vlastní korekce se provádí diuretiky, a protože ztráta vody bude při jejich užití relativně větší než ztráta Na+, hyperosmolalita se koriguje infúzí 5 % glukózy, opět při kontrole natrémie resp. osmolality.
Obsah Na+ v některých solných koncentrátech:
NaCl 10 %, 1 ml = 1,7 mmol Na+ i Cl-,
NaCl 5,8 %, 1 ml = 1 mmol Na+ i Cl-,
NaHCO3 4,2 %, 1 ml = 0,5 mmol Na+ i HCO3-.
plazma 3,8 - 5,4 mmol/l
Celková zásoba cca 3500 mmol, z toho 3150 mmol směnitelných, v ECT je 60 mmol K. Koncentrace intracelulárního K je 10 až 20násobně vyšší než v plazmě. Denní příjem a výdej je 50 až 100 mmol. Draslíkové ionty jsou hlavními kationty intracelulárního prostoru. Jsou nezbytné při tvorbě i rozpadu makroergních fosfátů. K+ se účastní všech fosforylačních dějů v organizmu a proto souvisí s energetikou. Jestliže převládají anabolické děje, zvyšuje se ukládání kalia v buňkách. Naopak při katabolizmu buňky opouští.
Kalémie je závislá na pH. Při acidémii se uvolňuje K+ především z vazby na fosfáty v buňce. Dále se uvolňuje při rozpadu tkáňových bílkovin, na které je vázáno. V alkalémii se naopak více váže na fosfáty a jsou vyšší ztráty močí - směna za Na+. Při acidémii normální S-K+ upozorňuje na depleci K+ v organismu. Při alkalémii normální nebo zvýšené S-K+ svědčí pro hyperkatabolismus. Vztahy mezi pH a kalemií připomíná obr. 2.8.
5.2.1 Hypokalémie
Klinické příznaky: slabost, sklon k paralytickému ileu, renální poruchy - neschopnost koncentrovat moč, zvýšená citlivost myokardu na kardiotonika, nebezpečí arytmií. Nižší T vlny, objevují se U vlny. Terapie spočívá v úpravě primární poruchy a v doplnění draselných iontů.
Výpočty pro korekční a substituční dávky kalia:
1. U pacientů, kde se úspěšně zvládla katabolická situace, není hypoxie a daří se výživa nemocného a upravila se acidobazická rovnováha:
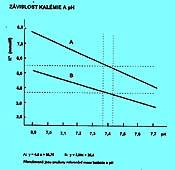 5.2 Kalium
5.2 Kalium
Referenční interval:
moč 45 - 90 mmol/d.
Příčiny:
1) Ze zvýšených ztrát ledvinami. Léčba diuretiky, polyurie, léčba steroidy ve vysokých dávkách. Hypokalémie může vzniknout již během 2 dnů po zahájení této léčby.
2) Ztráta mimorenální. Průjmy, střevní píštěle.
3) Přesun K do buněk. Alkalóza, léčba diabetické acidózy infúzemi glukózy a inzulínem.
kde ECT je objem extracelulární tekutiny v litrech.
Substituční dávky K+ počítáme tak, že násobíme objem moče a event. dalších ztrácených tekutin zjištěnou koncentrací K+ v mmol/l. Jestliže došlo před přijetím do nemocnice k nekontrolovaným ztrátám kalia (diabetická ketoacidóza, diuretická léčba nekrytá kaliem) a jsou-li splněny výše zmíněné podmínky, lze zvýšit korekční dávku o 50 mmol K+, které hradíme v rozpětí 6 až 12 hodin. Podávání kaliových iontů přerušujeme v intervalech asi 2 h., kdy kape infúzní roztok bez kalia. Z jiné žíly odebíráme krev na kontrolní vyšetření kalémie.
2. U pacientů, kde nenastalo rychlé zlepšení stavu, volíme opatrnější postup, který upravuje pouze množství, chybějící v ECT:
Pokud se po této dávce zvýší kalémie na normální hodnoty, jde o nepříznivou situaci, protože K+ nevniká do buněk. Další podávání je nevhodné, pokud nebude upravena energetika nemocného. Většinou se ale kalémie upravit nestačí a v přívodu pokračujeme po novém výpočtu.
3. Oligurie a anurie je kontraindikací podávání kalia. Jen pokud je hypokalémie zjištěná při oligoanurii vzniklé akutně z prerenálních důvodů, lze současně s úpravou hypovolémie podávat roztoky s obsahem K+. Korekce má upravit pouze deficit v ECT:
Nutno hlídat kalémii po obnovení diurézy, nebezpečí poklesu!
Obsah K v některých solných koncentrátech:
7,5 % KCl, 1 ml = 1 mmol K+ a 1 mmol Cl-.
KH2PO4 13,8 %, 1 ml = 1 mmol K+ a 1 mmol P.
Tyto koncentráty se přidávají do infúzních roztoků cukrů v takovém množství, aby v nich maximální koncentrace K+ nepřekročila 40 mmol/l. Maximální hodinová dávka K+ smí být 20 mmol, maximální celková denní dávka K+ má být 150 mmol, ale dává se i více, dokonce až 600 mmol (pod kontrolou laboratorní i EKG).
5.2.2 Hyperkalémie
Klinické příznaky: bradykardie, arytmie až fibrilace komor se zástavou v diastole při kalémii 10 až 11 mmol/l. Snížení citlivosti myokardu na digitalis. Na EKG hrotnaté T a rozšířené P vlny. Prodloužení intervalu PQ, rozšíření QRS a deprese ST úseku.
Příčiny:
1. Vázne vylučování ledvinami: při akutní renální insuficienci, léčbě antagonisty aldosteronu (Spirolakton, Amilorid, Triamteren), nedostatku mineralokortikoidů (M. Addison).
2. Uvolnění K z buněk: katabolismus, acidóza, rozpad tkání, hemolýza in vivo i in vitro (únik K z erytrocytů), trauma.
3. Nadměrný přívod: infúze s obsahem solí kalia, transfúze staré krve.
(10-20 ml dospělí) | ||||
1j./g glukózy | ||||
(p.o., p.r., sonda) 50-100g dospělí | ||||
5.3 Magnezium
sérum 0,7 - 0,9 mmol/l
V těle je celkem 600 až 1150 mmol hořčíku. Z toho je asi 53 % v kostech, v příčně pruhovaném svalstvu a dalších měkkých tkáních je 46 %. V ECT je jen 1 %, z toho 0,5 % v erytrocytech a 0,3 % v plazmě, takže podobně jako S-K, ani S-Mg neodráží stav zásob v těle. Asi 33 % plazmatického Mg je vázáno na bílkoviny, 5 - 12 % je v komplexech s jinými ionty (citráty, fosfáty) a zbytek, 55 - 60 % je volný, fyziologicky aktivní Mg2+. V poslední době (od r. 1993) je možno v závislosti na technickém vybavení laboratoře vyšetřovat Mg2+ místo celkového Mg. Protože informace o koncentraci Mg2+ je blíže jeho biologické aktivitě, je tomuto vyšetření třeba dávat přednost.
Význam hořčíku vychází ze skutečnosti, že Mg2+ je po K+ druhým nejzastoupenějším intracelulárním kationtem. Je kofaktorem více než 300 enzymových reakcí. Mezi reakce zajišťované Mg2+ patří např. funkce Na+-K+ ATPázové pumpy. Proto buňka s nedostatkem Mg2+ nemůže doplnit chybějící K+ ani při jeho dostatečném přívodu. Další funkcí je zajištění činnosti ATPázové pumpy, bránící vstupu Ca2+ do buněk. Při depleci Mg2+ vstupují Ca2+ do buněk. V případě buněk hladkého a příčně pruhovaného svalstva stoupá jejich tonus, je sklon k hypertenzi a křečím. Mg2+ se také účastní reakcí s užitím ATP pro syntetické procesy, pro funkci myokardu a svalové kontrakce, neuromuskulární převod a uvolňování hormonů. Mg2+ má funkce antiarytmické, vasomotorické, snižuje excitabilitu myokardu a zlepšuje průtok koronárními arteriemi.
5.3.1 Hypomagnezémie
Klinické příznaky se manifestují obvykle při poklesu celkového S-Mg pod 0,5 mmol/l. Kardiovaskulární příznaky: arytmie, hypertenze, toxicita digitalis. Metabolické příznaky: hypokalémie, stoupá kaliuréza (pokles aktivity Na+-K+ ATPázové pumpy), hypokalcémie, hypofosfatémie, hyponatrémie. Psychické příznaky: deprese, agitovanost. Neurologické příznaky: příznaky zvýšené neurosvalové dráždivosti, pozitivní Trousseau, Chvostek, fascikulace svalové, spazmy, tetanie ale i slabost, ataxie, až psychotické chování.
Terapeuticky se při křečích podává až 16 mmol MgSO4.7 H2O během 10 minut. Další suplementace je pomalejší, 10 až 20 mmol/d i.v. nebo i.m. po dobu 1 až 3 týdnů při terapii chronické deplece. Potom se přechází na dávky udržovací 0,05 až 0,1 mmol/kg.d-1.
Obsah Mg v některých solných koncentrátech:
5.3.2 Hypermagnezémie
Klinické příznaky: nauzea, zvracení, zarudlá, teplá kůže, hypotenze, bradykardie, letargie (při zvýšení S-Mg na 1,5 až 2,5 mmol/l), skleslost, svalová slabost, dechová deprese, snížené reflexy, prodloužení QT (při zvýšení S-Mg na 2,5 až 5 mmol/l), kóma, zástava srdce v diastole, zástava respirace ( při S-Mg nad 5 mmol/l). Dále je popisováno snížení tvorby trombinu a adhezivity destiček.
Terapie spočívá v úpravě acidózy, úhradě ev. deficitu náplně cévního systému a v zastavení přívodu Mg2+. Pomalu se podá i.v. 2,5 až 5 mmol kalcia formou CaCl2 nebo Ca-gluconium (bližší o těchto roztocích viz u hypokalcémie), někdy je indikována hemodialýza nebo peritoneální dialýza.
5.4 Kalcium
sérum 2,23 - 2,63 mmol/l
Horní hranice odpadu vápníku močí lze též určit výpočtem ve vztahu k hmotnosti pacienta:
Celková zásoba vápníku v těle je 30 mol (1200 g), z toho 75 % je uloženo v kostech. V séru je 40 až 45 % vápníku vázáno na bílkoviny, 50 % ionizováno, 5 až 10 % v komplexu s kyselinami. Pro myokard a neuromuskulární dráždivost má význam hlavně ionizované Ca. Pokles koncentrace má za následek vyšší dráždivost, zároveň snížení síly svalové kontrakce.
5.4.1 Hypokalcémie
Klinické příznaky: parestézie, pozitivní Chvostek a Trousseau, dušnost, abdominální koliky, křeče, zmatenost, podrážděnost. Při hodnocení hypokalcémie je vždy nutno posuzovat současně 3 parametry: pH, Ca, celkovou bílkovinu. Např. normální celkové Ca, při alkalóze a vysoké celkové bílkovině mohou být křeče, protože Ca2+ je nízké.
Terapie spočívá v infuzích CaCl2.6 H2O 10 % každých 12 nebo i 6 hodin po převodech. Při parenterální výživě jsou doporučovány udržovací denní dávky po 0,1
mmol/kg. V praxi se však často nedávají, počítá se s trvalým uvolňováním kalcia z kostí u ležících pacientů.
Obsah Ca2+ v některých solných koncentrátech:
5.4.2 Hyperkalcémie
Klinické příznaky: slabost, letargie, únava, zmatenost, snížení neuromuskulární dráždivosti, nechutenství, zvracení, na EKG zkrácení QT, zvýšená citlivost na digitalisové preparáty. Při Ca vyšším než 4 mmol/l se objevuje hyperkalcemická krize, zmatenost, bezvědomí, zástava srdce v systole.
Terapie: zavodnit, podat diuretika, alkalizace, nitrožilně roztoky fosfátů (vazba s Ca), steroidy (působí přesun Ca do buněk), tyreokalcitonin.
5.5 Fosfor
sérum 0,7 - 1,5 mmol/l
Celková zásoba fosforu v těle je 19 až 26 mol (600 až 800 g), z toho 80 % je v kostech a zubech, 9 % ve svalech.
5.5.1 Hypofosfatémie
Klinické příznaky: slabost svalová na končetinách, poruchy artikulace, žvýkacích svalů, anizokorie, anorexie, hyperventilace, z deficitu ATP se tvoří sférocyty, zkrácené přežívání erytrocytů a trombocytů. Chemotaxe leukocytů a jejich fagocytární vlastnosti jsou rovněž zhoršeny. Klinické příznaky se začínají objevovat při poklesu sérové koncentrace pod 0,3 mmol/l a jsou vždy přítomny při poklesu pod 0,16 mmol/l.
Terapeuticky se podává 30 až 40 mmol P parenterálně po 3 dny, pak se sníží dávky na 20 až 25 mmol denně a končí se udržovací dávkou 10 až 15 mmol/d.
KH2PO4 13.6 % 1 ml = 1 mmol K+ i P,
5.5.2 Hyperfosfatémie
6. Celková bílkovina (CB) a albumin
sérum CB 60 - 80 g
Celková zásoba albuminu v organismu je 4 - 5 g/kg, tj. u dospělého celkem 280 až 350 g. Z toho je za fyziologických okolností asi 40% v cévním řečišti a 60% je uloženo extravazálně, převážně v kůži. Při chronických malnutricích se extravazálně uložený podíl přesunuje do oběhu. Při akutních stavech bývá pohyb opačný - viz dále. Význam albuminu spočívá v udržování koloidně osmotického, tj. onkotického tlaku, který zajišťuje návrat tekutiny do kapiláry na venózním konci. Únik albuminu do intersticia je součástí odpovědi organismu na trauma.
Další úloha albuminu spočívá v transportu metabolických produktů, iontů, hormonů a léků. Zvláštní pozornost si zaslouží farmakokinetika léčiv vázaných na albumin. Změny se uplatňují při snížení albuminémie pod 30 g/l, které je u hypermetabolických nemocných časté. Terapeutická odpověď je při hypoalbuminémii buď rychlejší nebo silnější než obvykle, ale kratší. Příznaky intoxikace léky jsou častější, protože je snadno překročená vazebná kapacita pro ně. Např. žaludeční vředy, jako vedlejší příznaky dlouhodobé léčby steroidy, jsou při hypoalbuminémii 2 až 3x častější. Buzení nemocného po thiopentalu je u nemocného s hypoalbuminémií výrazně prodlouženo.
Na akutně vzniklé hypoalbuminémii u hypermetabolických nemocných se podílí trojí vliv: pokles syntézy, zvýšení katabolismu a přesun do intersticia.
U chronicky vyvinuté hypoalbuminémie může být deficit 150 až 200 g. Pokud je při ní albumin pod 30 g/l, jde vždy o pokles syntézy. Hodnoty koncentrace CB a albuminu jsou u pacientů, kteří byli léčeni plazmaexpandery, sníženy. Plazmaexpandery zvyšují koloidně osmotický tlak plazmy a to vede k přesunu části tekutin z IST do oběhu. Díky naředění se koncentrace CB i albuminu výrazně sníží. Tím ztrácejí tyto parametry význam z hlediska informace o koloidně osmotickém tlaku.
K přímému měření koloidně osmotického tlaku se používá onkometr. Referenční hodnoty koloidně osmotického tlaku vestoje jsou 3,33 až 3,52 kPa, vleže po 12 hod. okolo 3,0 kPa. Výpočet z celkové bílkoviny nebo z albuminu a globulinů je u hypermetabolických, intenzívně léčených nemocných nespolehlivý. Znalost koloidně osmotického tlaku má prognostický význam quoad vitam u kritických stavů a při predikci plicního edému. Sledování koncentrace sérových bílkovin má význam u stavů malnutrice, kde různé bílkoviny mají různou výpovědní hodnotu s ohledem na své poločasy. U albuminu je to 20 dní, u transferinu 7,5 dne, u prealbuminu 1,9 dne.
Terapie albuminem: v akutních stavech je 50 až 80 % infundovaného albuminu ztráceno katabolismem. Z těchto důvodů, nejen z finančních, je snaha omezit jeho podávání u akutních stavů jen pro zabránění poklesu koncentrace albuminu v séru pod 25 až 30 g/l.
7. Urea v moči
Široký rozsah je dán závislostí na příjmu bílkovin a na tělesné aktivitě. Vylučování močoviny je mírou katabolismu bílkovin a v hypermetabolických stavech i rychlostí glukoneogeneze. Stanovení urey v moči umožňuje hodnotit ztráty celkového dusíku močí a tím i dusíkovou bilanci.
Postup:
Příklad:
Odhad ztrát bílkovin (svaloviny):
Pro úplnost by na tomto místě bylo ještě vhodné zařadit informaci o chloridech a laktátu. Protože ale obojí je součástí kapitoly 3 "Poruchy acidobazické regulace", odkazujeme čtenáře na tuto část.
Doporučená literatura:
Referenční interval:
moč 1,2 - 12 mmol/d
ionizované Mg sérum 0,45 - 0,62 mmol/l
Příčiny:
1. Snížený příjem při stravování předem připravenými jídly a "fast food", snížený příjem parenterální výživou (p.v.).
2. Snížená absorpce: alkoholismus, zvracení, průjmy a laxativa, malabsorpční syndrom, pankreatitis, stavy po resekci tenkého střeva.
3. Zvýšené vylučování: enterální onemocnění, endokrinopatie (hyperparatyreóza, hyperaldosteronismus, hypertyreóza, diabetes mellitus), antibiotika, digitalis.
4. Různé: gravidita, laktace, pooperačně, Bartterův sd.
MgSO4.7 H2O 10 %, 1 ml = 0,4 mmol Mg2+,
MgCl2.6 H2O 10 %, 1 ml = 0,5 mmol Mg2+ a 1 mmol Cl-
Příčiny:
1. Akutní i chronické renální selhání.
2. Endokrinní - hypotyreóza, m. Addison, nedostatek STH.
3. Zvýšený příjem léků - antacida, projímadla, sole Mg při léčbě eklampsie (ohrožení i novorozenců), léčba srdečních arytmií a dialyzační tekutiny s Mg.
4. Různé - traumata se zhmožděním svalstva, dehydratace, metastázy tumorů, metastázy do kostí, mnohočetný myelom, acidémie.
Referenční interval:
moč 2,5 - 7,5 mmol/d
ionizované kalcium - sérum 1,0 - 1,4 mmol/l
dU-Ca (mmol/24 h) = kg x 0,1
(tedy např. pro osobu o hmotnosti 70 kg to je 7 Ca mmol/d).
Příčiny:
1. Snížení celkového Ca bývá u nekrotizující pankreatitidy, hypoparatyreózy, renální insuficience, hypomagnezémie, poklesu proteinémie, osteomalacie, deficitu D vitaminu, osteoblastických tumorů.
2. Pokles Ca2+ nastává u alkalózy i po masivních transfúzích, kdy citrát váže Ca2+. Pokles Ca2+ nemusí být provázen poklesem celkového Ca.
CaCl2. 6 H2O 10 %, 1 ml = 0,5 mmol Ca2+ a 1,0 mmol Cl-,
Ca-gluconicum . H2O 10% 1 ml = 0.25 mmol Ca2+
Příčiny:
hyperparatyreóza, hypervitaminóza D, metastázy tumorů do kostí, hyperproteinémie, při terapii antacidy obsahujícími CaCO3.
Referenční interval:
moč 16 - 48 mmol/d
Příčiny: MAL a RAL stimulují glykolýzu, což iniciuje přesun P do buněk, kde je zvýšená fosforylace. Chronická léčba antacidy (váží P), malabsorpce, hyperparatyreóza, deficit vitaminu D, Fanconiho syndrom, vrozené renální tubulární poruchy, zvýšená clearance fosfátů. U dlouhodobé metabolické acidózy, při rozpadu buněčných struktur se uvolní fosfáty a při korekci a úpravě energetické situace vzniká rovněž hypofosfatémie. K další příčinám patří alkoholismus a také parenterální výživa, není-li dostatečná úhrada P. Při hypofosfatémii je nalézán pokles 2,3-bisfosfoglycerátu v erytrocytech, čímž dochází i k posunu disociační křivky O2 doleva, tedy ke zhoršenému uvolňování kyslíku ve tkáních.
Na2HPO4 . 12 H2O 10 % 1 ml = 0,6 mmol Na+ a 0,3 mmol P
Příčiny: oligurické renální selhání, chronická renální insuficience, hojení rozsáhlých fraktur, akromegalie, hypoparatyreóza, předávkování vitaminem D.
Referenční meze:
albumin 32 - 45 g/l
Referenční meze dU: 67 - 580 mmol/d
odhad g N/den = urea mmol/d . 0,0336
Faktor 0,0336 vzniká součinem hodnoty 0,028 (tj. přepočtu mmol urey na g N urey) a hodnoty 1,2 (tj. přepočtu ztráty celkového N za předpokladu, že N urey tvoří přibližně 84 % celkového N v moči).
Ztráty dusíku:
diuréza změřená = 2,5 l moči/den
stanovená koncentrace močoviny ve vzorku sbírané moči = 320 mmol/l
vyloučené množství urey = 800 mmol/d (320x2,5)
odhad ztrát dusíku za den = 800 x 0,0336 = 26,88 g N/d
Na každý gram N bylo katabolizováno 6,25 g bílkovin (bílkoviny obsahují asi 16 hmotn.% dusíku) a toto množství odpovídá přibližně 25 g svalové tkáně. V našem příkladu je tedy ekvivalent ztracené svalové tkáně: 26,88 x 25 = 672 g. Nemocný neztrácí ovšem zejména zpočátku jen svalovou tkáň, ale na ztrátě se podílejí i bílkoviny s krátkým poločasem, které tvoří enzymovou výbavu zažívacího traktu a jater.
Kazda A., Jabor A.: Natrémie - hodnocení nálezů v klinické praxi. Bioch. clin. bohemoslov., 19, 1990, č. 1, s. 11-22
Kazda A., Růžičková J., Zítko K., Hendl J.: Podíl dusíku močoviny na celkové ztrátě dusíku močí u nemocných v resuscitační péči. FONS, prosinec 1993, s. 14-16
Kazda A.: Význam sledování celkového a ionizovaného magnézia v klinické praxi. Klin. bioch. a metab., 2, 1994, č. 4, s. 217-221
Kazda A.: Metabolická odpověď na trauma. Kapitola II. dílu skript: Vybrané kapitoly z problematiky biochemického sledování v intenzivní péči. Editor: A. Jabor, STAPRO Pardubice 1990, s. 23-55
Kazda A., Balík M.: Osmolální dysbalance v intenzivní péči a jejich monitorování. Klin. bioch. a metab., 4, 1996, č. 4, s.223-227
Kazda A., Drábková J., Jabor A.: Požadavky na rozsah a frekvenci laboratorního vyšetřování nemocných v intenzivní péči. Účelová publikace Biochem. monitorování pacientů v intenzivní péči. TECOM, Praha, 1996, s. 18-26
Anděl M., Brodanová M.: Infúzní terapie, parenterální a enterální výživa. Grada, Praha, 1994, s. 148-163
Dzúrik R. a kol.: Štandardná klinicko-biochemická diagnostika. Osveta, Martin, 1996, s. 183-207
Kazda A.: Biochemické monitorování nemocných v intenzivní a resuscitační péči. Avicenum, Praha, 1986, s. 17-40
Nejedlý B.: Vnitřní prostředí - klinická biochemie a praxe. Avicenum, Praha, 1980, s. 15-114