Klinicko-diagnostický proces v oblasti zažívacího ústrojí je založen na řadě specializovaných vyšetření, ke kterým patří zejména moderní zobrazovací metody (endoskopie, sonografie, RTG, CT, NMR) poskytující morfologický obraz orgánů. Nedílnou součást diagnostiky však přesto tvoří metody biochemické. Přínos biochemických testů pro klinicko-diagnostický proces je především v oblasti funkčních testů, screeningových programů a sledování dynamiky procesů v průběhu léčby resp. dlouhodobého sledování nemocného (follow-up).
Základní funkcí trávicího ústrojí je příjem a zpracování potravy procesem trávení (digesce) a vstřebávání (absorpce) jednotlivých složek potravy. Trávicí proces je možno rozdělit do tří fází.
Orální fáze začíná v dutině ústní kde již probíhá první fáze štěpení škrobů slinnou a-amylázou.
Gastrická fáze probíhá v žaludku a zahrnuje sekreci žaludeční šťávy, HCl, žaludečních proteináz (pepsiny) a štěpení bílkovin.
Enterální fáze začíná v duodenu alkalizací kyselého žaludečního obsahu hydrogen karbonátem pankreatické šťávy, sekrecí pankreatických enzymů, které vedou k hydrolýze peptidů (trypsin, chymotrypsin, elastáza, karboxypeptidázy), škrobů (a -amyláza) i tuků (lipáza). K další hydrolýze a vstřebávání dochází pomocí enzymů kartáčového lemu enterocytu (disacharidázy, dipeptidázy, aminopeptidázy...).
2. Kategorizace metodik a testů
2.1 Anatomická kategorizace
2.1.2 Pankreas
2.1.3 Tenké střevo
2.1.4 Tlusté střevo
2.2 Klinicko-diagnostická kategorizace
2.3 Laboratorně-metodická kategorizace
3. Rutinní stanovení v séru a moči
Stanovovat lze jednak koncentraci imunologickými technikami (tj. stanovení koncentrace proteinu) nebo enzymovou, katalytickou koncentraci pomocí specifických substrátů. Při stanovení jak hmotnostní, tak katalytické koncentrace enzymu je nutno zvažovat přítomnost inhibitorů v séru a vznik makroforem enzymů. Běžně používané stanovení aktivity a-amylázy je založeno na štěpení chromogenního substrátu. Starší postupy, které používaly deriváty přirozeného substrátu-škrobu, byly obtížně standardizovatelné a již se nepoužívají. Současné syntetické substráty jsou odvozeny od maltózy, jako chromogen je nejčastěji používán 4-nitrofenylfosfát. Stanovení isoenzymů a-amylázy je umožněno inhibicí jednoho z obou isoenzymů specifickou monoklonální protilátkou.
Makroamyláza je příčinou asi 8-12% případů hyperamylazémie. Pro detekci makroamylázy je nutno použít gelové filtrace nebo jiné separační techniky k oddělení vysokomolekulární a nízkomolekulární formy enzymu, např.elektroforézy. K diagnostice lze použít indexu amylázy a kreatininu.
Klinický význam. Zvýšená hladina celkové aktivity a-amylázy je prokazatelná u celé řady onemocnění. Nejčastějším diagnostickým důvodem je dg. akutní pankreatitidy. Hladina celkové a-amylázy je sice zvýšena ve 100% onemocnění akutní pankreatitidou, zvýšena je však i v 80% všech případů akutních bolestí břicha. Podstatně větší diagnostický přínos má stanovení pankreatického izoenzymu (P-amylázy), jehož hladina je rovněž zvýšena ve 100% případů akutní pankreatitidy, u akutních bolestí břicha je zvýšena jen v 10%. V běžné klinické praxi se používá kriteria 5-násobného zvýšení celkové amylázy, které je dg.indikátorem akutní pankreatitidy. Zvýšená sérová hladina je samozřejmě prokazatelná u akutních i chronických onemocnění ledvin, u střevních zánětů ve 30% případů akutní apendicitidy. Zvýšení hladiny a-amylázy v moči u akutní pankreatitidy přetrvává déle a nastupuje později, než zvýšení hladiny v séru. Slinný typ a-amylázy (S-amyláza) je zvýšen u onemocnění slinných žlaz, u některých plicních chorob, u řady maligních tumorů, ovariální cysty, mimoděložního těhotenství. Normální hodnoty poměru clearance amylázy a kreatininu jsou mezi 2-4%, při pankreatitidě stoupá index na 10%. Zvýšený index clearance amylázy-kreatininu byl prokázán např. u diabetické ketoacidózy, popáleninách, myelomu a u ledvinných poruch. Snížení indexu clearance je diagnosticky významné pro makroamylázemii.
3.1.2 Lipáza
Stanovení aktivity lipázy zahrnuje různé postupy - enzymové štěpení přirozeného substrátu, chromogenních a fluorogenních substrátů a metody imunologické (ELISA, latex-aglutinační). Nejčastěji se používá nefelometrických a turbidimetrických postupů postupů založených na štěpení přirozeného substrátu triacylglycerolu, většina souprav pro enzymové stanovení lipázy obsahuje i ko-lipázu. Turbidimetrické stanovení aktivity lipázy je založeno na vyčeření olejové emulse působením lipolytické aktivity. Tento proces však může být ovlivněn i dalšími složkami séra např. tzv. vyčeřovacím faktorem - pseudolipázou. Nejčastěji se jedná o cirkulující imunokomplexy typu IgM. Pro diferenciální stanovení sérové pankreatické lipázy vedle pseudolipázy s použitím standardního turbidimetrického postupu je vypracován postup založený na inaktivaci pseudoplipázy ß merkaptoetanolem, který vede k disociaci IgM komplexů. Novější chromogenní testy jsou založeny na enzymové kaskádě lipázy štěpící 1,2-diacylglycerol, glycerol-kináze, glycerol-3-fosfátoxidáze a peroxidáze s chromogenním produktem. Zcela nový typ techniky stanovení pankreatické lipázy je založen na změně vodivosti roztoku uvolněním mastných kyselin ze substrátu-trioleinu; detekována je akustickým snímačem a měřenou veličinou je frekvenční odpověď.
Makrolipáza (makroforma enzymu) byla prokázána u 2 ze 20 pankreatitid se zvýšenou hodnotou lipázy a tvořila 10-18% celkové aktivity. Poprvé byla popsána v roce 1987 u non-Hodgkin lymfomu, kdy katalytická aktivita lipázy byla zvýšena v séru 7x.
Klinický význam. Stanovení lipázy je diagnosticky využíváno podstatně méně než stanovení a-amylázy. Důvodem jsou především technické problémy, které stanovení lipázy donedávna přinášelo. Z těchto důvodů vznikla celá řada velmi odlišných metodik k stanovení lipázy, jejichž výsledky lze velmi obtížně vzájemně porovnávat a standardizovat např. referenční meze. Diagnostický přínos stanovení sérové hladiny pankreatické lipázy je však podstatně vyšší než stanovení a -amylázy. Hladina lipázy v séru zůstává po atace akutní pankreatitidy zvýšena podstatně déle než hladina amylázy (popsána je zvýšená aktivita lipázy po 14 dnech). Vzhledem k tomu, že lipáza v séru má svůj původ především v buňkách pankreatu, poskytuje její stanovení podstatně vyšší specificitu, srovatelnou se specificitou pankreatického isoenzymu a-amylázy. V moči je lipáza běžnými posupy nedetegovatelná a nestanovuje se, makroforma existuje u lipázy také, diagnosticky se však opět toto stanovení nepoužívá. Vzhledem k vysoké specificitě je pro praxi, především v oblasti akutní medicíny, navržen imunologický průkaz lipázy jednoduchým latexovým testem.
3.1.3 Další pankreatické enzymy
Elastáza-1
3.2 Tumorové markery
Karcinoembryonální antigen (CEA), a1-fetoprotein (AFP), kyselý a1-glykoprotein, pankreatickou elastázu-1, sacharidové antigeny CA 19-9, CA 50, CA 72-4 a CA 242. Z hlediska orgánové lokalizace má pro karcinom žaludku nejvyšší pozitivitu CA 72-4, pro kolorektální karcinom CEA a CA 242, a pro karcinom pankreatu CA 19-9 a CA 242. Stanovení více tumorových markerů paralelně zvyšuje specificitu vyšetření, snižuje však jeho senzitivitu.
3.3 Jiné testy
Hladinu gastrinu v séru stanovujeme většinou RIA metodou, existují i ELISA varianty imunochemického průkazu. Normální hodnoty 66±2 ng/l jsou výrazně zvýšeny především u Zollinger-Ellisonova syndromu (gastrinom, tumor pankreatu s nadprodukcí gastrinu), kdy prokazujeme 10-1000 násobné zvýšení hladiny gastrinu, která však výrazně kolísá i v průběhu dne; u 20-40% lze zachytit i normální hladinu gastrinu. Vzhledem k existenci tří forem gastrinu závisí výsledek stanovení na typu protilátky použité v testu. Metody stanovení gastrinu jsou standardizovány na syntetický gastrin G-17, stanovení forem G-34 a G-13 závisí na zkřížené reaktivitě s příslušnou protilátkou. Normální poměr forem G-13:G-17:G-34 je 8:2:1, na lačno je vyšší zastoupení formy G-34, po jídle forem G-17 a G-13.
3.3.2 Pepsin, pepsinogen
4. Funkční testy
4.1 Vyšetření funkce žaludku
Provedení testu. Pacient přichází na lačno a je mu zavedena žaludeční sonda, jejíž pozici je nutno ověřit skiaskopií. Pomocí odsávačky je odčerpáván žaludeční obsah a jednotlivé porce jsou sbírány po 15 minutách, celkem 2 hodiny. Nejprve je odebrána veškerá žaludeční šťáva na lačno - porce T0 a pak následuje sběr nestimulované, basální sekrece T60 4 x 15 minut. Po 1 hodině testu je provedena stimulace 6 µg pentagastrinu/kg váhy subkutánně (histamin podáváme jako 1% roztok v dávce 0.1 ml/10kg váhy, insulin podáváme i.v. 10-20 IU NI). Následuje odběr dalších 4 porcí po 15 minutách - stimulovaná sekrece T120.
Analýza žaludečního obsahu a stanovení koncentrace HCl. Ve všech porcích změříme pH, objem porce a titračně stanovíme koncentraci HCl. Titrujeme 10 ml (minimálně 5 ml) žaludeční šťávy pomocí 0.1 mol/l NaOH v přítomnosti barevného pH-indikátoru (např. diethylaminoazobenzen). V každé frakci stanovujeme koncentraci HCl, vypočítáme celkový výdej HCl a sekreční rychlost mmol HCl/hodinu. Indexy používané v diagnostice jsou označeny BAO (Basal acid output), stanoven z basální frakce T60 před stimulací; PAO (Peak acid output) stanovený průměrem ze dvou frakcí s nejvyšší koncentrací HCl a MAO (Maximum acid output) jako výsledek hodinové stimulované sekrece T120. Při insulinovém testu se stanovuje i koncentrace pepsinu jako BPO (Basal pepsin output) a MPO (Maximal pepsin output).
Referenční hodnoty testu s pentagastrinem: BAO 1-5 mmol HCl/hod, MAO 10-23 mmol HCl/hod, PAO 8-40 mmol HCl/hod. Hodnoty u mužů jsou vyšší než u žen (PAO u mužů je 11-40, u žen 8-33 mmol HCl/hod). Po stimulaci histaminem hodnotíme celkový objem žaludeční štávy, normální hodnoty jsou 150-250 ml/2 hod a celková acidita 72-80 mmol HCl/l. Hodnoty insulinového testu jsou u mužů BPO 32 ± 29 mg/hod, MPO 320±170 mg/hod; u žen BPO 60±81 mg/hod, MPO 170 ± 150 mg/hod.
Klinický význam. Hypochlorhydrie (hypoacidita) až achlorhydrie (anacidita) je signifikantním příznakem perniciózní anemie, podezření na malignity (karcinom žaludku vykazuje však v časných stádiích hyperaciditu i normoaciditu). Dg.významné je stanovení žaludeční acidity při Zollinger-Ellisonově syndromu, kdy prokazujeme vysokou bazální i maximální sekreci (BAO>15, MAO>60), ve více než 50% případů Zollinger-Ellisonova syndromu je index BAO/MAO > 0.60.
4.2 Vyšetření exokrinní funkce pankreatu
4.2.1 Sekretinový přímý funkční test
Provedení testu. Pacient přichází nalačno a je odebrán vzorek séra. Pod RTG kontrolou je zavedena nejprve žaludeční sonda (slouží k odčerpávání žaludečního šťávy a zamezení kontaminace duodenálního obsahu) a poté druhá sonda do duodena. Přítomnost žluče v aspirátu a alkalické pH je rovněž kontrolou správného zavedení. Po odčerpání 1.frakce (lačný vzorek pro stanovení basálních hodnot) je podána i.v. stimulace cholecystokininem (nejčastěji 1 IU/kg váhy i.v.) a je proveden odběr duodenální šťávy - 20 minut. Následuje stimulace sekretinem (nejčastěji se podává 1 IU/kg váhy) a odčerpání dalších 3 frakcí po 20 minutách. Laboratorní zpracování zahrnuje změření objemu, stanovení pH, podle barevné škály zhodnocení tzv. ikterického indexu, stanovení koncentrace HCO3-, a aktivity pankreatických enzymů a-amylázy, lipázy a trypsinu běžnými enzymovými metodami.
Hodnocení a klinický význam. Sekretin-CCK test poskytuje ze všech dostupných testů nejpřesnější informace o sekrečních poměrech pankreatu. Přes nestandardnost jeho uspořádání je považován za "zlatý standard" funkčních testů pankreatu ke zhodnocení především pankreatické insuficience. Normální hodnoty závisí na způsobu stimulace, odběru i analýze duodenálního obsahu. Uvedené hodnoty jsou jednou z variant. Objem sekrece stimulované sekretinem 165-536 ml/hod, koncentrace HCO3- 9.8-39.7 mmol/hod, aktivita trypsinu 9.3-171 j/20 minut, aktivita amylázy 34-204 j/20 minut.
4.2.2 Nepřímé funkční testy
Provedení testu. Pacient přichází nalačno a je odebrán vzorek séra a moče. Následuje podání substrátu (Ac-Tyr-PAB ve 4 tabletách) a stimulační pokrm (modifikace Lundhovy snídaně - hydrolyzát kaseinu s olivovým olejem). Po dobu 6 hodinového sběru moče pacienta saturujeme tekutinami (minimálně 3x250 ml čaje). Po 3 hodinách se odebere další vzorek krve, po 6 hodinách poslední porce moče, změří se celkový objem moče za 6 hodin a pro analýzu se vezme vzorek cca 10ml moče. Laboratorní zpracování zahrnuje změření objemu moče za 6 hodin a stanovení koncentrace HPAB ve vzorcích séra a moče po hydrolýze. HPAB se stanovuje diazotační reakcí podle Bratton-Marshala s fotometrickým měřením.
Klinický význam. Nepřímé funkční testy mají význam jako screeningové testy k průkazu pankreatické insuficience. Normální hodnoty výdeje močí za 6 hodin > 30.7% podaného množství pankreatickou nedostatečnost vylučují. Pomocnou hodnotou je hladina v séru ve 3.hodině testu s hranicí normálních hodnot > 25 µmol/l. Pankreatickou insuficienci lze vyloučit i při sníženém výdeji močí za 6 hodin tj. < 30.7% je-li prokázána normální hladina v séru. PABA test (ALTAB-test) se také s výhodou používá pro stanovení účinnosti pankreatické substituce enzymovými preparáty (např. Pankreolan, Panzynorm, Panpur, Kreon aj.). Při interpretaci výsledků PABA testu je nutno zvažovat komplexně možnosti falešně snížených hodnot v důsledku porušené funkce dalších orgánů, které se na výsledku testu uplatňují. Falešně pozitivní výsledeky jsme prokazovali při podání tablet s nižším obsahem substrátu (např. v důsledku přítomnosti racemátu tj. D,L-formy tyrosinu). Vzhledem k obtížím při interpretaci výsledků PABA-testu a relativně vysokému počtu falešně pozitivních výsledků již byla popsána celá řada modifikací. Jedná se především o stanovení tzv. PABA-indexu, stanovení PABA spolu s dalším markerem např. PAS nebo radioizotopu 14C ze značeného substrátu.
4.2.3 Chymotrypsin a elastáza-1 ve stolici
Stanovení chymotrypsinu (CHT) ve stolici. Pacient odebere vzorek stolice do specielní odběrové nádobky se stabilizujícím reagens a detergentem (pro CHT), který je předán do laboratoře. Laboratorní stanovení chymotrypsinu je založeno na jednoduché reakci s chromogenním substrátem, Suc-Ala-Ala-Pro-Phe-pNA. Chymotrypsin katalyzuje hydrolýzu a uvolnění barevného 4-nitroanilinu, který je stanoven fotometricky při 405 nm. Referenční hodnoty jsou > 140 nkat/g, hraniční pásmo je v rozmezí 70-140 nkat/g, patologické hodnoty < 70 nkat/g (hodnoty jsou pro stanovení při 30°C). Souprava byla donedávna vyráběna firmou Boehringer, v současné době není dostupná.
Stanovení elastázy-1 (EL-1) ve stolici je založeno na imunologickém průkazu ELISA metodou s monoklonální protilátkou k lidské, pankreatické elastáze. Vzorek stolice je v laboratoři homogenizován v extrakčním nárazníkovém roztoku a po ředění 1:500 dále zpracován běžným ELISA postupem na mikrotitrační destičce s detekcí pomocí POD-streptavidin. Souprava obsahuje 5 kalibračních standardů v rozmezí 0.3-10.0 ng/ml. Referenční hodnoty jsou 200-500 µg/g stolice, hraniční pásmo je 100-200 µg/g, závažná pankreatická insuficience je stanovena při hodnotách < 100µg/g stolice. Imunochemické stanovení elastázy-1 není ovlivněno pasáží tlustým střevem, substituční terapií ani jinými faktory, které ovlivňují enzymové stanovení chymotrypsinu ve stolici.
4.3 Vyšetření funkce tenkého střeva
4.3.1 Beta-karoten
Stanovení ß-karotenu se provádí pomocí HPLC nebo extrakční metodou (vytřepání do petroléteru/chloroformu, nebo jiných organických rozpouštědel) se spektrofotometrickým měřením. Referenční hodnoty závisí na postupu stanovení, běžně je uváděno rozmezí pro extrakční metodu tj.stanovení celkových sérových karotenoidů, 0.90-4.60 µmol/l, užší pásmo referenčních hodnot je 1.12-3.72 µmol/L. Pro screening malabsorpčního syndromu u dospělých se uvádí pouze dolní hranice 0.93 µmol/l.Přestože extrakční metodika stanovuje celkové karotenoidy, hodnoty jsou uváděny jako ß-karoten. Pro HPLC techniku specificky stanovující pouze ß-karotén je popsáno referenční pásmo 0.37-74 µmol/l. Hladina ß-karotenu není signifikantně rozdílná v závislosti na pohlaví, u mužů jsou však hodnoty nižší než u žen.
Klinický význam má stanovení ß-karotenu především jako screeningový test při podezření na malabsorpční syndrom. Zvýšená hladina ß-karoténu je popsána u hypothyreózy, diabetes mellitus, myxedému, nefrotického syndromu, hyperlipoproteinémií a u žen v těhotenství.
Zátěžový test s ß-karotenem porovnává hladinu nalačno a vzestup po zátěži. Pacientovi je podávána dávka 15000 IU s jídlem po dobu tří dnů. Normální hodnotou je vzestup oproti hodnotě nalačno o > 65 µmol/l. Tento zátěžový test je klinicky používán velmi zřídka, běžněji je používán zátěžový test s A-vitaminem.
4.3.2 Toleranční test s A-vitaminem
Provedení zátěžového testu. Pacient přichází nalačno, je odebrán vzorek krve a pak je podána zátěž 5000 IU A-vitaminu/kg váhy a tekutina (čaj). Za 3 a 5 hodin po podání A-vitaminu je odebrán vzorek krve pro analýzu.
Stanovení A-vitaminu v séru je možno provádět extrakční metodou se spektrofotometrickým měřením. Základní metodika podle Carr-Price je založena na reakci s chloridem antimonitým, nutná je korekce na ß-karoten. Moderní metodiky stanovení A-vitaminu využívají separačních možností HPLC.
Referenční hodnoty A-vitaminu v séru jsou v rozmezí 1.8-2.3 µmol/l, klinicky se prosté stanovení sérové hladiny využívá jen zřídka. Zátěžový toleranční test s A-vitaminem je hodnocen vzestupem hladiny v séru za 3 a 5 hodin po podání testovací zátěže. Normální hodnoty za 3 hodiny jsou v pásmu 3.6-12.6 µmol/l, za 5 hodin 7.2-24.6 µmol/l. Patologický výsledek testu je při hodnotách < 3.6 µmol/l za 3 hodiny resp. < 7.2 µmol/l za 5 hodin.
Klinický význam má toleranční test s A-vitaminem při diferenciální diagnostice malabsorpčního syndromu. Pozitivita testu koreluje s vylučováním tuku ve stolici.
4.3.3 Toleranční test s D-xylózou
Provedení testu. Pacient přijde nalačno, odebere se vzorek krve a moče a podá se zátěž D-xylózou. U dospělých osob se podává 25g D-xylózy, u dětí 5g; alternativní postup (především u dětí) doporučuje 0.5g/kg váhy. Po dobu 5 hodinového sběru moče pacienta saturujeme tekutinami (minimálně 2x250 ml čaje). Po 2 hodinách se odebere další vzorek krve, po 5 hodinách poslední porce moči. Změří se celkový objem moče za 5 hodin a pro analýzu se vezme vzorek cca 10ml moče. Variantní uspořádání testu umožňuje odběr krve i v jiném intervalu než 2 hodin, u dětí se odebírá obvykle krev již za 1 hodinu.
Stanovení D-xylózy je založeno na reakci 4-bromanilinu s furfuralem, který vzniká dehydratací D-xylózy v kyselém prostředí. Vzniklý barevný produkt je měřen fotometricky při 520nm. Reakce probíhá v přítomnosti thiomočoviny, která minimalizuje tvorbu interferujících barevných produktů. Vzorky krve je nutno před stanovením D-xylózy deproteinovat, doporučená je procedura se síranem zinečnatým a hydroxidem barnatým. Alternativní postupy pro stanovení D-xylózy jsou plynová chromatografie, HPLC a enzymová metoda s D-xylózo-oxidoreduktázou (s NADP+).
Referenční hodnoty D-xylózy. Hladina v séru za 1 hod po podání D-xylózy je 1.40-3.80 mmol/l, za 2 hodiny 2.13-3.86 mmol/l, za 3 hodiny 1.27-2.80 mmol/l, za 4 hodiny 0.73-1.93 mmol/l za 5 hodin 0.40-1.20 mmol/l. Patologickým výsledkem je hladina za 2 hodiny u dospělých po podání 25g < 1.67 mmol/l u dětí po podání 5 g < 1.33 mmol/l. V 5ti hodinovém sběru moče je u dětí 5-12 let po podání 5g D-xylózy patologickým výsledkem hodnota < 0.8g/5hod (širší rozmezí normálních hodnot je 0.5-1.65 g/5hod), u dospělých osob po podání 25g hodnota < 4g/5 hod (podle některých autorů je jako patologický hodnocen nález <5g/5 hod), u osob starších 65 let klesá hraniční hodnota na 3.5g/5hod. Při podání D-xylózy podle váhy (především u malých dětí) je normální rozmezí xylózy vyloučené močí za 5 hodin 10-33% podaného množství.
Klinický význam. Toleranční test s D-xylózou je obvykle indikován k potvrzení střevní malabsorpce u gluténové enteropatie (céliakální sprue), tropické sprue. Výsledek výdeje močí je ovlivněn funkcí ledvin. Falešně pozitivní výsledek může být stanoven např. při zvracení, dehydrataci, myxedému, ascitu, edému. Celá řada léků snižuje exkreci D-xylózy ledvinami - např. kyselina aminosalicylová, acetylosalicylová, digitalis, indomethacin, neomycin a další. 14C-D-xylózový dechový test je variantou xylózového absorpčního testu.
4.4 Dechové testy
V současné době existuje široká škála značených substrátů pro funkční testy žaludeční pasáže (13C-acetát), pankreatické funkce (14C-cholesteryl-octanoid, 13C-triolein, amylóza), střevní malabsorpce (14C/13C-xylóza,laktóza,palmitát), jaterních funkcí (13C-aminopyrin, leucin),13C-močovina k detekci ureázy při infekci Helicobacter pylori. K provedení dechových testů jsou dodávány soupravy, které obsahují definované množství substátu, 2 až 6 odběrových nádobek pro vzorky vydechovaného vzduchu (podle uspořádání testu) a odběrovou trubičku. Screeningové testy jsou dodávány v balení, ve kterém může nemocný po odběru vzorky zaslat do laboratoře poštou.
5. Screeningové programy
5.1 Okultní krvácení
Průkaz okultního krvácení lze provádět s využitím pseudoperoxidázové vlastnosti hemoglobinu nebo imunochemickým průkazem. Pseudoperoxidázová reakce hemoglobinu je základem řady testů, které obsahují testovací médium (papírek) impregnované guajakovou pryskyřicí nebo derivátem benzidinu - např. dimethylbenzidinem (o-tolidin). Bezbarvá leukoforma těchto látek je v přítomnosti peroxidu vodíku a hemoglobinu oxidována na barevnou (chromogenní) formu. Vzhledem k chemickému principu oxidační reakce jsou testy ovlivněny přítomností jiných oxidačních látek (C-vitamin), přítomností hemoglobinu z potravy (maso, krev), falešně pozitivní výsledek může být způsoben i přítomností rostlinných peroxidáz (některé druhy kořenové zeleniny). V závislosti na uspořádání testu je proto doporučováno definované, dietní omezení. Citlivost testů s guajakovou pryskyřicí je řádově nižší ve srovnání s testy imunochemickými. Mezi nejčastěji používané testy patří především Haemoccult, HemoCare, HemDetect, HemaCheck, ColoScreen a další. Detekční papírek impregnovaný o-tolidinem je v soupravě dříve často používaného německého Krypto-Haem-SSW testu.
Druhým přístupem je imunochemická detekce hemoglobinu reakcí s monoklonální protilátkou proti lidskému hemoglobinu. Na imunochemickém principu jsou založeny testy hemaglutinační, latexové imunoprecipitace, radiální imunodifúze i imunoafinitní chromatografie. Detekce proteinu (lidského hemoglobinu) monoklonální protilátkou vylučuje možnost ovlivnění jiným zdrojem hemoglobinu (potrava), odpadá interference chemických látek, není nutna specielní dieta. Citlivost imunochemických testů je výrazně vyšší; v závislosti na technice i < 0.1 mg hemoglobinu/g stolice. K imunochemickým testům patří např. latexový test Hemolex, na principu reversní pasivní hemaglutinace Heme-Select, imunoafinitní chromatografie ImmoCare.
Provedení testu. Pro screening jsou dodávány soupravy, které obsahují většinou 3 testy a plastové nebo dřevěné špátle na odběr stolice. Pacient odebere vzorky stolice, které rozetře na označená místa testu, testovací okénka uzavře a testy odešle do laboratoře. Laboratorní zpracování spočívá v aplikaci detekčního reagens na opačnou stranu okének a zhodnocení případné barevné změny. Hodnocení je kvalitativní, jako pozitivní je hodnocen každý test, kde dochází ke specifickému modro-zelenému zabarvení (u Haemoccult testu).
Imunochemické testy se výrazně liší podle typu použité techniky. V poslední době je nejrozšířenější varianta imunoafinitní chromatografie. Pacient odebere 1 vzorek stolice do odběrové nádobky se stabilizujícím roztokem. Laboratorní zpracování spočívá v aplikaci kapky extraktu na test a odečtení 1 nebo 2 barevných proužků, které detekují přítomnost pouze protilátky s barevným markerem (negativní test, 1 barevný proužek) nebo vznik komplexu antigenu-protilátky (pozitivní test, 2 barevné proužky). Hodnocení je opět kvalitativní.
Klinický význam screeningu je v záchytu časných fází kolorektálního karcinomu (Dukes stadium A a B) s možností radikální chirurgické léčby a v detekci prekanceróz tlustého střeva, především adenomových polypů, které je možno při následném diagnostickém programu endoskopicky odstranit.
5.2 Helicobacterová infekce
Stanovení protilátek k Helicobacter pylori. Protilátky v séru lze detekovat celou řadou imunologických a sérologických technik jako je imunobloting, imunofluorescence, hemaglutinace, fixace komplementu, latexové testy apod. Nejrozšířenější metodou je však bezesporu ELISA - jednoduchá, rychlá, levná a spolehlivá technika. Specificita a senzitivita metody je však značně závislá na použitém antigenu - od celých buněk, přes ultrazvukový sonikát, glycinový extrakt až k purifikovaným proteinům. V roce 1989 byla popsána izolace vysokomolekulárního povrchového proteinu (označovaný HM-CAP, high molecular weight cell-associated protein), jehož specificita a senzitivita dosahuje 95%.
Klinický význam. Sérologický průkaz protilátek k Helicobacter pylori má klinický význam především pro dlouhodobé sledování po léčbě, k monitorování úspěchu eradikace Helicobacter pylori, pokles IgG po 6 měsících léčby na hodnoty < 50% vykazuje specificitu 95% a senzitivitu 97%. Mezi indikace patří screening rizikových pacientů, např. u nemocných s transplantací ledvin, kdy Helicobacterová infekce zvyšuje riziko vzniku peptického vředu a krvácení. V současné době probíhá diskuse o širším screeningu populace především u nižších věkových kategorií s následnou léčbou chronické infekce.
5.3 Glutenová enteropatie
Klasická forma, diagnostikovaná často již v dětském věku, je provázena hubnutím, průjmy a histologickým průkazem atrofické, ploché sliznice tenkého střeva (průkaz enterobiopsií). Základní léčbou je dietní režim s vyloučením lepku, tzv. bezlepková (gluten-free) dieta. Po nasazení této léčby dochází u klasické formy k normalizaci klinického stavu i laboratorních testů. Další formy nejsou běžně diagnostikovány a tvoří téměř 80% případů, které jsou schematicky rozděleny do dalších skupin v modelu ledovce
(obr. 6.7).
Latentní forma je charakterizována patologickými hodnotami sérologických testů, při enterobiopsii se však často nalézá normální histologický obraz i při návratu k normální dietě obsahující lepek.
Němá forma (silent CS) je charakterizována pouze pozitivními sérologickými testy.
Jako potenciální forma je označena populace s genetickou predispozicí tj. HLA Dqw2 antigenem a zvýšeným počtem intraepiteliálních lymfocytů resp. g/d IEL sybtypů. Incidence všech forem sumárně je podle současných evropských studií 1:200 až 1:250.
Detekce protilátek ke gliadinu (AGA), k retikulinu (ARA) a endomysiu (EmA) byla v nedávné době zařazena mezi diagnostická kriteria céliakie Evropskou společností pro dětskou gastroenterologii a výživu (ESPGAN).
Stanovení antigliadinových protilátek (AGA) třídy IgA a IgG je základním diagnostickým testem pro screeningové studie. Nejčastěji používanou technikou k detekci protilátek je ELISA test s Anti-IgA resp. Anti-IgG protilátkou (konjugovanou s peroxidázou), existuje i citlivější a-Gliatest s fluorogenní detekcí. Specificita a senzitivita v rozmezí 80-95% závisí na typu použitého antigenu, který se liší u různých výrobců. Námi doporučený test je založen na purifikované frakci a -gliadinu.
Stanovení antiendomysiálních protilátek (EmA). Detekce antiendomysiálních autoprotilátek vykazuje nejvyšší (téměř 100%) specificitu i když vlastní molekulární substrát definován zatím nebyl. Průkaz je prováděn imunofluorescenční technikou na substrátu hladkého svalu. Nejlepší výsledky poskytují řezy opičího jícnu, existují i varianty s jiným typem hladkého svalu.
Klinický význam screeningu spočívá v časné diagnostice i u asymptomatických (bezpříznakových) jedinců, kdy dodržování bezlepkové diety snižuje riziko rozvoje onemocnění včetně zvýšeného výskytu maligních nádorů (především lymfomu).
6. Doporučená literatura: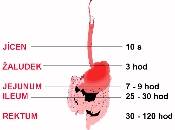 Při interpretaci výsledků, především funkčních testů je třeba zvažovat dobu pasáže, tj. dobu od polknutí potravy (např. testačního pokrmu) k dosažení cílového (testovaného) úseku trávicího ústrojí.
Doba pasáže (obr 6.1) je individuelní a může být výrazně ovlivněna jak vlastním patologickým procesem tak i psychickým stavem nemocného (stres, strach z vyšetření apod.).
Při interpretaci výsledků, především funkčních testů je třeba zvažovat dobu pasáže, tj. dobu od polknutí potravy (např. testačního pokrmu) k dosažení cílového (testovaného) úseku trávicího ústrojí.
Doba pasáže (obr 6.1) je individuelní a může být výrazně ovlivněna jak vlastním patologickým procesem tak i psychickým stavem nemocného (stres, strach z vyšetření apod.).
Biochemické testy a metodiky, které využíváme v diagnostice chorob zažívacího ústrojí tvoří velmi heterogenní skupinu, ze které lze velmi obtížně vytvořit jednoduchou kategorizaci. Nejčastěji se používá členění anatomické, orgánové, které neumožňuje jednoznačné zařazení všech testů, resp. řada testů musí být přiřazena duplicitně k několika anatomickým lokalizacím. Druhým kriteriem je klinicko-diagnostické, tj. přiřazení testu podle diagnostického problému. Třetí variantou je laboratorně-metodický přístup, který jsme zvolili jako optimální, s ohledem na zaměření této publikace.
2.1.1 Žaludek
Základním biochemickým vyšetřením je funkční test stanovení sekrece HCl (žaludeční acidita), v krevním séru stanovujeme hladinu gastrinu, pepsinogenů. Průkaz infekce Helicobacter pylori se provádí v biopsii sliznice rychlým ureázovým CLO testem (viz část 5.2), pro screening a dlohodobé sledování jsou vhodné serologické metody stanovení protilátek a dechové testy. Z klinických indikací je nejčastější vředová chroba gastroduodenální, karcinom žaludku, Zollinger-Ellisonův syndrom, akutní nebo chronická infekce Helicobacter pylori.
Běžným laboratorním testem je stanovení hladiny celkové a-amylázy v séru, vyšší specificitu poskytuje pankreatický izoenzym a -amylázy, stanovení lipázy a dalších pankreatických enzymů (trypsin, chymotrypsin, elastáza-1, fosfolipáza-A2). K vyšetření exokrinní funkce pankreatu slouží přímý test sekretin-cholecystokininový, nepřímé testy s chromogenním substrátem (PABA test), s fluorogenním substrátem, nebo testy dechové. Další variantou je stanovení chymotrypsinu nebo elastázy-1 ve stolici. Z tumorových markerů lze pro diagnostiku karcinomu pankreatu využít CA 19-9 a CA 242, případně CEA. Pro hodnocení závažnosti akutní pankreatitidy lze využít běžně používaných markerů zánětlivých procesů (reaktanty akutní fáze - CRP, LDH, a1-antitrypsin) zvláště výhodným markerem je leukocytární (polymorfonukleární) PMN-elastáza. Z klinických indikací je nejčastější akutní nebo chronická pankreatitida, karcinom pankreatu, malabsorpční syndrom.
Základním biochemickým testem je sérová hladina ß-karotenu a funkční testy s perorálně podaným A-vitaminem nebo xylózou. V dg.procesu se významně uplatňuje histochemické a imunohistochemické stanovení řady enzymů v bioptickém vzorku sliznice tenkého střeva. Při podezření na glutenovou enteropatii (céliakální sprue) stanovujeme sérovou hladinu protilátek ke gliadinu, antiretikulinových a antiendomysiálních protilátek, které mají význam i pro screeningové programy. Při malabsorpčním syndromu stanovujeme hladinu vápníku, železa, celkovou bílkovinu, alkalickou fosfatázu.
Biochemická diagnostika v oblasti tlustého střeva zahrnuje především testy okultního krvácení, a to jak pro screeningové programy tak pro dispensarizaci rizikových skupin populace. Další metody jsou zaměřeny na průkaz proliferační aktivity sliznice tlustého střeva a to v diagnostice malignity, nebo zhodnocení aktivity zánětlivého procesu při Crohnově chorobě nebo idiopatické proktokolitidě. Z tumorových markerů je pro tuto lokalizaci vhodný CEA, CA 19-9 a CA 242.
Správná volba vhodných biochemických testů a kvalifikovaná interpretace výsledků by měla být samozřejmou součástí klinicko-diagnostické rozvahy. Z tohoto klinického pohledu je výhodná kategorizace testů podle jejich vztahu k jednotlivým patologickým procesům nebo diferenciálně-diagnostickým otázkám (obr.6.2).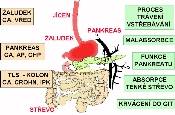 Patologickým procesem může být např. malabsorpční syndrom, jehož příčiny mohou být v porušené absorpci tenkého střeva nebo v insuficienci exokrinní sekrece pankreatu. Klinicko-diagnostickou otázkou může být rozlišení karcinomu pankreatu od chronického zánětu. Diagnostickýmproblémem může být nalezení zdroje krvácení do zažívacího systému, které může být lokalizováno v jícnu, žaludku, tenkém i tlustém střevě. Velmi častou dg. otázkou je stanovení aktivity procesu (zánětlivého, nádorového) a odpověď na léčbu tj. dlouhodobé sledování nemocného.
Patologickým procesem může být např. malabsorpční syndrom, jehož příčiny mohou být v porušené absorpci tenkého střeva nebo v insuficienci exokrinní sekrece pankreatu. Klinicko-diagnostickou otázkou může být rozlišení karcinomu pankreatu od chronického zánětu. Diagnostickýmproblémem může být nalezení zdroje krvácení do zažívacího systému, které může být lokalizováno v jícnu, žaludku, tenkém i tlustém střevě. Velmi častou dg. otázkou je stanovení aktivity procesu (zánětlivého, nádorového) a odpověď na léčbu tj. dlouhodobé sledování nemocného.
Laboratorní metody používané v gastroenterologii zahrnují stanovení řady enzymů a metabolitů v séru a v moči, imunologický průkaz protilátek, imunochemická stanovení hormonů, tumorových markerů, biochemické separační postupy detekce izoenzymů a makroforem enzymů, vyšetření žaludeční, duodenální a pankreatické šťávy, histochemické a imunohistochemické průkazy v bioptickém materiálu, kultivační a mikroskopický průkaz. Funkční testy mají složku prováděnou lékařem nebo zdravotní sestrou na lůžku či v ambulanci. Tímto stručným výčtem směřujeme k označení laboratorní medicíny; tj. metody používané v gastroenterologii nebudeme dělit na enzymologické, imunologické, histologické atd. Laboratorně-metodická kategorizace člení metody na 3 skupiny. Testy a metody prováděné rutinně ve smyslu běžné laboratoře klinické biochemie, metody aplikovatelné na automatické analyzátory. Funkční testy jsou druhou skupinou, testy specializované, prováděné většinou v návaznosti na vlastní funkční zátěž pacienta a odběr materiálu, který probíhá mimo laboratoř (na lůžku, ambulantně v ordinaci lékaře). Laboratorní analýza odebraných vzorků je většinou složitějším, manuálním procesem. Třetí skupinu tvoří screeningové programy, u kterých velmi často provádí odběr vzorku pacient sám, doma. Tato kategorizace je tedy členěním metodickým, technicko-organizačním.
3.1. Pankreatické enzymy
3.1.1. Alfa-amyláza
a-amyláza ( a-1,4-glukan-4-glukan-hydroláza, EC 3.2.1.1) hydrolyzuje a-1-4 glykosidovou vazbu; pH optimum a-amylázy je mezi 7.0-7.2. V organizmu se vyskytuje ve dvou formách - slinný a pankretický izoenzym, podle jejich orgánového původu. a-amyláza je tvořena v acinárních buňkách pankreatu a hromadí se v zymogenních granulech. Do střevního lumen se dostává ve formě pankreatického sekretu (pankreatické šťávy) spolu s dalšími trávicími enzymy. Za fyziologických podmínek není molekula enzymu absorpována střevním povrchem a sérová hladina je nízká, odpovídající aktivitě enzymu uvolněného do cirkulace přímo ze žlázových buněk resp. lymfatickou drenáží. Molekulová hmotnost a-amylázy je 55.000. Z cirkulace je a-amyláza eliminována v ledvinách glomerulární filtrací. Makroforma enzymu - makroamyláza vzniká vazbou enzymu na některé bílkoviny krevního séra, především imunoglobulíny, cirkulující imunokomplexy nebo jiné glykoproteiny. Makroforma enzymu má podstatně vyšší molekulovou hmotnost (od 150 000 do 2 000 000) a není proto eliminována glomerulární filtrací. Pro klinickou diagnostiku se stanovuje hladina a-amylázy v séru, v moči a vypočítává se index clearance amylázy/kreatininu.
Lipáza (triacylglycerol acyl hydroláza EC 3.1.1.3.) je rovněž glykoproteinem se 420 449 aminokyselinovými zbytky a molekulovou hmotností 46000 56000 u pankreatické lipázy a 32000 - 39000 u sérové lipázy. Lipáza je hydrolytickým enzymem štěpícím triacylglyceroly s mastnými kyselinami o delším řetězci než 12C, v přítomnosti žlučových kyselin štěpí tuk na monoacylglyceroly a diacylglyceroly. Predilekčně jsou štěpeny mastné kyseliny v polohách 1 a 3. Tak jako a-amyláza je i lipáza produkována žlázovými buňkami pankreatu a secernována do střevního lumen v pankreatické šťávě. Koncentrační gradient mezi pankreatickou tkání a sérovou lipázou je cca 20000:1. Pro enzymovou hydrolýzu je nezbytný serin v řetězci Asp His Ser, pH optimum je mezi 7.5 a 10.0, v závislosti na podmínkách reakce; pl hodnota popsaných forem enzymu je v rozmezí 5.80 a 7.4. Kromě pankreatické lipázy existují další formy triacylglycerolové lipázy např.lipáza jaterní, kterou lze odlišit inaktivcí atoxylem (pankreatická lipáza je rezistentní).
Trypsin
Trypsin (ve formě trypsinogenu) je obdobně jako další pankreatické enzymy produkován acinózními buňkami pankreatu a cestou pankreatického vývodu je secernován do duodena. Část přechází do krevního oběhu, kde jej lze stanovit imunologickými metodami (RIA). Většinou je stanoven trypsin spolu s trypsinogenem a komplexem trypsinu s a1-proteinázovým inhibitorem (a1-antitrypsin), v závislosti na použité detekční metodice (specificita protilátek). Fyziologické hodnoty se pohybují v rozmezí 100-400 µg/l opět v závislosti na typu použité detekční soupravy. U akutní pankreatitidy prokazujeme několikanásobné zvýšení (až 20000 µg/l), lehké zvýšení je u cholelitiázy. Snížené hodnoty svědčí pro chronickou pankreatitidu, mukoviscidózu. U karcinomu pankreatu lze prokázat snížené i zvýšené hodnotu trypsinu.
Elastáza (EC 3.4.21.11) je secernována jako proelastáza a aktivována trypsinem. Rozlišujeme elastázu-1 (Mr 30000; anodická frakce), která se vyskytuje v séru ve volné formě a v komplexu s a1-proteinázovým inhibitorem, a elastázu-2 (Mr 25000; katodická frakce). Hladina elastázy-1 je zvýšena u akutní i chronické recidivující pankreatitidy, přičemž zvýšení přetrvává déle a lépe koreluje s klinickým stavem než hladina a-amylázy. Ke stanovení elastázy-1 se používá RIA metody se 125I-značenou elastázou nebo novějších ELISA technik s monoklonální protilátkou k elastáze-1. Nejnovější studie prokazují význam stanovení elastázy-1 v diferenciální diagnostice karcinomu pankreatu. Elastáza-1 (stanovená ELISA technikou) má ze všech pankreatických enzymů pro karcinom pankreatu nejvyšší specificitu i sensitivitu. Referenční rozmezí (pro RIA metodiku) je 1.3-4.3 µg/l.
Tumorové markery představují značně heterogenní skupinu, do které patří onkofetální antigeny, specifické nádorové proteiny, proliferační proteiny, hormony, enzymy resp. isoenzymy a reaktanty akutní fáze. Stanovení tumorových markerů pro časnou diagnostiku nádorových onemocnění se v gastrointestinální oblasti neosvědčilo. Indikací vyšetření je především monitorování úspěšnosti terapie a dlouhodobé sledování nemocných, kdy změny hladiny tumorových markerů mohou signalizovat rozvoj metastatického procesu nebo recidivu tumoru. Pro přesnější vyhodnocení těchto změn lze s výhodou využít moderních expertních systémů, které pracují na základě statistických a predikčních algoritmů. Ze široké nabídky tumorových markerů lze pro uvedené indikace využít tyto tumorové markery:
3.3.1 Gastrin
Gastrin je hormon polypeptidového charakteru (molekula je tvořena 17 aminokyselinami, Mr = 2100), který se vyskytuje ve třech formách. Základní molekula G-17 (little gastrin), G-34 (big gastrin) a G-13 (mini gastrin) zkrácený řetězec na 13 aminokyselin. Pentapeptid s C-terminální sekvencí gastrinu (ß-Ala-Trp-Met-Asp-Phe-NH2) - pentagastrin se používá ke stimulaci při vyšetření žaludeční acidity.
Stanovení gastrinu je součástí gastrinového stimulačního testu, kdy stanovujeme 90ti minutový profil (v 9 vzorcích séra) po stimulaci insulinem, sekretinem nebo Ca-glukonátem.
Pepsin resp. pepsinogen je obecné označení pro řadu proteináz (pepsin A,B,C - EC 3.4.23.1,2,3) a jejich prekurzory (proenzymy). Aktivace pepsinogenu A na pepsin A probíhá v kyselém prostředí, vznikající pepsin A je schopen další aktivace pepsinogenu a vede k tzv. autokatalýze. Při elektroforetické separaci v agarovém gelu je možno stanovit 8 frakcí, frakce 1-5 tvoří skupinu pepsinogenů I (PG-I, odpovídající PG-A), další tři frakce pepsinogeny skupiny II (PG-II, odpovídající PG-C). Klinický význam má stanovení pepsinu při insulinovém testu a sérová hladina pepsinogenů A a C. Ke stanovení se používá RIA metodik s 125I-pepsinogenem v kompetitivním uspořádání. Pepsinogen A je markerem slizniční atrofie a je používán v genetických studiích jako subklinický marker vředové choroby duodena. Pepsinogen C je používán jako marker stavu žaludeční sliznice (případně v poměru PG-A/PG-C) a rovněž jako marker eradikace infekce Helicobacter pylori. Snížení hladiny pepsinogenu A prokazujeme u nemocných s achlorhydrií např. u perniciózní anémie.
Funkční testy tvoří významnou složku klinicko-diagnostického procesu v gastroenterologii. Doplňují výsledky zobrazovacích technik o podstatnou informaci, kterou je funkce orgánu, resp. schopnost reagovat na stimulaci. Funkční test zahrnuje přesně definovanou stimulaci a výsledek je interpretován jako odpověď orgánu na stimulaci s přihlédnutím k bazálním hodnotám analytu před stimulací. U nepřímých funkčních testů je nutno navíc při interpretaci posuzovat funkci dalších orgánů nebo systémů, které se na procesu podílejí. Např. u nepřímého testu, kdy je analyt vylučován ledvinami, je nutno výsledek interpretovat se znalostmi renálních funkcí; u dechových testů je nutno znát ventilační poměry, je-li analyt metabolizován v játrech - jaterní funkce apod. Komplexní zhodnocení a interpretace u funkčních testů vyžaduje úzkou spolupráci s indikujícím lékařem.
4.1.1 Stanovení žaludeční sekrece, acidity
Parietální buňky žaludeční sliznice produkují kyselinu chlorovodíkovou o koncentraci cca 0.5 mmol/l). Zdrojem vodíkového iontu H+ je voda,která je disociována membránovou hydrolýzou v součinnosti s reakcí karboanhydrázy produkující CO2. Karboanhydráza je limitujícím faktorem tvorby HCl v žaludeční sliznici. Regulace žaludeční sekrece je řízena neurohumorálně, významným faktorem je hladina gastrinu. Vyšetřování žaludeční acidity je založeno na stimulaci parietálních buněk, odběru žaludeční šťávy a stanovení obsahu volné a celkové HCl. Ke stimulaci je nejvhodnější pentagastrin
(viz část 3.3.1)
, použít lze i histaminu (Lamblingův test) nebo insulinu. Hodnocení funkčního testu je však závislé na typu stimulace tj. výsledek se liší po podání gastrinu, histaminu nebo insulinu.
Vyšetření exokrinní funkce pankreatu je zaměřeno ke stanovení pankreatické insuficience. Jako tzv. "zlatý standard" je označováno vyšetření přímé, kdy provádíme analýzu duodenálního obsahu po stimulaci enterohormóny. Jedná se o test, jehož výsledky poskytují jednoznačně nejvyšší specificitu i sensitivitu, test je však invasivní, náročný pro nemocného a vyžaduje náročnou laboratorní analýzu duodenálního obsahu. Proto se stále více uplatňují testy nepřímé, jednodušší a vhodné i pro screeningové účely.
Na stimulaci pankreatu se podílejí dva hormony, sekretin a cholecystokinin. Sekretin stimuluje vlastní sekreci pankreatické šťávy a produkci hydrogenuhličitanu, cholecystokinin stimuluje sekreci trávicích enzymů. Sekretinový test proto umožňuje zhodnocení pouze objemu pankreatického sekretu a koncentraci hydrogenuhličitanu, ke zhodnocení sekrece trávicích enzymů je nutné použít kombinované stimulace tj. sekretin-cholecystokininový test (PZS test; cholecystokinin = pankreozymin). Ke stimulaci může být použito místo cholecystokininu i ceruleinu. Sekretin-CCK test je prováděn v mnoha modifikacích, které se liší jak v množství stimulačních hormonů, ve formě podání (i.v., v infúzi), podání vnitřního markeru pro korekci objemu i ve způsobu analýzy duodenální šťávy.
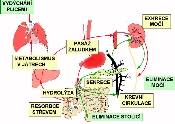 Nepřímé funkční testy
(obr. 6.3) jsou založeny na principu, kdy perorálně je podán chromogenní (nebo fluorogenní) substrát, který je štěpen pankreatickými enzymy (chymotrypsinem, lipázou). NBT-PABA test (Bentiromid, Roche; není již vyráběn) obsahoval substrát N-benzoyl-L-tyrosyl-4-aminobenzoovou kyselinu (Bz-Tyr-PAB), u nás byl vyráběn ALTAB test (Spofa-Gnost Pankenzan, Léčiva) se susbtrátem N-acetyl-L-tyrosyl-4-aminobenzoovou kyselinou (Ac-Tyr-PAB), který poskytoval lepší diskriminaci mezi souborem nemocných s insuficiencí pankreatu a kontrolním souborem. Fluorogenní variantou je preparát Pankreolauryl (substrátem je fluorescein-di-laurylester). Koncentrace chromogenu (fluorogenu) vyloučeného močí, resp. jeho koncentrace v séru je mírou aktivity enzymu v duodenu. Mezi nepřímé testy patří i stanovení chymotrypsinu nebo elastázy-1 ve stolici. V poslední době se objevují další nové funkční testy - dechové testy, kdy perorálně podaný substrát je značen izotopem uhlíku 13C (starší testy izotopem 14C). Mírou aktivity pankreatických enzymů je koncentrace 13C (nebo 14C) ve vydechovaném vzduchu.
Nepřímé funkční testy
(obr. 6.3) jsou založeny na principu, kdy perorálně je podán chromogenní (nebo fluorogenní) substrát, který je štěpen pankreatickými enzymy (chymotrypsinem, lipázou). NBT-PABA test (Bentiromid, Roche; není již vyráběn) obsahoval substrát N-benzoyl-L-tyrosyl-4-aminobenzoovou kyselinu (Bz-Tyr-PAB), u nás byl vyráběn ALTAB test (Spofa-Gnost Pankenzan, Léčiva) se susbtrátem N-acetyl-L-tyrosyl-4-aminobenzoovou kyselinou (Ac-Tyr-PAB), který poskytoval lepší diskriminaci mezi souborem nemocných s insuficiencí pankreatu a kontrolním souborem. Fluorogenní variantou je preparát Pankreolauryl (substrátem je fluorescein-di-laurylester). Koncentrace chromogenu (fluorogenu) vyloučeného močí, resp. jeho koncentrace v séru je mírou aktivity enzymu v duodenu. Mezi nepřímé testy patří i stanovení chymotrypsinu nebo elastázy-1 ve stolici. V poslední době se objevují další nové funkční testy - dechové testy, kdy perorálně podaný substrát je značen izotopem uhlíku 13C (starší testy izotopem 14C). Mírou aktivity pankreatických enzymů je koncentrace 13C (nebo 14C) ve vydechovaném vzduchu.
Mezi nepřímé funkční testy lze zařadit i stanovení aktivity chymotrypsinu nebo elastázy-1 ve vzorku stolice. Tato testy se provádějí bez standardní stimulace, není porovnávána bazální a stimulovaná sekrece. Testy jsou však ze všech dostupných metod nejjednodušší pro nemocného i laboratorní zpracování. Klinický přínos je však odpovídající vzhledem k uvedeným omezením test - tj. nestimulované testy neposkytují dostatečnou diferenciaci mezi normálním a patologickým stavem.
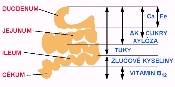 Funkční vyšetření tenkého střeva slouží především k diferenciální diagnostice malabsorpčního syndromu, k objasnění příčiny malabsorpce (primární, sekudární malabsorpční syndrom). Biochemické testy zahrnují zátěžové, toleranční testy s perorálním podáním D-xylózy nebo A-vitaminu, testy střevní permeability s podáním laktózy, manitolu, biochemické vyšetření vzorků sliznice odebrané enterobiopsií a testy sekreční funkce se značeným albuminem (51Cr-albuminový test). Variantou funkčních testů jsou i dechové testy s izotopově značenou (13C, 14C) xylózou, laktózou resp. dalšími substráty. K funčním testům může být použito i jiných látek např. železo a vitamin B12 (Schillingův test). Pro odběr vzorků po podání testované látky a při interpretaci je nutno zvažovat nejen dobu pasáže ale i rozdílnou lokalizaci v tenkém střevu (od duodena po terminální ileum), kde dochází ke vstřebávání testovaného substrátu
(obr. 6.4)
.
Funkční vyšetření tenkého střeva slouží především k diferenciální diagnostice malabsorpčního syndromu, k objasnění příčiny malabsorpce (primární, sekudární malabsorpční syndrom). Biochemické testy zahrnují zátěžové, toleranční testy s perorálním podáním D-xylózy nebo A-vitaminu, testy střevní permeability s podáním laktózy, manitolu, biochemické vyšetření vzorků sliznice odebrané enterobiopsií a testy sekreční funkce se značeným albuminem (51Cr-albuminový test). Variantou funkčních testů jsou i dechové testy s izotopově značenou (13C, 14C) xylózou, laktózou resp. dalšími substráty. K funčním testům může být použito i jiných látek např. železo a vitamin B12 (Schillingův test). Pro odběr vzorků po podání testované látky a při interpretaci je nutno zvažovat nejen dobu pasáže ale i rozdílnou lokalizaci v tenkém střevu (od duodena po terminální ileum), kde dochází ke vstřebávání testovaného substrátu
(obr. 6.4)
.
ß-karoten je retinoid, prekursor vitaminu A (z jedné molekuly ß-karotenu vznikají 2 molekuly A-vitaminu), jeho zdrojem je především ovoce a zelenina. A-vitamin i ß-karoten jsou rozpustné v tucích, jejich hladina v séru je proto závislá na trávení a vstřebávání tuků. V cirkulaci je ß-karotén vázán z 80% na LDL, 8% na HDL a z 12% na VLDL lipoproteiny. Ze sérových karotenoidů tvoří ß-karoten asi 25%. Z klinického hlediska je významný velmi krátký poločas ß-karotenu resp. jeho rychlá konverze na A-vitamin.
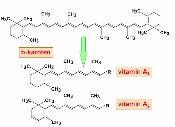 A-vitamin je v tuku rozpustný vitamin, molekulové hmotnosti 286.44 existující ve dvou přirozených formách
(obr. 6.5) - retinol (A1) a 3-dehydroretinol (A2); prekursorem A-vitaminu je ß-karoten. A-vitamin (Axeroftol) je podán ve formě esteru rozpustného v tucích, který je hydrolyzován pankreatickými enzymy a v enterocytu pak dochází k jeho reesterifikaci nejčastěji s kyselinou palmitovou; v plazmě se váže na specifický lipoprotein (retinol vázající protein).
A-vitamin je v tuku rozpustný vitamin, molekulové hmotnosti 286.44 existující ve dvou přirozených formách
(obr. 6.5) - retinol (A1) a 3-dehydroretinol (A2); prekursorem A-vitaminu je ß-karoten. A-vitamin (Axeroftol) je podán ve formě esteru rozpustného v tucích, který je hydrolyzován pankreatickými enzymy a v enterocytu pak dochází k jeho reesterifikaci nejčastěji s kyselinou palmitovou; v plazmě se váže na specifický lipoprotein (retinol vázající protein).
Zátěžový test s D-xylózou (xylózový absorpční test) je indikován v diferenciální diagnostice malabsorpčního syndromu. D-xylóza je 5-uhlíkový monosacharid (pentóza), který je asi ze 60% pasivně absorpován v proximální části tenkého střeva (duodenojejunální) a z cirkulace je eliminován ledvinami. Clearance cca 87% je dána tubulární resorpcí D-xylózy. Stanovujeme hladinu v séru a v moči, nalačno a za 5 hodin po podání zátěže (pro stanovení odpadu močí je prováděn 5 hodinový sběr moče).
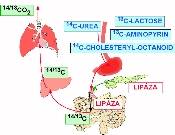 Variantním uspořádáním funkčních testů jsou testy dechové. Po podání testovaného substrátu jsou odebírány vzorky vydechovaného vzduchu a je měřena koncentrace vodíku nebo CO2 podle, typu testu
(obr. 6.6). U H2 dechových testů je měřena koncentrace H2 plynovou chromatografií, u testů značených izotopem uhlíku 14C je nutné měření radioizotopové. Moderní dechové testy jsou proto založeny na izotopu 13C, který je stanovován ve vydechovaném vzduchu hmotnostní spektrometrií.
Variantním uspořádáním funkčních testů jsou testy dechové. Po podání testovaného substrátu jsou odebírány vzorky vydechovaného vzduchu a je měřena koncentrace vodíku nebo CO2 podle, typu testu
(obr. 6.6). U H2 dechových testů je měřena koncentrace H2 plynovou chromatografií, u testů značených izotopem uhlíku 14C je nutné měření radioizotopové. Moderní dechové testy jsou proto založeny na izotopu 13C, který je stanovován ve vydechovaném vzduchu hmotnostní spektrometrií.
Screeningové (vyhledávací) programy jsou zaměřeny na časnou diagnostiku onemocnění, které jinak zůstávají, v této časné fázi, nerozpoznány. Screeningové programy se provádějí u asymptomatických osob (bez příznaků onemocnění). U definovaných tzv. vysokorizikových skupin se jedná o programy dispensarizační. Pro tyto vyhledávácí programy se musí přesně definovat populace, která má být screeningem testována, interpretace použitých testů a způsob dalšího vyšetření resp. léčby při pozitivním výsledku testu. Velmi detailně je propracován screening okultního krvácení ve vyhledávání kolorektálních nádorů, kde je stanoven interval screeningu, věkové rozmezí i následný koloskopický vyšetřovací program při pozitivním průkazu okultního krvácení. Screening Helicobacterové infekce pomocí serologických nebo dechových testů je ve fázi vývoje, obdobně i screening glutenové enteropatie (céliakální sprue) detekcí protilátek ke gliadinu resp. endomysiálních protilátek.
Zásadní otázkou pro použití testů detekce okultního krvácení je indikace tohoto stanovení. Screening, jako úvodní metoda depistážních programů pro vyhledávání kolorektálních nádorů u asymptomatických jedinců, je nutno provádět testem, který splňuje stanovená kriteria. Depistážní programy jsou založeny na opakovaném stanovení v pravidelných intervalech jednoho až dvou let. V případě pozitivního výsledku testu musí následovat cílené gastroenterologické (endoskopické) vyšetření k objasnění příčiny pozitivity testu. Z těchto důvodů nelze pro screening použít testů imunochemických, které mají výrazně vyšší citlivost a poskytují 4 - 7% falešnou pozitivitu. Haemoccult testem jsme ve studii našeho pracoviště prokázali u > 95 tisíc asymptomatických osob pozitivitu 2.8%, falešná pozitivita testovaná při srovnání s imunochemickými testy byla nulová. Imunochemické testy jsou vhodné pro detekci (vyloučení) krvácení u symptomatických nemocných, kde test okultního krvácení je jedním z řady vyšetřovacích postupů.
Bakterie Helicobacter pylori (dříve Campylobacter) je známa řadu desetiletí, její klinický význam však vzrostl teprve v roce 1982, kdy Warren a Marshal popsali přímý vztah k epithelu žaludeční sliznice u nemocných s gastritidou nebo žaludečními vředy. Pro diagnostiku infekce Helicobacterem pylori lze použít mikrobiologický kultivační postup, mikroskopický průkaz bakterie v bioptickém materiálu nebo jednoduchý ureázový test. Kultivační test vykazuje nejvyšší sensitivitu i specificitu, nevýhodou je však značná citlivost bakterie Helicobacter pylori ke kyslíku, což vyžaduje specielní podmínky odběru a transportu. Rychlý ureázový (CLO) test je založen na intensivní aktivitě ureázy (povrchový marker bakterie Helicobacter pylori). Mezi nepřímé testy patří jednak serologický průkaz protilátek k Helicobacter pylori v séru, jednak dechový test založený opět na aktivitě ureázy, kdy je stanovován 14C nebo 13C ve vydechovaném vzduchu po rozštěpení izotopově značené močoviny jako substrátu pro ureázu.
 Céliakální sprue (CS, glutenová enteropatie) je onemocněním, které se projevuje intolerancí k pšeničnému gliadinu (lepku) resp. dalším zásobním proteinům (prolaminům) příbuzných obilovin, ječmene, žita a ovsa. Glutenová enteropatie je geneticky podmíněným autoimunitním onemocněním. Současné poznatky přinášejí doklady o heterogenitě klinické prezentace tohoto onemocnění.
Céliakální sprue (CS, glutenová enteropatie) je onemocněním, které se projevuje intolerancí k pšeničnému gliadinu (lepku) resp. dalším zásobním proteinům (prolaminům) příbuzných obilovin, ječmene, žita a ovsa. Glutenová enteropatie je geneticky podmíněným autoimunitním onemocněním. Současné poznatky přinášejí doklady o heterogenitě klinické prezentace tohoto onemocnění.
Burtis C.A., Ashwood E.R. editors: Tietz Textbook of Clinical Chemistry, W.B.Saunders Comp.1994
Frič P.: Klinickobiochemická diagnostika chorob trávicího ústrojí. Biochem.Clin.Bohemoslov. 1985, 14:209
Frič P.: Pokroky v diagnostice chorob exokrinního pankreatu. Pokroky v gastroenterologii 2, Mařatka Z. editor, Avicenum, zdrav. nakladatelství Praha 1983
Friedman R.B., Young, D.S.: Effects of Disease on Clinical Laboratory Tests, Lexi-Comp.Inc. AACC Press 1989
Hořejší J. a spol.: Základy klinické biochemie ve vnitřním lékařství, Avicenum, zdrav. nakladatelství Praha 1989
Howanitz J.H., Howanitz P.J. editors: Laboratory Medicine, Test Selection and Interpretation, Churchil Livingstone 1991
Jacobs D.S. editor et al.: Laboratory Test Handbook. Lexi-Comp.Inc. Williams & Wilkins 1990
Masopust J.: Požadování a hodnocení biochemických vyšetření. Zdravotnické aktuality 90/216, Avicenum, zdrav. nakladatelství Praha 1990
Musil J.: Molekulové základy klinické biochemie, Grada-Avicenum, Praha 1994