Výuka klinické biochemie tvoří nezbytnou součást lékařského studia. Lékař musí být schopný aplikovat znalosti medicíny a biochemie v lékařské praxi. K efektivní spolupráci s biochemickou laboratoří a k plnému využití výsledků laboratorních vyšetření jsou pro ošetřujícího lékaře nejdůležitější tyto dva aspekty:
- efektivní indikace biochemických vyšetření
V současnosti má lékař k dospozici širokou škálu biochemických vyšetření. Při správném použití poskytují velmi cennou informaci. Jestliže by byly používány nesprávně a bez rozmyslu, mohou pacienta neúměrně zatěžovat, jejich výsledek může být bezcenný a v nejhorším případě i zkreslující a tím i nebezpečný vzhledem ke stavu pacienta. Mechanické vyplňování žádanky nelze považovat za vhodný prostředek k získání informací, které by pomohly vyléčit nebo zachránit pacienta. Laboratorní vyšetření mají být využita k prevenci či diagnostice onemocnění, ke sledování jeho průběhu a k monitorování léčby, tedy ne proto, aby se jejich počtem dokládala péče o nemocného.
Ačkoliv se tato skutečnost zdá být zcela jasná, může být někdy opomíjena. Intelektuální uspokojení lékaře přichází naopak z co nejefektivnějšího využití nálezů z laboratoře ke prospěchu pacienta. Jedno biochemické vyšetření nelze též považovat nezbytně za lepší než druhé jen z toho důvodu, že je dražší a vyžaduje složitější přístrojovou techniku. Lékař má znát požadovaný test a jeho typický průběh u daného onemocnění. Nadměrně požadovaná biochemická vyšetření nemusí vždy přinášet odpovídající plnohodnotnou informaci a mohou naopak oddálit léčbu. Může také docházet k odčerpávání finančních prostředků, které by bylo možné investovat efektivněji v rámci celkové péče o nemocného. Je samozřejmě též jasné, že podcenění indikace je stejně nežádoucí jako indikace nadměrná. K efektivnímu využití laboratorních vyšetření je nutné, aby indikace řešila konkrétní otázku či cíl. Biochemická vyšetření pomáhají nejen ke stanovení diagnózy, ale umožňují též odhalit asymptomatické onemocnění, posoudit aktivitu a stádium choroby, sledovat účinnost terapie.
V následujícím přehledu jsou ukázány důvody požadování laboratorních vyšetření:
Dříve než lékař požaduje biochemické vyšetření, mohou k rozhodnutí o indikaci posloužit tyto otázky:
Řada vyšetření může výrazně přispět k včasné diagnostice v době, kdy je pacient ještě v asymptomatickém stádiu choroby. Sem patří např. stanovení cholesterolu u pacienta s rizikem ICHS, detekce okultního krvácení u kolorektálních karcinomů nebo nález fenylketonurie u vrozených metabolických poruch.
Jestliže bude odpověď na kteroukoliv otázku kladná, pak má být biochemické vyšetření požadováno. Když jsou odpovědi na všechny otázky záporné, pak není nutné vyšetření provádět.
Jak často požadovat biochemická vyšetření?
Rozhodnutí záleží převážně na těchto faktorech:
- změna v biochemickém parametru bude mít vliv na léčbu
Interpretace
Po vztažení výsledků k referenčnímu rozmezí je nutné posoudit výsledek z hlediska celkového a současného klinického stavu nemocného. Je sice neobvyklé, aby na základě jen jednoho laboratorního testu byla stanovena diagnóza, nicméně i výsledky malého počtu vhodně zvolených a indikovaných vyšetření mohou být velmi užitečné k potvrzení klinického podezření nebo k vyloučení jednoho či více patologických procesů.
Před stanovením diagnózy a zahájením léčby na podkladě kvantitativních biochemických vyšetření lze ke správné interpretaci použít tyto otázky:
a) Jestliže je vyšetření provedeno v současném stavu poprvé, je v mezích anamnestických fyziologických hodnot jedince? Nejsou-li tyto k dispozici, je výsledek v mezích referenčních hodnot nebo je patologický?
Následující text vysvětluje podrobněji uvedené tři otázky.
Ad a) Je vyšetření v rozmezí fyziologických hodnot nebo je patologické?
Skutečné referenční fyziologické hodnoty jsou definovány jako určité kvantity, které byly získány od jedinců s definovaným stavem zdraví. Při stanovení referenčních hodnot je nutné vzít v úvahu faktory ovlivňující biochemická vyšetření. Je proto nezbytné definovat způsob odběru vzorku, referenční populaci, fyziologické podmínky včetně vlivu vnějšího prostředí na referenční populaci, druh analytické metody atd. Též je nutné přesně definovat způsob statistického zpracování.
Často se předpokládá, že distribuce parametru bude gaussovská (normální). Této distribuci odpovídají zčásti parametry, které jsou v těle regulovány (koncentrace glukózy, sodíku, draslíku). Za normální rozsah se bere průměr plus/minus 2 směrodatné odchylky, tedy rozsah, který zahrnuje 95% všech analyzovaných hodnot. U řady biochemických vyšetření však gaussovské rozložení neplatí a vyskytuje se distribuce asymetrická s maximem posunutým k vyšším, ale i nižším hodnotám, než je hodnota střední.
Všeobecně větší výhodnost by mohly mít tzv. "individuální fyziologické hodnoty", kde znalost rozpětí hladin daného parametru z opakovaných vyšetření konkrétního pacienta umožní rozlišit patologické výsledky. Tato optimální situace, kdy každý jedinec by měl stanoven svůj individuální rozsah normálních hodnot, zjištěný v delším časovém úseku, nebývá však z praktických důvodů vždy dosažitelná.
Pro interpretaci je nutné též upozornit na diferenci referenčních hodnot mezi laboratořemi. Klinicko-biochemické laboratoře mohou mít u některých parametrů rozdílná referenční rozmezí. Tato odlišnost referenčních rozmezí je dána použitím rozdílných analytických systémů, metod, reagencií a instrumentária. Při porovnávání výsledků biochemických vyšetření s referenčním rozmezím je proto nutné použít hodnoty z laboratoře, která provedla daná vyšetření.
Ad b) Má výsledek diagnostickou hodnotu?
V některých případech může být výsledek nespecifický a nemusí mít diagnostický či terapeutický význam. Např. při infúzi glukózy a inzulinu může plazmatická hladina fosfátu klesnout tím, že se dostává fosfát do buněk. Hypofosfatémie tak neodráží depleci fosfátu v těle.
Numerické hodnoty koncentrace závisejí nejen na celkovém množství měřeného analytu, ale též na množství vody, ve kterém je daná látka v těle distribuována. Hyponatrémie nemusí být výrazem deplece sodíku, ale častěji ukazuje na zvýšené množství vody. Podobně hypernatrémie je častější z důvodu sníženého množství vody než z nadbytku sodíku. Tuto skutečnost je nutné si uvědomit, neboť souvisí s adekvátní léčbou.
Plazmatické koncentrace např. albuminu, kalcia a železa se mohou měnit u onemocnění, která nesouvisí s primárním defektem vlastního metabolismu. Většina metod pro stanovení plazmatického kalcia měří celkovou sumu kalcia vázaného na bílkovinu a volného - ionizovaného kalcia. Změna hladiny albuminu souvisí se změnou vázaného kalcia, aniž by došlo ke změně fyziologicky důležité volné ionizované frakce. Je proto důležité nesnažit se zvýšit celkovou koncentraci kalcia k normě, jestliže je prokázána hypoalbuminémie. Plazmatická hladina železa může být snížena u řady typů anémií, aniž by se jednalo o anémii z deficitu železa.
Při hodnocení abnormálního výsledku laboratorního vyšetření je nutné vzít v úvahu též možnost řady interferencí. Nejčastější interference jsou způsobeny léky a to zejména při analýze moči. Podaná léčiva jsou vylučována v nezměněné formě nebo se do moči dostává řada lékových metabolitů, které mohou ovlivňovat chování sledovaného parametru v ledvinách. Léky a jejich metabolity mohou tak ovlivňovat stanovení kyseliny močové, porfyrinu, glukózy, bilirubinu a urobilinu. Při dosažení určité koncentrace léku v krvi může také dojít k interferenci s průběhem chemické reakce používané pro stanovení koncentrace sledovaného parametru. Tak při enzymovém stanovení glukózy v krvi falešně snižují její koncentraci kyselina askorbová nebo bilirubin. Dalším mechanismem lékových interferencí či spíše nežádoucím účinkem léku je jeho vlastní farmakologický účinek, kde pak dochází k sekundární změně hladin jiných sledovaných látek. Známým příkladem je změna koncentrace draslíku v krvi po podání thiazidových diuretik.
Ad c) Jedná se o klinicky signifikantní změnu?
Kromě biorytmů patří mezi další biologické faktory, které běžně ovlivňují biochemická vyšetření pohlaví, věk, tělesná zátěž, výživa, poloha těla při odběru krve a další preanalytické vlivy.
Pohlaví
Věk
Tělesná zátěž
Výživa
Tělesná poloha
Vzhledem ke vlivu řady faktorů na výsledek biochemického vyšetření jsou pro posouzení klinického stavu důležitější změny hodnot vyšetření prováděného opakovaně než výsledky jednorázového vyšetření.
Závěrem lze shrnout, že správná indikace a interpretace vede k co možná nejmenší duplikaci vyšetření, k nižší útratě (pacientových) peněz, nepřetěžuje přístrojovou a personální vybavenost laboratoře a zabraňuje ztrátě času lékaře.
Konzultace s laboratoří
Řada biochemických nálezů, např. vyšetření vnitřního prostředí, renálních funkcí, vyšetření dědičných poruch metabolismu, zahrnuje nejen kvantitativní stanovení určitých parametrů, ale též interpretaci nálezu, doporučení dalšího sledu vyšetření či návrh léčby. Jestliže ošetřující lékař poskytne relevantní klinickou informaci o pacientovi s uvedením diferenciálně diagnostického problému, lze poté dospět ke kvalitnější interpretaci biochemických vyšetření. Z těchto důvodů je konzultace v řadě případů velmi cenná. Pracovníci laboratoře mají aktivní zájem o pacienty, které vyšetřují. Vzájemná výměna informací a myšlenek je nejen v nejlepším zájmu pacienta, ale může též u řady zajímavých nálezů vést ke stimulaci výzkumu daného problému.
Doporučená literatura:
1. Definice funkce a význam sledování
"Dřívější pohled na jeho definici dával vyniknout anatomickému vymezení extracelulárního prostoru. Dnes hluboce oceňujeme i závěr definice, který prozíravě a od začátku správně definuje stálost vnitřního prostředí jako funkci všech základních změn". Toto ocenění uvádí ve své knize z r. 1980 "Vnitřní prostředí, klinická biochemie a praxe" prim. MUDr. B. Nejedlý,
který se jako první z našich klinických biochemiků touto problematikou zabýval a stal se tak učitelem jak
klinických biochemiků, tak anesteziologů a intenzivistů řady dalších lékařských oborů.
Organizmus představuje polootevřený systém, který komunikuje prostřednictvím vnitřního prostředí s prostředím zevním. Tato komunikace spočívá v transportu a příjmu kyslíku, živin, minerálů a dalších nezbytných látek, ve výdeji energie,
CO2, H2O a dalších odpadních produktů. Vnitřní prostředí umožňuje migraci buněk. Od zevního prostředí je odděleno kůží, sliznicemi a alveolární výstelkou. Vnitřní prostředí má spoluúčast na zajištění stability objemu
a průtoku tělesných tekutin, stability osmolality a iontového složení, stability aktivity H+ a stability teploty. Sledování
změn vnitřního prostředí má význam pro včasnou diagnostiku chorobných stavů, sledování kritických stavů, posuzování vhodnosti terapeutických postupů.
Tělesné tekutiny jsou krystaloidní a koloidní roztoky organických a anorganických látek. Tvoří jednak hlavní část buněčné fáze organizmu, intracelulární tekutinu, jednak tzv. extracelulární tekutinu. Tyto fáze jsou odděleny buněčnými membránami. Obě složky extracelulární tekutiny, tj. složka intravazální a intersticiální, jsou odděleny kapilární stěnou. Detailněji o rozdělení vody v organizmu - viz část 2. - Tělesná voda.
Při definování iontového a molekulového složení tělesných tekutin se rozeznává:
Koncentraci a hotovost je třeba chápat jako dynamickou rovnováhu mezi příjmem (input, I) a výdejem (output, O) látky. Stálost koncentrace je podmíněna vztahem I = O. V praxi disponujeme údajem o koncentraci, obrat odhadujeme z rozdílu mezi přísunem a odsunem látky, tj. z bilance.
Při sledování změn vnitřního prostředí, diagnostice jeho jednoduchých i smíšených poruch a sledování jejich léčby je zapotřebí používat komplexní přístup.
Sledujeme tyto tři skupiny informací:
Poznámky k indikaci a interpretaci biochemických vyšetření
Autor kapitoly: MUDr.Ivan Šebesta CSc., Ústav klinické biochemie VFN a 1.LF UK Praha
- a jejich správná interpretace .
- diagnóza,
- stanovení aktivity onemocnění a prognózy,
- monitorování průběhu nemoci nebo odpovědi na léčbu,
- detekce komplikací,
- screening,
- odhadnutí rizika onemocnění,
- epidemiologie,
- výzkum,
- stanovení výchozích hodnot pro zjištění budoucích změn.
- Ovlivní výsledek (hodnota biochemického parametru vyšší, nižší či v mezích normy) moji pracovní diagnózu?
- Ovlivní výsledek průběh léčby?
- Bude mít výsledek vliv na můj odhad pacientovy prognózy?
- Může patologický proces, po kterém pátrám, probíhat u pacienta bez klinických projevů? Jestliže ano, může být závažný a lze ho léčit?
Požadavky na vyšetření v intervalu kratším než 24 hodin jsou vzácné. Nicméně, v některých případech jsou vyšetření požadována častěji (např. pacienti na jednotkách intenzivní péče, monitorování terapie, glykémie u diabetiků a jiné).
Příklad: koncentrace plazmatického kalia se může rychle změnit po vyšší dávce diuretik. Zde je na místě vyšetřovat a podle výsledků změnit terapii.
- rychlost signifikantní změny biochemického parametru
Příklady: Koncentrace hlavních frakcí bílkovin v séru (elektroforéza proteinů séra) se s největší pravděpodobností nezmění v intervalu kratším než jeden týden. Plazmatická koncentrace urey nevykáže při oligurii signifikantní změnu v intervalu kratším než 12 hodin.
Interpretace laboratorních výsledků představuje nejobtížnější část zpracování biochemické informace. Je zcela zřejmé, že nelze vytvořit spolehlivý závěr ani z
jednoho izolovaného vyšetření, ani bez znalosti klinického stavu pacienta. Jednoznačné potvrzení či vyvrácení předběžné diagnózy jen na základě biochemického vyšetření není časté. Nejčastěji lze takto stanovit diagnózu např. u dědičných metabolických poruch, kde abnormální nahromadění metabolitu v důsledku genetického defektu vytváří pro řadu těchto onemocnění specifické biochemické markery .
b) Jestliže je výsledek abnormální, má diagnostickou hodnotu, nebo se jedná o nespecifický nález?
c) Při větším počtu vyšetření: jaký je trend změn a mají klinický význam?
K posouzení výsledků biochemického vyšetření slouží obvykle porovnání nálezu s referenčním rozmezím. Termín "normální hodnota" je nepřesný a nemá se užívat. Tyto "normální hodnoty" byly získávány dříve na malém počtu osob, které netvořily reprezentativní vzorek (např. studenti, vojáci).
Výsledky stanovení v plazmě či séru vyjadřují extracelulární koncentraci daného metabolitu (analytu), odpovídají tedy spíše poměrům v extracelulárním prostoru a nemusí vždy nezbytně odrážet situaci v celém organismu.
K interpretaci změn výsledků prováděných opakovaně a k rozhodnutí, zda se jedná o patologickou změnu biochemického vyšetření, je nutné vzít v úvahu též fyziologické variace hladiny daného analytu. Některé biochemické parametry vykazují pravidelné změny ve 24 hodinových, vícedenních, měsíčních či ročních periodách. Tyto pravidelné změny jsou označovány jako "intraindividuální variace". Rozdíl mezi hladinami plazmatického železa ráno a večer může být 30 až 50 %. Koncentrace lipidů, močoviny a aspartátaminotransferázy se může měnit až o 20 %. Diurnální variace u močové kyseliny činí zhruba 10 % s vyššími hodnotami ráno a nižšími večer. Kreatinin, cholesterol, kalium kolísají ze dne na den v rozsahu od 4 do 10 %.
Rozdílné hodnoty u mužů a žen vykazují nejen pohlavní hormony, ale např. i močová kyselina, železo, hemoglobin, haptoglobin, ceruloplasmin a gama-glutamyltransferáza (GMT). Hladiny kreatininu jsou vyšší u mužů vzhledem k většímu podílu svalové hmoty.
Některé parametry mají v dětském věku zcela jiné referenční rozmezí: katalytické koncentrace alkalické fosfatázy v séru jsou výrazně vyšší, hladiny kreatininu v krvi jsou u dětí naopak nižší. Se vzrůstajícím věkem stoupá hladina cholesterolu. Hladina kyseliny močové v krvi, která je u žen nižší než u mužů, se po menopauze zvyšuje a dosahuje stejné hodnoty jako mají muži.
Fyzická námaha zvyšuje aktivitu kreatinkinázy a ALT. Po zvýšené svalové aktivitě dochází ke změnám látek energetického metabolismu (laktát, glukóza, mastné kyseliny apod.) Mění se distribuce vody a nízkomolekulových látek mezi krevní cirkulací a intersticiem (makromolekulové látky se zahušťují). Při intenzivní tělesné zátěži dochází též ke zvýšení močové kyseliny v krvi.
Strava přijatá bezprostředně před vyšetřením má vliv na koncentraci plazmatického železa, Na+ a glukózy. Správná interpretace hladin glukózy v krvi je možná jen tehdy, jestliže byla krev odebrána na lačno či po určitém časovém intervalu po podání standardní dávky glukózy. Strava s vyšším obsahem bílkovin zvyšuje hladinu močoviny v krvi. Dieta bohatá na tuky zvyšuje hladinu triacylglycerolů. Banány mohou ovlivňovat vyšetření kyseliny homovanilmandlové v moči.
Vestoje je koncentrace vysokomolekulových látek (enzymy, lipidy vázané na bílkoviny, bílkoviny) vyšší o 10 až 15 % než vleže.
Klinické nálezy jsou základní informací o nemocném a správného stanovení diagnózy lze dosáhnout jen při vztažení výsledků biochemických vyšetření ke klinickému stavu pacienta. Z hlediska efektivního využití laboratoře je nutné zdůraznit účelnost vzájemné komunikace mezi ošetřujícím lékařem a lékařem v klinicko-biochemické laboratoři. V případě nejasností může ošetřující lékař během telefonické konzultace dostat přesné informace o typu biologického materiálu, způsobu transportu do laboratoře, instrukce k provedení zátěžového testu apod. Některá speciální vyšetření či zátěžové testy provádí laboratoř až po předchozí domluvě.
J. Masopust: Úvod do klinické biochemie, základy indikace a interpretace klinicko-biochemických vyšetření I-V. Učební texty, Univerzita Karlova, Praha 1988.
J. Masopust: Požadování a hodnocení biochemických vyšetření I,II. Účelová publikace ministerstva zdravotnictví ČR, sv. 216 a 217, Avicenum, Praha 1991
J. Musil: Základy biochemie chorobných procesů. Avicenum Praha 1991
A. Kazda: Biochemické monitorování nemocných v intenzivní a resuscitační péči. Avicenum, Praha 1986 2. vydání
Kolektiv: Lékařská chemie a biochemie. Učebnice pro lék. fakulty. Avicenum - Osveta 1991
C.A.Burtis, E.R.Ashwood: Tietz Textbook of Clinical Chemistry. Saunders W.B. Comp., Philadelphia 1994
R.Montgomery, T.W.Conway, A.A.Spector: Biochemistry - A Case Oriented Approach. C.V. Mosby Comp., 1990
N.W.Tietz, R.B.Conn, E.L.Pruden: Applied Laboratory Medicine.
W.B.Saunders Comp., Philadelphia 1992
S.Kessler: Memorix - Laboratorní diagnostika. Scientia Medica Praha 1993
R.N. Walmsley, L.R. Watkinson, E.S.C. Koay: Cases in Chemical Pathology - a diagnostic approach. World Scientific, 1992
J.Wallach: Interpretation of diagnostic tests. Little, Brown and Company, Boston/Toronto, 1986
P.Panndall, W.Marshall, A.Jabor, E.Madig: A Strategy to Promote the Rational Use of Laboratory Tests. Journal of the International Federation of Clin Chem (IFCC), 8, 1, 1996, 16-19.
Klinická biochemie vnitřního prostředí
Autor kapitoly: prof.MUDr.Antonín Kazda DrSc., Ústav klinické biochemie VFN a 1.LF UK Praha
"Co je vnitřní prostředí? Je to krev, ve skutečnosti však nikoli celá krev, nýbrž tekutá část krve, krevní plazma, všechny intersticiální tekutiny, zdroj a výslednice všech základních změn". Tuto definici napsal již v r. 1878 Claude Bernard.
1. Látková koncentrace (látkové množství rozpuštěné látky dělené objemem roztoku, jednotka mol/l), hmotnostní koncentrace (hmotnost rozpuštěné látky dělená objemem roztoku, jednotka kg/l, užívá se tam, kde Mr látky není známa), molalita (látkové množství rozpuštěné látky dělené hmotností samotného rozpouštědla, jednotka mol/kg) a některé další méně časté veličiny koncentrace.
2. Hotovost (zásoba, pool) látky, buď v celém organizmu nebo v jednotlivých oddílech tělesných tekutin.
3. Obrat (turnover), což je množství látky, které proteče distribučním prostorem za časovou jednotku.
1. Anamnézu. Je zaměřená na zdravotní stav především z hlediska předchozího postižení kardiovaskulárního aparátu, respiračních, renálních a jaterních funkcí, na metabolická onemocnění, především diabetes mellitus a na medikamentózní léčbu, především steroidy a diuretiky. Dále nás zajímá příjem živin, tekutin, změny tělesné hmotnosti. Délka nynějšího onemocnění, teploty, patologické ztráty tekutin a iontů (zvracení, průjmy) a jejich úhrada. Údaje o žízni, pocení a zejména a diuréze.
2. Somatické vyšetření. Je zaměřeno na stav hydratace (turgor kůže, sliznice, tonus bulbů), retenci tekutin (edémy, ascites a pod.), TK, puls, oběhové poměry, náplň krčních žil, centrální žilní tlak.
3. Laboratorní parametry
glykémie |
glykémie |
aniontová mezera* reziduální anionty* |
celk. bílk., albumin osmolalita, Na, K, Cl, ev. Ca laktát, amylázy dle potř. |
Ca, P, Mg |
index moč/krev pro ureu, kreatinin, osmolalitu |
glykozurie osmolalita Na, K, Cl amylázy dle potřeby |
glykozurie osmolalita Na, K, Cl odpady |
index Na/K moč clearance kreat. osmol., bezsol. vody frakční exkrece Na, K, vody, osm. |
Optimální je, můžeme-li koncentrace iontů ve ztrácených tělesných tekutinách měřit. Pokud je to vzhledem k jejich povaze obtížné nebo je to z jiných technických důvodů neproveditelné, spokojujeme se s odhady. Koncentrace elektrolytů a možné objemy ztrát gastrointestinálních a dalších tekutin jsou uvedeny v tab. 2.1. (pH žaludeční šťávy se pohybuje od hodnot 1 až 2 k vyšším, při anaciditě je pH nad 6).
mmol/l | mmol/l | mmol/l | mmol/l | ml/d |
|
|---|---|---|---|---|---|
silně kyselá | (10-30) | (5-40) | (80-150) | ||
málo kyselá | (70-140) | (5-40) | (40-120) | ||
(115-180) | (3-8) | (55-95) | (60-110) | ||
(130-160) | (3-12) | (90-120) | (30-40) | ||
drenáž | (80-150) | (2-8) | (60-125) | (20-40) | |
střevo, cékum | (40-135) | (5-30) | (20-90) | (20-40) | |
stolice | (20-160) | (10-40) | (340-120) | (30-50) | |
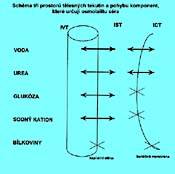
2. Tělesná voda
Průměrný podíl celkové tělesné vody (CTV) na tělesné hmotnosti (CTH):
Korekce na obezitu: u obézních tvoří tuková tkáň relativně větší podíl na CTH, u hubených relativně menší. Proto je nutno počítat u obézních s nižším podílem CTV na CTH, u hubených naopak s vyšším podílem. Např. u velmi obézních mužů je to 54%, u hubených až 68%. V praxi počítáme CTV nejčastěji jako 60% CTH.
CTV je rozdělena do těchto prostorů tělesných tekutin:
Intracelulární tekutina (ICT). Obecně se předpokládá, že tvoří 40% CTH, z toho asi množství odpovídající 30 až 35% CTH je v měkkých tkáních, především svalů. Zbytek, tj. množství odpovídající 8 až 10% CTH, je v pojivu, v chrupavkách a v kostech.
Extracelulární tekutina (ECT) tvoří 20% CTH. Její objem se u kriticky nemocných může velmi rychle měnit. Dělí se na intersticiální a intravaskulární tekutinu.
Intersticiální tekutina (IST) tvoří 10 až 15% CTH. Zajišťuje výměnu látek mezi buňkou a zevním prostředím. Buňky trpí při jejím nedostatku i nadbytku zhoršením této výměny. Iontové složení je podobné jako v plazmě, s výjimkou malé koncentrace bílkovin a větší koncentrace Cl-.
Intravazální tekutina (IVT). Plazma obsahuje vodu, představující 3,5-5% CTH.
Transcelulární tekutina. Patří k ní cerebrospinální mok, kloubní tekutina a tekutina v trávicím ústrojí. Nelze ji počítat k žádné ze složek ECT (tj. ani k IST ani k IVT). Celkové množství zpravidla nepřesahuje 500 ml, ale po jídle stoupá na 2 až 3 litry.
Tekutiny ve třetím prostoru. Vyskytují se jen za patologických situací, funkčně je nelze řadit ani k ECT ani k ICT. Patří sem např. patologické hromadění tekutin při ileu, kdy se může v lumen střev nahromadit 8 až 10 litrů tekutin. Při peritonitidě se může jednat o uložení 5 až 8 litrů tekutin v peritoneu. Patří sem i traumatický edém nebo ascitická tekutina.
Iontové složení IVT a IST je téměř shodné - viz tabulku 2.2. IST představuje ultrafiltrát krevní plazmy s minimem bílkovin. Aby byla i v IST zachována elektroneutralita v nepřítomnosti bílkovin, musí se ustavit nová (tzv. Gibbsova-Donnanova) rovnováha. Proto je koncentrace aniontů (Cl-, HCO3-) v IST vyšší než v plazmě a koncentrace Na+ naopak lehce nižší. To se v tab. 2.2 neprojevuje, protože koncentrace Na+ (141 mmol/l) je uvažována v plazmě s obsahem cca 6% bílkovin. Vodní fáze, v níž je Na+ rozpuštěn, zde tvoří 94%. Ve vodní fázi samotné by pak jeho koncentrace byla vyšší. Koncentrace Na+ v IST (143 mmol/l) která představuje fakticky jen vodní fázi, je pak proti IVT ve skutečnosti nižší (Tab. 2.2).
mmol/l | mmol/l | mmol/l |
|
|---|---|---|---|
Složení intracelulární tekutiny je v jednotlivých tkáních odlišné, tabulka předkládá její nejčastěji uváděnou iontovou skladbu a umožňuje posoudit základní rozdíly proti extracelulární tekutině.
Hodnocení diurézy má pro posuzování vnitřního prostředí základní význam. Jako oligurii označujeme objem moči 50-500 ml/d, jako polyurii označujeme objem nad 3000 ml/d. Většina hypermetabolických nemocných má diurézu kolem 3000 ml/d a vyšší. Je to dáno hyperkinetickým oběhem např. v sepsi, který intenzivista větším příjmem tekutin respektuje. Navíc se může uplatnit časté forsírování diurézy, nutnost vyloučit vysokou katabolickou nálož, a to někdy za podmínek, kdy ledvina není schopna adekvátně koncentrovat např. pro poškozený dřeňový gradient po hypoxických stavech nebo po intenzívní léčbě diuretiky. O adekvátnosti diurézy se přesvědčujeme nejen hodnocením stavu hydratace a oběhových poměrů, ale i osmolality tělesných tekutin. Je-li diuréza vzhledem k osmotické náloži a stavu renálních funkcí nedostatečná, nemocný se stává hyperosmolálním, přestože podle běžných kritérií močí dostatečně nebo více než dostatečně.
Při oligoanurických stavech je diuréza sledována v hodinových intervalech. Polyurie nekrytá dostatečným přívodem tekutin ohrožuje nemocného nedostatkem vody a bezprostředně ohrožuje i základní životní funkce. Současně s objemem moči je nutno kontrolovat hustotu moči a v indikovaných případech její osmolalitu. Zjišťují se denní ztráty iontů, především Na+ a K+, v indikovaných případech i Cl, s menší frekvencí i Mg, Ca a P. Při současné acidobázické poruše je vhodné I vyšetření pH moči. Informace o chemickém vyšetření (proteinurie, glykozurie a další) a o mikroskopickém vyšetření moče jsou u oligurických nemocných samozřejmé. Vyšetření ledvin doplňuje denní sledování S-urey a S-kreatininu. V akutních stavech je vhodné je doplnit sledováním některých clearancových vyšetření (clearance kreatininu, clearance bezsolutové vody) a frakčních exkrecí (natria, kalia, vody, osmolální).
3. Osmolalita
Někdy jsou uváděny rozdíly pro hodnoty v séru mezi oběma pohlavími, pro ženy v dolní, pro muže v horní polovině normy. Rozdíly ve vylučování osmoticky aktivních látek močí jsou uvedeny dále. Osmolalita séra je udržována v poměrně úzkých mezích. Při jejím zvýšení nad 278 (variace 277 až 282) se začíná zvyšovat sekrece vasopresinu. Ta pak stoupá plynule až do osmolality 296 až 298 mmol/kg, kdy je sekrece maximální. Současně se progresivně zvyšuje osmotická koncentrace moči. Další patologické zvyšování osmolality už sekreci vasopresinu nezvyšuje. Jinou stimulací sekrece vasopresinu je pokles cirkulujícího objemu o 10 až 20% nebo pokles krevního tlaku nejméně o 5%. Antidiuréza se pak uplatňuje i u stavů normo- či hypoosmolálních. Vylučování denní osmotické málože močí může někdy i za fyziologických okolností překročit výše uvedený interval. U zdravých osob se zvýšeným příjmem soli a bílkovin a s vysokou fyzickou aktivitou mohou být hodnoty vyšší než je nahoře uvedeno a mohou přesáhnout i 1500 mmol/d. Při nízkém příjmu bílkovin a v tělesném klidu u hospitalizovaných nekatabolických osob jsou naopak uváděny ztráty pod 600 mmol/d.
Pro ilustraci uveďme typické průměrné hodnoty koncentrací močí a rozsahy
vylučování osmoticky aktivních látek:
Referenční interval
sérum: 275 - 295 mmol/kg H2O
moč: 600 - 1200 mmol/d
mmol/kg H2O | mmol/d |
|
|---|---|---|
O osmolalitě séra (plazmy) rozhoduje především Na+ a jemu odpovídající anionty, dále urea, glukóza a v malé míře bílkoviny. Podíl urey se stává významnějším až s její retencí, podíl glykémie roste s dekompenzací diabetika nebo při intoleranci glukózy u kriticky nemocných. Podíl bílkovin, tzv. koloidně osmotický tlak, je významný pro udržení cirkulujících tekutin v cévním řečišti. Obr. 2.1 znázorňuje schématicky 3 prostory tělesných tekutin, oddělených membránami (kapilární stěna, buněčná membrána). Je znázorněn průnik komponent, podílejících se na osmolalitě plazmy, těmito membránami.

Kromě sledování vylučovaného množství osmoticky aktivních látek je užitečné sledovat i jejich koncentraci v moči. Umožňuje to posoudit současné koncentrační úsilí ledvin v porovnání s osmolalitou séra (plazmy). Je to jeden ze základních parametrů, sloužících k diferenciální diagnóze prerenální nebo renální příčiny oligoanurického stavu. Poměr U-osm/P-osm při prerenálním selhání je nad 1,5 a při renálním pod 1,1. Při hodnocení osmotické koncentrace moči je samozřejmě nutno respektovat i pokles koncentrační schopnosti v závislosti na věku nemocných. Sledování močové a plazmatické osmolality za podmínek dehydratace s následným podáním vasopresinu slouží k diferenciální diagnóze příčin hypotonické polyurie. Její příčinou může být diabetes insipidus centrální, psychogenní (dypsogenní) nebo nefrogenní.
Efektivní osmotický tlak
Tím, že urea prochází volně oběma membránami (obr. 2.1), nevede její zvýšení např. v intravazálním prostoru ke tvorbě trvalejšího gradientu mezi prostorami tělesných tekutin, který by způsobil přesun vody mezi nimi za účelem opětného dosažení rovnovážného stavu osmolality. Jestliže se ale zvýší v ECT glykémie (ať u diabetika nebo rychlou infúzí nekrytou adekvátně inzulínem), zvýší se efektivní osmotický tlak v tomto prostoru. To vede k přesouvání vody z ICT tak dlouho, až je opět dosaženo osmotické rovnováhy mezi ECT a ICT. Samozřejmě, že v ECT se přitom ředí další komponenty, např. natrémie klesá o 1,5 mmol/l na každé zvýšení glykémie o 5,5 mmol/l.
Podobná situace s uplatněním efektivní osmolality nastává i při přívodu solí natria při korekci hyponatrémie. Našim cílem je zvýšení koncentrace Na+ v ECT. Přesto se ve výpočtech (viz níže) pracuje s tím, jako bychom Na+ přidávali do CTV. Jeho přidání do IVT resp. ECT vede ke vzniku osmotického gradientu oproti ICT. Reakcí je částečný přesun vody do ECT.
Bílkoviny a polysacharidy (obr. 2.1) membránami neprocházejí, a proto budou i polysacharidové náhradní koloidní roztoky (dextran, hydroxyetylškrob) distribuovány rovněž jen v prostoru IVT. Do něj se bude po jejich infúzích přesouvat voda jak z IST, tak z nitrobuněčného prostoru.
Měření a výpočet osmolality, osmolal gap
Osmolalitu v laboratořích měříme na osmometrech. Jednotkou je mmol/kg H2O. Lze ji také odhadnout výpočtem z koncentrací Na, urey a glykémie (v hranatých závorkách):
osmolalita mmol/kg H2O = 2 [Na] mmol/l + [urea] mmol/l + [glykémie] mmol/l.
Obě hodnoty se běžně shodují, resp. liší pouze v intervalu do 5, maximálně 10 mmol/kg H2O. Porovnání výpočtu s měřením je užitečné tam, kde je podezření na přítomnost látek o malé molekule, s nimiž výpočet samozřejmě nepočítá. Měření potom může být vyšší než výpočet třeba o 50 až 100 mmol/kg H2O. Hovoříme potom o osmolální mezeře (osmolal gap). Např. 1o/oo alkoholu v plazmě zvýší naměřenou osmolalitu o cca 23 mmol/kg H2O.
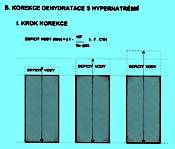
4. Hyperosmolální a hypoosmolální stavy
Poněkud jinak je tomu v akutním katabolismu, tj. v šoku. Příčinou hyperosmolality je zde nahromadění metabolických meziproduktů v buňkách. Pro poruchu energetiky nemohou být metabolizovány na konečné produkty ani uvolňovány z tkání. Výsledkem je hyperosmolalita v ICT proti ECT, vedoucí k přesunu vody do buněk. Snížení objemu ECT zhorší oběhové poměry často již dříve primárně postižené.
V intenzívní péči může vzniknout akutní hyperosmolalita i iatrogenně. Mezi příčinami je např. špatné dávkování parenterální výživy, dialýza hyperosmolálním roztokem, vysoké dávky NaHCO3 při kardiální resuscitaci, transdermální absorpce propylenglykolu při léčbě popálenin nebo osmoterapie glycerolem či dalšími látkami o malé molekule. V posledně uvedených situacích vzniká výrazný rozdíl mezi měřenou a vypočítanou osmolalitou (osmolal gap), který se může pohybovat mezi 100 až 150 mmol/kg!
Klinicky vedou hyper- i hypoosmolalita bez ohledu na příčiny k příznakům metabolické encefalopatie, jejíž patofyziologický základ je v difuzních neuronálních funkčních poruchách s event. ložiskovým maximem. Jde o stavy od mírných neuropsychických poruch spojených s nespecifickými motorickými symptomy až k deliriu a nakonec kómatu. Vývoj hyperosmolálního stavu provázejí zmatenost a halucinace, které jsou někdy u starších lidí mylně považovány za projevy sklerózy mozkových cév. Typická je žízeň a bolesti hlavy. U starších osob jsou i za normálních okolností patrně změněny některé faktory, kontrolující vodní bilanci. Je snížen pocit žízně, zvyšuje se osmoregulační sekrece vasopresinu, ale renální odpověď na něj je otupena.
Při hypernatrémii může vzniknout hemorhagická encefalopatie. V likvoru je počet buněk normální, koncentrace bílkovin je nad 0,5 g/l, zbarvení CSF je xanthochromní nebo krvavé při hemorhagiích. EEG prokazuje nespecifické změny nebo ložiskové změny při krvácení, počítačová tomografie ukáže zmenšení objemu mozku, event. hemorhagii. Při přetrvávání akutně vzniklé hyperosmolality zvyšují mozkové buňky jako kompenzační mechanismus obsah osmoticky aktivních částic. To jim umožní doplnit objem na původní. Povaha těchto částic byla dlouho zčásti neznámá, byly nazývány idiogenní milimoly. V poslední době bylo zjištěno, že jde o více organických sloučenin (polyoly, aminokyseliny, aminy, cholinové sloučeniny, fosfokreatinin). Již dříve bylo uváděno i zvýšení obsahu anorganických iontů a glukózy při hyperglykémiích. V experimentu k tomuto vývoji dochází při hyperglykémii a hypernatrémii již během prvních hodin, dle jiných při hypernatrémii až během týdne. Klinické příznaky vznikají při akutním zvýšení natrémie nad 150 mmol/l a osmolality nad 310 mmol/kg H2O. Při chronickém stavu je to až při natrémii nad 160 mmol/l a při osmolalitě nad 330 mmol/kg H2O.
4.2 Hypoosmolalita
Klinicky je vývoj hypoosmolálních stavů provázen slabostí, nevolností, apatií a opět bolestmi hlavy. Vzniká difuzní edém mozku a nebezpečí herniace kmene mozkového, bílkovina v likvoru je nízká pod 0,1 g/l. EEG prokáže nespecifické, event. epileptiformní změny, počítačová tomografie prokáže difuzní edém mozku.
Pokles natrémie a osmolality se klinicky manifestuje v akutních stavech při hodnotách natrémie pod 125 mmol/l, resp. osmolality pod 265 mmol/kg H2O. Při chronických stavech jsou odpovídající hodnoty opět extrémnější, pro natrémii pod 120 mmol/l a pro osmolalitu pod 250 mmol/kg H2O. Při přetrvávání akutně vzniklé hypoosmolality se kompenzačně snižuje počet osmoticky aktivních částic v mozkových buňkách, což brání jejich edému. Jde o částice popisované již v případě hyperosmolality, v tomto případě se ale jejich počet naopak snižuje.
Extrémní hodnoty osmolality. Nejnižší publikované hodnoty vůbec byly pod 200 mmol/kg H2O při léčbě thiazidovými diuretiky a neslanou dietou. Nejnižší osmolalita séra, kterou jsme sami naměřili, byla 213 mmol/kg H2O u nemocného s morbus Addison. Měl průjmy léčené zpočátku nesprávně roztoky glukózy. Jeho natrémie klesla na 98 mmol/l. Hyperosmolality nad 500 mmol/kg H2O byly popsány u dvou nemocných s kombinovanou otravou etyl- a metylalkoholem.
4.3 Korekce poruch osmolality
V důsledku hypoosmolálních stavů je popisována demyelinizace v CNS, původně v oblasti mostu, později i jinde. Jejími následky jsou pseudobulbární ochrnutí, chabé kvadruplegie, zhoršení citlivosti. Dosud není jasné, zda za stav je zodpovědná samotná hypoosmolalita nebo rychlost její úpravy. Proto se u hypoosmolality doporučuje postupovat zvlášť opatrně. Nahoře uvedená rychlost úpravy platí jen u akutně vzniklých stavů vzápětí léčených. Po dosažení natrémie 120 mmol/l je nutno zmírnit rychlost na 0,5 až 0,6 mmol/kg.hod-1. Důvodem k opatrnosti a k monitorování biochemických nálezů jsou výše uvedené změny v oblasti mozku, kdy se při prudší úpravě může právě pro kompenzační změny mozkových buněk jejich velikost prudce měnit a klinický stav nemocného zhoršit. Např. zvýšení počtu osmoticky aktivních částic za stavu hyperosmolality s dehydratací vede při poklesu osmolality ECT během léčby k prudkému přesunu vody do mozkových buněk a k příznakům nitrolební hypertenze. Při odstranění hypoosmolality je tomu zcela naopak. Počet částic v mozkových buňkách se kompenzačně snížil. Zvyšování osmolality ECT vede pak k prudkému poklesu objemu buněk CNS.
Ke každému nemocnému je nutno přistupovat individuálně a pouze monitorování jak biochemického, tak i klinického stavu je směrodatné pro posouzení úměrnosti léčby.
5. Poruchy vodního a iontového hospodářství
Referenční meze:
Celková zásoba Na+ u muže vážícího 70 kg činí asi 3700 až 4000 mmol. Z toho asi 30 % ( 1100 - 1200 mmol ) je nesměnitelný podíl uložený v kostech a v buněčných strukturách. Extracelulární zásoba je 1800 až 2000 mmol, směnitelná celulární zásoba je kolem 1000 mmol. Interpretaci nálezů natrémie a úvahu o vhodné korekční dávce Na+ nebo/a vody může usnadnit rozdělení poruch vodního a solného metabolismu, předložené v dalším textu. Jsou uváděna schematická znázornění jednotlivých poruch, která vždy vycházejí z fyziologických poměrů jak objemu ECT, tak i zásoby Na+ v ní. Schémata upozorňují i na přesuny vody mezi prostorami tělesných tekutin, k nimž dochází při vzniku osmotického gradientu při zvýšení nebo snížení osmolality v některém z těchto prostorů.
Předpoklady hodnocení poruch vodního a iontového metabolismu
Dělení poruch vodního a iontového hospodářství
V dalším textu budou předložena schémata základních poruch vodního nebo solného hospodářství. Jsou uspořádána tak, že vlevo je vždy fyziologická situace velikosti ECT a zásoby Na, v dalších sloupcích potom patologická situace, event. její alternativy a konečně korekce. Tam, kde dochází v důsledku změn efektivní osmolality k přesunu vody mezi ICT a ECT, je to vyznačeno.
5.1.1 Fyziologická hydratace s natrémií v referenčních mezích.
5.1.2 Fyziologická hydratace s hyponatrémií (obr. 2.2a).
Akutní stavy
Korekce: u asymptomatických stavů stačí zpravidla izotonické solné roztoky. U symptomatických hyponatrémií se přivádí Na+ formou hyperosmolálních roztoků podle výpočtu:
(rovnice 1)
4.1 Hyperosmolalita
Příčinou hyperosmolality může být ztráta prosté vody, akutní katabolismus, diabetické kóma, hyperosmolální kóma bez acidózy, popáleniny, často selhání ledvin, těžké sepse, akutní intoxikace látkami o malé molekule, diabetes insipidus, nefrogenní diabetes insipidus a tonutí ve slané vodě. Patobiochemicky je u většiny těchto stavů v popředí zvýšení efektivní osmolality v ECT a přesun vody z IC do EC prostoru.
Příčinami hypoosmolality jsou metabolická odpověď na trauma, nadbytek celkové vody, úhrada ztrát izotonické tekutiny vodou, chronický katabolismus, tonutí ve sladké vodě, nepřiměřená sekrece ADH.
Korekce poruch osmolality má obecně probíhat pomalu tak, aby se osmolalita neměnila prudčeji než o 2 až 4 mmol/kg.hod-1 resp. natrémie o 1 až 2 mmol/hod. a aby celková změna za 24 hodin nebyla větší než 20 až 30 mmol/kg H2O.
5.1 Natrium
plazma 132 - 142 mmol/l
moč 120 - 140 mmol/l.
1. Znalost aktuální tělesné hmotnosti a její porovnání s běžnou (standardní) hmotností nemocného. Protože nemocné na většině jednotek intenzívní péče a resuscitačních stanic vážit nelze, je nutno se spokojit s odhadem běžné hmotnosti. Posouzení akutně vzniklé změny: při klinicky zřejmé dehydrataci se uvažuje deficit tekutin v rozsahu 2,5 až 5,0 % běžné tělesné hmotnosti, při hyperhydrataci je to nadbytek tekutin v rozsahu 2,5 až 7,5 % hmotnosti. Takže, když např. u 70 kg dehydratovaného nemocného odhadneme úbytek tělesné hmotnosti na 5 %, počítáme s deficitem 3,5 litru, který nutno korigovat. Kritériem správnosti tohoto odhadu je klinická reakce nemocného na léčbu (stav hydratace, diuréza) i úprava laboratorních parametrů.
Příznaky dehydratace: snížený turgor kůže, suché sliznice, "hadrovité" bulby, snížená náplň žil, oligurie, nízký centrální žilní tlak.
Příznaky hyperhydratace: zvýšený turgor kůže, i lehké kabely od monitorů zanechávají otisk na kůži, je zvýšená náplň žil i centrální žilní tlak, stoupá hmotnost, začínají otoky.
2. Výpočty terapeutických dávek Na+, které vycházejí z natrémie, je nutno posuzovat v širších souvislostech. Jejich validita závisí nejen na absolutní koncentraci Na+, ale i na jeho zásobě a na vztahu mezi touto zásobou a velikostí ECT a sekundárně i ICT.
Stav hydratace se hodnotí klinicky a podle toho se nemocní dělí na tři skupiny: s hydratací fyziologickou, s dehydratací a s hyperhydratací. Ve všech těchto skupinách může být zjištěná natrémie jak v referenčním intervalu, tak i hyponatrémie nebo hypernatrémie.
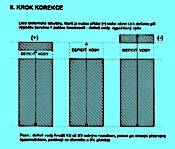
Terapeutické dávky vody a solí jsou tvořeny dvěma složkami: korekční a substituční.
Korekční: Jedná se o dávky, které upravují stávající deficity v organizmu. Následující popisy jednotlivých situací jsou zakončeny výpočty nebo úvahami právě o dávkách korekčních.
Substituční: Jde o dávky, kterými hradíme měřitelné i neměřitelné ztráty z organismu. Jde o logické součty, které při určení celkové dávky přičítáme k dávkám korekčním. Nevyžadují žádné zvláštní výpočty a další text se jimi nezabývá.
U nemocných s nálezy natrémie v referenčních mezích a s fyziologickou hydratací se provádí pouze substituce renálních a extrarenálních ztrát.
Hmotnost je nezměněná, klesla zásoba Na+ v ECT. Situace vzniká jednak u akutních, jednak u chronických stavů.
Ztráty vody a iontů byly hrazeny infúzemi glukózy nebo pitím vody. Vznikající hypoosmolalita ECT vedla k přesunu části vody z ECT do ICT.
Na+cílové = hodnota na poloviční vzdálenosti mezi zjištěnou hyponatrémií a referenční hodnotou 137 mmol/l. Úprava natrémie nemá být rychlejší než o 0,5 až 0,6 mmol/l hod. Pouze u akutně vzniklé hyponatrémie může být rychlejší do hodnoty 120 mmol/l (viz nahoře - část o korekcích poruch osmolality).
F = faktor pro výpočet distribučního prostoru, u mužů F = 0,6, u žen 0,55.
CTH = standardní (běžná) hmotnost nemocného v kg.
Po podání natria dochází ke změnám distribučního prostoru natria, část vody se vždy přesune z ICT do ECT. Při extrémních hyponatrémiích jsou takto určené dávky značně vysoké. Potom volíme s ohledem na klinický stav hodnoty faktoru nebo cílové natrémie nižší (např. jen o 5 vyšší než je zjištěná) a dle laboratorní kontroly po podání dávky Na potom korekci doplníme.
Chronické stavy
Vleklý katabolismus vede k atrofii buněčných struktur, a tím k poklesu tonicity buněk. Část vody se přesune z ICT do ECT. Bývá hypoosmolalita, hyponatrémie, hypoproteinémie.
Korekce: přísun Na+ situaci neřeší, zvýší pouze jeho vylučování. Terapie musí být kauzální + zajištění energetického příjmu. Na+ resp. jeho soli podávat pouze při symptomatické hyponatrémii a s ohledem na klinický stav!
Poznámka:
U metody plamenové fotometrie, která se někde používá ke stanovení natria, je změřená natrémie závislá na obsahu bílkovin a lipidů v plazmě. Tam, kde se jejich hodnoty patologicky zvyšují, se změřená natrémie falešně snižuje. Hovoří se o tzv. pseudohyponatrémii.
Korekce: je možno provést dva výpočty, ale oba mají hodnotu pouze teoretickou. Je to výpočet nadbytku natria a "deficitu" tekutin:
(rovnice 2)
 5.1.3 Fyziologická hydratace s hypernatrémií (obr. 2.2b)
5.1.3 Fyziologická hydratace s hypernatrémií (obr. 2.2b)
Hmotnost je nezměněná, zvýšila se zásoba Na+ v ECT. Dochází k přesunu vody z ICT do ECT.
| nadbytek natria (mmol/l) = CTH . F . ( 1 - | 137 | . 137 |
| ---------- ) | ||
| Na+zjištěné |
(rovnice 3)
| "deficit" H2O (litry) = CTH . F . ( | Na+zjištěné | - 1) |
| ---------- | ||
| 137 |
Symbolika - viz rovnice 1, hodnota faktoru F je v tomto případě vždy 0,2. Podání vypočteného množství tekutin by vedlo sice k úpravě natrémie, ale zároveň k hyperhydrataci. Podávají se diuretika a infúze 5 % glukózy.
Korekce: nálezy natrémie nelze užít k výpočtům potřebného množství tekutin. Podává se takové množství izotonických solných roztoků, které je úměrné rozdílu hmotnosti běžné a aktuální. Protože se podaná tekutina bude distribuovat prakticky jen v ECT, podává se s ohledem na možné zatížení oběhu v indikovaných případech pouze 2/3 vypočteného množství, zbytek se doplňuje podle reakce nemocného.
Pozor! Zde jde často o stavy s trvající značnou ztrátou víceméně izotonické tekutiny (žaludeční šťávy, průjmy). Proto zde bude i substituční dávka solných roztoků vysoká.
Korekce: úplná náhrada deficitu vody a Na+ má dvě části. První je doplnění chybějících tekutin solnými roztoky. Pro jejich množství je určující pokles hmotnosti nebo jeho odhad. Také v tomto případě se při úvaze o iniciální korekční dávce uvažují zpravidla 2/3 chybějícího množství izotonických tekutin. Druhou je úprava zjištěné hyponatrémie s určením cílového Na+ a výpočtem dle rovnice 1. Patologické mechanismy se ale upravují většinou izotonickými solemi a korekce koncentrovanými solemi není potom nutná.
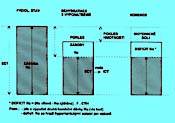
5.1.6 Dehydratace s hypernatrémií (obr. 2.4 A)
Ve všech případech vzniká přesun vody z ICT do ECT, úměrný osmotickému gradientu. Korekce musí mít dva kroky.
První z nich je na obrázku 2.4 B a znázorňuje, jak se liší vypočítané množství deficitu prosté vody od skutečného deficitu hmotnosti.
Výpočet deficitu prosté vody:
(rovnice 4)
 5.1.4 Dehydratace s natrémií v referenčním intervalu (obr. 2.3a)
5.1.4 Dehydratace s natrémií v referenčním intervalu (obr. 2.3a)
Hmotnost je snížená, stejně tak klesla i zásoba Na+. Nedochází k přesunu vody mezi ICT a ECT. Tento stav je zvlášť nebezpečný tím, že celá ztráta postihuje jen ECT, hrozí brzy oběhový kolaps, oligurie a metabolická acidóza.
 5.1.5 Dehydratace s hyponatrémií (obr. 2.3b)
5.1.5 Dehydratace s hyponatrémií (obr. 2.3b)
Hmotnost je snížená, zásoba Na+ v ECT relativně ještě více. Dochází k přesunu vody z ECT do ICT. Tím více hrozí klinické a metabolické komplikace popsané v situaci předcházející.

Obr. 2.4 A ukazuje tři možné situace, u nichž je klinický nález dehydratace provázen hypernatrémií. Pokles hmotnosti může být provázen:
a) relativně menším snížením zásoby natria (chybí prostá voda, ale současně i izotonická tekutina), levý sloupec
b) nezměněnou fyziologickou zásobou natria (chybí pouze prostá voda), prostřední sloupec
c) zvýšenou zásobou natria (chybí prostá voda při současném nadbytku natria), pravý sloupec
| deficit H2O (litry) = CTH . F . ( 1 - | 137 |
| ---------- ) | |
| Na+zjištěné |
Jsou tři možnosti vztahu vypočítaného deficitu prosté vody ke zjištěnému úbytku hmotnosti:
a) K úhradě zbývá ještě ta část tekutin, kterou určuje vztah:
chybějící množství izotonických tekutin = hmotnost běžná - (hmotnost aktuální + vypočítaný deficit H2O).
b) Je souhlas:
hmotnost běžná = hmotnost aktuální + vypočítaný deficit H2O.
c) Pomocí zjištěné natrémie vypočítáme takový deficit vody, že její dodání by převýšilo běžnou tělesnou hmotnost:
hmotnost běžná < hmotnost aktuální + vypočítaný deficit H2O.
Proto korekce vyžaduje ještě druhý krok, při němž uvedené rozdíly respektujeme - obr. 2.4 C.
ad a) Je dodáno množství izotonických tekutin chybějící do dosažení běžné hmotnosti.
ad c) Je dodáno jen takové množství, aby nebyla překročena běžná hmotnost.
Deficit vody je hrazen 1/2 až 2/3 solným roztokem, ale čím vyšší je natrémie, tím opatrněji je nutno postupovat. V těch případech jsou i izotonické roztoky z hlediska osmolality vnitřního prostředí hypotonické a poruchu nenásilně korigují. Pouze v případě, kdy po zajištění adekvátní hydratace a dosažení běžné hmotnosti přetrvává hypernatrémie (ad c), se doporučuje podat infúze 5 % glukózy s diuretiky při kontrole natrémie resp. osmolality.
5.1.7 Hyperhydratace s normonatrémií (obr. 2.5)
Korekce: jedině znalost rozdílu mezi běžnou a aktuální hmotností objektivizuje množství tekutin, které je nutno vyloučit. Jinak je třeba se řídit stavem hydratace. Zastavuje se příjem solných roztoků, podávají se diuretika a kardiotonika.
Ve všech případech vzniká přesun vody z ECT do ICT úměrný osmotickému gradientu. Situace vzniká jednak u akutních, jednak u chronických stavů.
U akutních stavů hovoříme o intoxikaci vodou. Kromě vlastního převodnění se jako podpůrné vlivy mohou uplatnit léky s antidiuretickým účinkem a endokrinní vlivy (oxytocin, ADH).
Korekce: zastavení příjmu vody. U symptomatických stavů se určí cílová natrémie a provede výpočet dávky Na+ podle již známé rovnice č. 1. Potřebné dávky Na+ zde budou ovšem zpravidla vyšší. Korekce poruchy za dobu kratší než 12 až 24 hodin je příliš rychlá. Nebezpečí oběhového přetížení je zvýšeno zejména u starých osob a při kardiovaskulárním onemocnění.
U chronických stavů se jedná nejčastěji o edematózní nemocné - buď kardiaky, cirhotiky, pacienty s nefrotickým syndromem nebo v těžké malnutrici.
Korekce: posuzuje se závažnost hyponatrémie, která je asymptomatická do nižších hodnot než u akutních stavů (viz nahoře). Užití hypertonických solí proto prakticky nepřichází v úvahu. Terapie usiluje především o dosažení negativní vodní bilance, forsírované jak snahou o zlepšené prokrvení ledvin, tak diuretiky.
Korekce: je možno vypočítat nadbytek Na+. Výpočet zachytí ovšem jen tu část zvýšení zásoby Na+, která není kryta zvýšením zásoby vody:
(rovnice 5)
Hmotnost je zvýšená. Došlo ke zvýšení zásoby vody i iontů v poměru, v němž jsou fyziologicky v ECT. Nevzniká osmotický gradient mezi ECT a ICT a není důvod k přesunu tekutin mezi těmito prostorami.
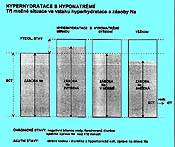 5.1.8 Hyperhydratace s hyponatrémií (obr. 2.6)
5.1.8 Hyperhydratace s hyponatrémií (obr. 2.6)
Podobně jako u dehydratace s hypernatrémií mohou i zde vznikat tři možné situace, u nichž je klinický nález hyperhydratace provázen hyponatrémií. Zvýšení hmotnosti může být provázeno
a) relativně menším zvýšením zásoby Na+ (nadbytek hypotonických tekutin),
b) nezměněnou, fyziologickou zásobou Na+,
c) zmenšením zásoby Na+ (ztráty ECT hrazeny nadbytkem hypotonických tekutin).
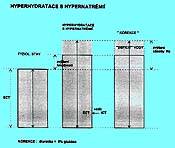 5.1.9 Hyperhydratace s hypernatrémií (obr. 2.7)
5.1.9 Hyperhydratace s hypernatrémií (obr. 2.7)
Hmotnost je zvýšená, zásoba Na+ se zvýšila relativně více než zásoba vody. Dochází k přesunu vody z ICT do ECT.
Tento výpočet slouží jen k orientaci o tíži poruchy, stejně tak jako výpočet "deficitu" vody, kterým lze určit jaký objem vody by bylo třeba dodat, aby se hypernatrémie upravila. Užívá se rovnice č. 3. Vlastní korekce se provádí diuretiky, a protože ztráta vody bude při jejich užití relativně větší než ztráta Na+, hyperosmolalita se koriguje infúzí 5 % glukózy, opět při kontrole natrémie resp. osmolality.
Obsah Na+ v některých solných koncentrátech:
NaCl 10 %, 1 ml = 1,7 mmol Na+ i Cl-,
NaCl 5,8 %, 1 ml = 1 mmol Na+ i Cl-,
NaHCO3 4,2 %, 1 ml = 0,5 mmol Na+ i HCO3-.
plazma 3,8 - 5,4 mmol/l
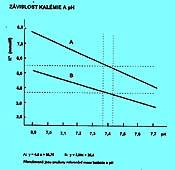
Celková zásoba cca 3500 mmol, z toho 3150 mmol směnitelných, v ECT je 60 mmol K. Koncentrace intracelulárního K je 10 až 20násobně vyšší než v plazmě. Denní příjem a výdej je 50 až 100 mmol. Draslíkové ionty jsou hlavními kationty intracelulárního prostoru. Jsou nezbytné při tvorbě i rozpadu makroergních fosfátů. K+ se účastní všech fosforylačních dějů v organizmu a proto souvisí s energetikou. Jestliže převládají anabolické děje, zvyšuje se ukládání kalia v buňkách. Naopak při katabolizmu buňky opouští.
Kalémie je závislá na pH. Při acidémii se uvolňuje K+ především z vazby na fosfáty v buňce. Dále se uvolňuje při rozpadu tkáňových bílkovin, na které je vázáno. V alkalémii se naopak více váže na fosfáty a jsou vyšší ztráty močí - směna za Na+. Při acidémii normální S-K+ upozorňuje na depleci K+ v organismu. Při alkalémii normální nebo zvýšené S-K+ svědčí pro hyperkatabolismus. Vztahy mezi pH a kalemií připomíná obr. 2.8.
5.2.1 Hypokalémie
Klinické příznaky: slabost, sklon k paralytickému ileu, renální poruchy - neschopnost koncentrovat moč, zvýšená citlivost myokardu na kardiotonika, nebezpečí arytmií. Nižší T vlny, objevují se U vlny. Terapie spočívá v úpravě primární poruchy a v doplnění draselných iontů.
Výpočty pro korekční a substituční dávky kalia:
1. U pacientů, kde se úspěšně zvládla katabolická situace, není hypoxie a daří se výživa nemocného a upravila se acidobazická rovnováha:
 5.2 Kalium
5.2 Kalium
Referenční interval:
moč 45 - 90 mmol/d.
Příčiny:
1) Ze zvýšených ztrát ledvinami. Léčba diuretiky, polyurie, léčba steroidy ve vysokých dávkách. Hypokalémie může vzniknout již během 2 dnů po zahájení této léčby.
2) Ztráta mimorenální. Průjmy, střevní píštěle.
3) Přesun K do buněk. Alkalóza, léčba diabetické acidózy infúzemi glukózy a inzulínem.
kde ECT je objem extracelulární tekutiny v litrech.
Substituční dávky K+ počítáme tak, že násobíme objem moče a event. dalších ztrácených tekutin zjištěnou koncentrací K+ v mmol/l. Jestliže došlo před přijetím do nemocnice k nekontrolovaným ztrátám kalia (diabetická ketoacidóza, diuretická léčba nekrytá kaliem) a jsou-li splněny výše zmíněné podmínky, lze zvýšit korekční dávku o 50 mmol K+, které hradíme v rozpětí 6 až 12 hodin. Podávání kaliových iontů přerušujeme v intervalech asi 2 h., kdy kape infúzní roztok bez kalia. Z jiné žíly odebíráme krev na kontrolní vyšetření kalémie.
2. U pacientů, kde nenastalo rychlé zlepšení stavu, volíme opatrnější postup, který upravuje pouze množství, chybějící v ECT:
Pokud se po této dávce zvýší kalémie na normální hodnoty, jde o nepříznivou situaci, protože K+ nevniká do buněk. Další podávání je nevhodné, pokud nebude upravena energetika nemocného. Většinou se ale kalémie upravit nestačí a v přívodu pokračujeme po novém výpočtu.
3. Oligurie a anurie je kontraindikací podávání kalia. Jen pokud je hypokalémie zjištěná při oligoanurii vzniklé akutně z prerenálních důvodů, lze současně s úpravou hypovolémie podávat roztoky s obsahem K+. Korekce má upravit pouze deficit v ECT:
Nutno hlídat kalémii po obnovení diurézy, nebezpečí poklesu!
Obsah K v některých solných koncentrátech:
7,5 % KCl, 1 ml = 1 mmol K+ a 1 mmol Cl-.
KH2PO4 13,8 %, 1 ml = 1 mmol K+ a 1 mmol P.
Tyto koncentráty se přidávají do infúzních roztoků cukrů v takovém množství, aby v nich maximální koncentrace K+ nepřekročila 40 mmol/l. Maximální hodinová dávka K+ smí být 20 mmol, maximální celková denní dávka K+ má být 150 mmol, ale dává se i více, dokonce až 600 mmol (pod kontrolou laboratorní i EKG).
5.2.2 Hyperkalémie
Klinické příznaky: bradykardie, arytmie až fibrilace komor se zástavou v diastole při kalémii 10 až 11 mmol/l. Snížení citlivosti myokardu na digitalis. Na EKG hrotnaté T a rozšířené P vlny. Prodloužení intervalu PQ, rozšíření QRS a deprese ST úseku.
Příčiny:
1. Vázne vylučování ledvinami: při akutní renální insuficienci, léčbě antagonisty aldosteronu (Spirolakton, Amilorid, Triamteren), nedostatku mineralokortikoidů (M. Addison).
2. Uvolnění K z buněk: katabolismus, acidóza, rozpad tkání, hemolýza in vivo i in vitro (únik K z erytrocytů), trauma.
3. Nadměrný přívod: infúze s obsahem solí kalia, transfúze staré krve.
(10-20 ml dospělí) | ||||
1j./g glukózy | ||||
(p.o., p.r., sonda) 50-100g dospělí | ||||
5.3 Magnezium
sérum 0,7 - 0,9 mmol/l
V těle je celkem 600 až 1150 mmol hořčíku. Z toho je asi 53 % v kostech, v příčně pruhovaném svalstvu a dalších měkkých tkáních je 46 %. V ECT je jen 1 %, z toho 0,5 % v erytrocytech a 0,3 % v plazmě, takže podobně jako S-K, ani S-Mg neodráží stav zásob v těle. Asi 33 % plazmatického Mg je vázáno na bílkoviny, 5 - 12 % je v komplexech s jinými ionty (citráty, fosfáty) a zbytek, 55 - 60 % je volný, fyziologicky aktivní Mg2+. V poslední době (od r. 1993) je možno v závislosti na technickém vybavení laboratoře vyšetřovat Mg2+ místo celkového Mg. Protože informace o koncentraci Mg2+ je blíže jeho biologické aktivitě, je tomuto vyšetření třeba dávat přednost.
Význam hořčíku vychází ze skutečnosti, že Mg2+ je po K+ druhým nejzastoupenějším intracelulárním kationtem. Je kofaktorem více než 300 enzymových reakcí. Mezi reakce zajišťované Mg2+ patří např. funkce Na+-K+ ATPázové pumpy. Proto buňka s nedostatkem Mg2+ nemůže doplnit chybějící K+ ani při jeho dostatečném přívodu. Další funkcí je zajištění činnosti ATPázové pumpy, bránící vstupu Ca2+ do buněk. Při depleci Mg2+ vstupují Ca2+ do buněk. V případě buněk hladkého a příčně pruhovaného svalstva stoupá jejich tonus, je sklon k hypertenzi a křečím. Mg2+ se také účastní reakcí s užitím ATP pro syntetické procesy, pro funkci myokardu a svalové kontrakce, neuromuskulární převod a uvolňování hormonů. Mg2+ má funkce antiarytmické, vasomotorické, snižuje excitabilitu myokardu a zlepšuje průtok koronárními arteriemi.
5.3.1 Hypomagnezémie
Klinické příznaky se manifestují obvykle při poklesu celkového S-Mg pod 0,5 mmol/l. Kardiovaskulární příznaky: arytmie, hypertenze, toxicita digitalis. Metabolické příznaky: hypokalémie, stoupá kaliuréza (pokles aktivity Na+-K+ ATPázové pumpy), hypokalcémie, hypofosfatémie, hyponatrémie. Psychické příznaky: deprese, agitovanost. Neurologické příznaky: příznaky zvýšené neurosvalové dráždivosti, pozitivní Trousseau, Chvostek, fascikulace svalové, spazmy, tetanie ale i slabost, ataxie, až psychotické chování.
Terapeuticky se při křečích podává až 16 mmol MgSO4.7 H2O během 10 minut. Další suplementace je pomalejší, 10 až 20 mmol/d i.v. nebo i.m. po dobu 1 až 3 týdnů při terapii chronické deplece. Potom se přechází na dávky udržovací 0,05 až 0,1 mmol/kg.d-1.
Obsah Mg v některých solných koncentrátech:
5.3.2 Hypermagnezémie
Klinické příznaky: nauzea, zvracení, zarudlá, teplá kůže, hypotenze, bradykardie, letargie (při zvýšení S-Mg na 1,5 až 2,5 mmol/l), skleslost, svalová slabost, dechová deprese, snížené reflexy, prodloužení QT (při zvýšení S-Mg na 2,5 až 5 mmol/l), kóma, zástava srdce v diastole, zástava respirace ( při S-Mg nad 5 mmol/l). Dále je popisováno snížení tvorby trombinu a adhezivity destiček.
Terapie spočívá v úpravě acidózy, úhradě ev. deficitu náplně cévního systému a v zastavení přívodu Mg2+. Pomalu se podá i.v. 2,5 až 5 mmol kalcia formou CaCl2 nebo Ca-gluconium (bližší o těchto roztocích viz u hypokalcémie), někdy je indikována hemodialýza nebo peritoneální dialýza.
5.4 Kalcium
sérum 2,23 - 2,63 mmol/l
Horní hranice odpadu vápníku močí lze též určit výpočtem ve vztahu k hmotnosti pacienta:
Celková zásoba vápníku v těle je 30 mol (1200 g), z toho 75 % je uloženo v kostech. V séru je 40 až 45 % vápníku vázáno na bílkoviny, 50 % ionizováno, 5 až 10 % v komplexu s kyselinami. Pro myokard a neuromuskulární dráždivost má význam hlavně ionizované Ca. Pokles koncentrace má za následek vyšší dráždivost, zároveň snížení síly svalové kontrakce.
5.4.1 Hypokalcémie
Klinické příznaky: parestézie, pozitivní Chvostek a Trousseau, dušnost, abdominální koliky, křeče, zmatenost, podrážděnost. Při hodnocení hypokalcémie je vždy nutno posuzovat současně 3 parametry: pH, Ca, celkovou bílkovinu. Např. normální celkové Ca, při alkalóze a vysoké celkové bílkovině mohou být křeče, protože Ca2+ je nízké.
Terapie spočívá v infuzích CaCl2.6 H2O 10 % každých 12 nebo i 6 hodin po převodech. Při parenterální výživě jsou doporučovány udržovací denní dávky po 0,1
mmol/kg. V praxi se však často nedávají, počítá se s trvalým uvolňováním kalcia z kostí u ležících pacientů.
Obsah Ca2+ v některých solných koncentrátech:
5.4.2 Hyperkalcémie
Klinické příznaky: slabost, letargie, únava, zmatenost, snížení neuromuskulární dráždivosti, nechutenství, zvracení, na EKG zkrácení QT, zvýšená citlivost na digitalisové preparáty. Při Ca vyšším než 4 mmol/l se objevuje hyperkalcemická krize, zmatenost, bezvědomí, zástava srdce v systole.
Terapie: zavodnit, podat diuretika, alkalizace, nitrožilně roztoky fosfátů (vazba s Ca), steroidy (působí přesun Ca do buněk), tyreokalcitonin.
5.5 Fosfor
sérum 0,7 - 1,5 mmol/l
Celková zásoba fosforu v těle je 19 až 26 mol (600 až 800 g), z toho 80 % je v kostech a zubech, 9 % ve svalech.
5.5.1 Hypofosfatémie
Klinické příznaky: slabost svalová na končetinách, poruchy artikulace, žvýkacích svalů, anizokorie, anorexie, hyperventilace, z deficitu ATP se tvoří sférocyty, zkrácené přežívání erytrocytů a trombocytů. Chemotaxe leukocytů a jejich fagocytární vlastnosti jsou rovněž zhoršeny. Klinické příznaky se začínají objevovat při poklesu sérové koncentrace pod 0,3 mmol/l a jsou vždy přítomny při poklesu pod 0,16 mmol/l.
Terapeuticky se podává 30 až 40 mmol P parenterálně po 3 dny, pak se sníží dávky na 20 až 25 mmol denně a končí se udržovací dávkou 10 až 15 mmol/d.
KH2PO4 13.6 % 1 ml = 1 mmol K+ i P,
5.5.2 Hyperfosfatémie
6. Celková bílkovina (CB) a albumin
sérum CB 60 - 80 g
Celková zásoba albuminu v organismu je 4 - 5 g/kg, tj. u dospělého celkem 280 až 350 g. Z toho je za fyziologických okolností asi 40% v cévním řečišti a 60% je uloženo extravazálně, převážně v kůži. Při chronických malnutricích se extravazálně uložený podíl přesunuje do oběhu. Při akutních stavech bývá pohyb opačný - viz dále. Význam albuminu spočívá v udržování koloidně osmotického, tj. onkotického tlaku, který zajišťuje návrat tekutiny do kapiláry na venózním konci. Únik albuminu do intersticia je součástí odpovědi organismu na trauma.
Další úloha albuminu spočívá v transportu metabolických produktů, iontů, hormonů a léků. Zvláštní pozornost si zaslouží farmakokinetika léčiv vázaných na albumin. Změny se uplatňují při snížení albuminémie pod 30 g/l, které je u hypermetabolických nemocných časté. Terapeutická odpověď je při hypoalbuminémii buď rychlejší nebo silnější než obvykle, ale kratší. Příznaky intoxikace léky jsou častější, protože je snadno překročená vazebná kapacita pro ně. Např. žaludeční vředy, jako vedlejší příznaky dlouhodobé léčby steroidy, jsou při hypoalbuminémii 2 až 3x častější. Buzení nemocného po thiopentalu je u nemocného s hypoalbuminémií výrazně prodlouženo.
Na akutně vzniklé hypoalbuminémii u hypermetabolických nemocných se podílí trojí vliv: pokles syntézy, zvýšení katabolismu a přesun do intersticia.
U chronicky vyvinuté hypoalbuminémie může být deficit 150 až 200 g. Pokud je při ní albumin pod 30 g/l, jde vždy o pokles syntézy. Hodnoty koncentrace CB a albuminu jsou u pacientů, kteří byli léčeni plazmaexpandery, sníženy. Plazmaexpandery zvyšují koloidně osmotický tlak plazmy a to vede k přesunu části tekutin z IST do oběhu. Díky naředění se koncentrace CB i albuminu výrazně sníží. Tím ztrácejí tyto parametry význam z hlediska informace o koloidně osmotickém tlaku.
K přímému měření koloidně osmotického tlaku se používá onkometr. Referenční hodnoty koloidně osmotického tlaku vestoje jsou 3,33 až 3,52 kPa, vleže po 12 hod. okolo 3,0 kPa. Výpočet z celkové bílkoviny nebo z albuminu a globulinů je u hypermetabolických, intenzívně léčených nemocných nespolehlivý. Znalost koloidně osmotického tlaku má prognostický význam quoad vitam u kritických stavů a při predikci plicního edému. Sledování koncentrace sérových bílkovin má význam u stavů malnutrice, kde různé bílkoviny mají různou výpovědní hodnotu s ohledem na své poločasy. U albuminu je to 20 dní, u transferinu 7,5 dne, u prealbuminu 1,9 dne.
Terapie albuminem: v akutních stavech je 50 až 80 % infundovaného albuminu ztráceno katabolismem. Z těchto důvodů, nejen z finančních, je snaha omezit jeho podávání u akutních stavů jen pro zabránění poklesu koncentrace albuminu v séru pod 25 až 30 g/l.
7. Urea v moči
Široký rozsah je dán závislostí na příjmu bílkovin a na tělesné aktivitě. Vylučování močoviny je mírou katabolismu bílkovin a v hypermetabolických stavech i rychlostí glukoneogeneze. Stanovení urey v moči umožňuje hodnotit ztráty celkového dusíku močí a tím i dusíkovou bilanci.
Postup:
Příklad:
Odhad ztrát bílkovin (svaloviny):
Pro úplnost by na tomto místě bylo ještě vhodné zařadit informaci o chloridech a laktátu. Protože ale obojí je součástí kapitoly 3 "Poruchy acidobazické regulace", odkazujeme čtenáře na tuto část.
Doporučená literatura:
1. Úvod
Kyselina je látka, která je schopna uvolnit H+.
Báze (zásada) je látka, která je schopná vázat H+.
Kyseliny dělíme na silné a slabé, a to na základě jejich schopnosti disociovat:
HCl -----> H+ + Cl-
Mírou disociace je hodnota pK, což je záporný dekadický logaritmus disociační konstanty kyseliny. Silné kyseliny mají hodnotu pK nízkou, slabé kyseliny vyšší.
Referenční interval:
moč 1,2 - 12 mmol/d
ionizované Mg sérum 0,45 - 0,62 mmol/l
Příčiny:
1. Snížený příjem při stravování předem připravenými jídly a "fast food", snížený příjem parenterální výživou (p.v.).
2. Snížená absorpce: alkoholismus, zvracení, průjmy a laxativa, malabsorpční syndrom, pankreatitis, stavy po resekci tenkého střeva.
3. Zvýšené vylučování: enterální onemocnění, endokrinopatie (hyperparatyreóza, hyperaldosteronismus, hypertyreóza, diabetes mellitus), antibiotika, digitalis.
4. Různé: gravidita, laktace, pooperačně, Bartterův sd.
MgSO4.7 H2O 10 %, 1 ml = 0,4 mmol Mg2+,
MgCl2.6 H2O 10 %, 1 ml = 0,5 mmol Mg2+ a 1 mmol Cl-
Příčiny:
1. Akutní i chronické renální selhání.
2. Endokrinní - hypotyreóza, m. Addison, nedostatek STH.
3. Zvýšený příjem léků - antacida, projímadla, sole Mg při léčbě eklampsie (ohrožení i novorozenců), léčba srdečních arytmií a dialyzační tekutiny s Mg.
4. Různé - traumata se zhmožděním svalstva, dehydratace, metastázy tumorů, metastázy do kostí, mnohočetný myelom, acidémie.
Referenční interval:
moč 2,5 - 7,5 mmol/d
ionizované kalcium - sérum 1,0 - 1,4 mmol/l
dU-Ca (mmol/24 h) = kg x 0,1
(tedy např. pro osobu o hmotnosti 70 kg to je 7 Ca mmol/d).
Příčiny:
1. Snížení celkového Ca bývá u nekrotizující pankreatitidy, hypoparatyreózy, renální insuficience, hypomagnezémie, poklesu proteinémie, osteomalacie, deficitu D vitaminu, osteoblastických tumorů.
2. Pokles Ca2+ nastává u alkalózy i po masivních transfúzích, kdy citrát váže Ca2+. Pokles Ca2+ nemusí být provázen poklesem celkového Ca.
CaCl2. 6 H2O 10 %, 1 ml = 0,5 mmol Ca2+ a 1,0 mmol Cl-,
Ca-gluconicum . H2O 10% 1 ml = 0.25 mmol Ca2+
Příčiny:
hyperparatyreóza, hypervitaminóza D, metastázy tumorů do kostí, hyperproteinémie, při terapii antacidy obsahujícími CaCO3.
Referenční interval:
moč 16 - 48 mmol/d
Příčiny: MAL a RAL stimulují glykolýzu, což iniciuje přesun P do buněk, kde je zvýšená fosforylace. Chronická léčba antacidy (váží P), malabsorpce, hyperparatyreóza, deficit vitaminu D, Fanconiho syndrom, vrozené renální tubulární poruchy, zvýšená clearance fosfátů. U dlouhodobé metabolické acidózy, při rozpadu buněčných struktur se uvolní fosfáty a při korekci a úpravě energetické situace vzniká rovněž hypofosfatémie. K další příčinám patří alkoholismus a také parenterální výživa, není-li dostatečná úhrada P. Při hypofosfatémii je nalézán pokles 2,3-bisfosfoglycerátu v erytrocytech, čímž dochází i k posunu disociační křivky O2 doleva, tedy ke zhoršenému uvolňování kyslíku ve tkáních.
Na2HPO4 . 12 H2O 10 % 1 ml = 0,6 mmol Na+ a 0,3 mmol P
Příčiny: oligurické renální selhání, chronická renální insuficience, hojení rozsáhlých fraktur, akromegalie, hypoparatyreóza, předávkování vitaminem D.
Referenční meze:
albumin 32 - 45 g/l
Referenční meze dU: 67 - 580 mmol/d
odhad g N/den = urea mmol/d . 0,0336
Faktor 0,0336 vzniká součinem hodnoty 0,028 (tj. přepočtu mmol urey na g N urey) a hodnoty 1,2 (tj. přepočtu ztráty celkového N za předpokladu, že N urey tvoří přibližně 84 % celkového N v moči).
Ztráty dusíku:
diuréza změřená = 2,5 l moči/den
stanovená koncentrace močoviny ve vzorku sbírané moči = 320 mmol/l
vyloučené množství urey = 800 mmol/d (320x2,5)
odhad ztrát dusíku za den = 800 x 0,0336 = 26,88 g N/d
Na každý gram N bylo katabolizováno 6,25 g bílkovin (bílkoviny obsahují asi 16 hmotn.% dusíku) a toto množství odpovídá přibližně 25 g svalové tkáně. V našem příkladu je tedy ekvivalent ztracené svalové tkáně: 26,88 x 25 = 672 g. Nemocný neztrácí ovšem zejména zpočátku jen svalovou tkáň, ale na ztrátě se podílejí i bílkoviny s krátkým poločasem, které tvoří enzymovou výbavu zažívacího traktu a jater.
Kazda A., Jabor A.: Natrémie - hodnocení nálezů v klinické praxi. Bioch. clin. bohemoslov., 19, 1990, č. 1, s. 11-22
Kazda A., Růžičková J., Zítko K., Hendl J.: Podíl dusíku močoviny na celkové ztrátě dusíku močí u nemocných v resuscitační péči. FONS, prosinec 1993, s. 14-16
Kazda A.: Význam sledování celkového a ionizovaného magnézia v klinické praxi. Klin. bioch. a metab., 2, 1994, č. 4, s. 217-221
Kazda A.: Metabolická odpověď na trauma. Kapitola II. dílu skript: Vybrané kapitoly z problematiky biochemického sledování v intenzivní péči. Editor: A. Jabor, STAPRO Pardubice 1990, s. 23-55
Kazda A., Balík M.: Osmolální dysbalance v intenzivní péči a jejich monitorování. Klin. bioch. a metab., 4, 1996, č. 4, s.223-227
Kazda A., Drábková J., Jabor A.: Požadavky na rozsah a frekvenci laboratorního vyšetřování nemocných v intenzivní péči. Účelová publikace Biochem. monitorování pacientů v intenzivní péči. TECOM, Praha, 1996, s. 18-26
Anděl M., Brodanová M.: Infúzní terapie, parenterální a enterální výživa. Grada, Praha, 1994, s. 148-163
Dzúrik R. a kol.: Štandardná klinicko-biochemická diagnostika. Osveta, Martin, 1996, s. 183-207
Kazda A.: Biochemické monitorování nemocných v intenzivní a resuscitační péči. Avicenum, Praha, 1986, s. 17-40
Nejedlý B.: Vnitřní prostředí - klinická biochemie a praxe. Avicenum, Praha, 1980, s. 15-114
Poruchy acidobázické regulace
Autor kapitoly: MUDr.Pavel Pick, Ústav klinické biochemie VFN a 1.LF UK Praha
Poruchy acidobázické regulace (ABR) jsou stavy, které vznikají v úzké souvislosti se změnami celého vnitřního prostředí. Objevují se při narušení funkce orgánů, podílejících se na regulaci homeostázy. Hodnocení poruch ABR proto musí být komplexní s hodnocením změn všech parametrů vnitřního prostředí. Při rozpoznání a terapii poruch ABR se řídíme podrobnou anamnézou, nálezem fyzikálního interního vyšetření a výsledky vyšetření biochemických parametrů. To zahrnuje parametry ABR, koncentraci kationtů a aniontů, laktátu a ostatní laboratorní výsledky, které umožňují hodnocení funkce orgánů, podílejících se na regulaci vnitřního prostředí. Úvodem zopakujeme některé základní pojmy z chemie a fyziologie, které jsou nutné pro pochopení dalšího výkladu.
I.st. H3PO4 -----> H+ + H2PO4-
II.st. H2PO4- -----> H+ + HPO42-
III.st. HPO42- -----> H+ + PO43-
CH3COCH2COOH -----> H+ + CH3COCH2COO-
Koncentrace H+
Koncentrace H+ je v krvi velmi nízká, asi 40 nmol/l. Většinou se neužívá přímé vyjadřování koncentrace ve zlomcích molu na litr, ale v jednotkách pH, které je definováno jako záporný dekadický logaritmus molální aktivity H+ .
Zjišťujeme aktivitu - aH+, která se v krvi prakticky od koncentrace neliší a můžeme tedy v dalším výkladu oba pojmy zaměňovat. Při hodnocení pH ve vztahu k aktivitě je třeba přihlížet k tomu, že jde o logaritmický vztah. Malá změna pH odpovídá velké změně v aktivitě H+ (Obr. 3.1).
Normální hodnoty pH v arteriální krvi u dospělých jsou 7.400 + - 0.040. Hodnoty pH pod 7.360 označujeme jako acidémii, nad 7.440 označujeme jako alkalémii.
2. Nárazníkové systémy (pufry)
Jsou to soustavy látek, které brání změně pH roztoku po přidání kyseliny nebo zásady. Nárazníky jsou tvořeny párem - slabá kyselina a její sůl se silnou zásadou, nebo naopak slabá zásada a její sůl se silnou kyselinou. Nárazníkové roztoky působí tak, že volný H+ vážou ve formě slabé kyseliny, která je velmi málo disociovaná a tak se koncentrace H+ udržuje relativně stálá. pH nárazníkového roztoku je dáno vztahem, který podle autorů nazýváme Hendersonova-Hasselbalchova rovnice:
| pH = pK + log | [súl] |
| ---------- | |
| [kyselina] |
Z rovnice vyplývá, že při konstantní hodnotě pK závisí pH pufru výhradně na velikosti poměru koncentrace soli ke koncentraci kyseliny. Jakákoliv změna v tomto poměru se projeví změnou pH.
Nárazníkový systém hydrogenkarbonátový
Základním nárazníkovým systémem v krvi je systém hydrogenkarbonátový (hydrogenuhličitanový, nesprávně bikarbonátový), a to proto, že je co do kapacity nejrozšířenější a snadno se regeneruje. Je v rovnováze s nárazníky "nebikarbonátovými", kterým je schopen jak předávat H+ a sám se regenerovat, tak od nich H+ přijímat. Je tvořen kyselinou uhličitou (H2CO3) a hydrogenkarbonátem (bikarbonátem, převážně sodným, NaHCO3). Jeho pH je definováno Hendersonovou-Hasselbalchovou rovnicí pro hydrogenkarbonátový nárazník:
| pH = pKkys.uhlič + log | [HCO3-] | = 6.1 + log | [HCO3-] |
| ---------- | ---------- | ||
| [H2CO3] | [H2CO3] |
Výraz (H2CO3) v rovnici lze nahradit výrazem (pCO2.s), kde malé "s" je koeficient rozpustnosti, kterým násobíme pCO2, abychom dostali koncentraci kyseliny uhličité v mmol/l. Pro pCO2 vyjádřený v kPa je tento koeficient roven 0,225 (pro vyjádření v torrech je roven 0,03).
Disociační konstanta kyseliny uhličité (pKI H2CO3)
Číselná hodnota pKI H2CO3 byla deklarována jako konstantní a rovna 6.1. Zjistilo se však, že hodnota pKI H2CO3 může kolísat v závislosti na iontovém složení krve, zejména u pacientů v těžkých stavech, a to od hodnoty 5.8 do 6.4. Protože pKI H2CO3 se užívá k výpočtu koncentrace hydrogenkarbonátů, jak vyplývá z Hendersonovy-Hasselbalchovy rovnice, musí se při hodnocení koncentrace hydrogenkarbonátů, respektive BE nebo BD (viz dále) k této skutečnosti přihlédnout.
Parciální tlak oxidu uhličitého (pCO2)
Kyselina uhličitá se v Hendersonově-Hasselbachově rovnici označuje jako respirační složka. Její koncentrace v arteriální krvi je dána rovnováhou mezi množstvím CO2 produkovaného ve tkáních a množstvím, které je z organismu vyloučeno plícemi. V alveolárním vzduchu se za fyziologických podmínek ustálí parciální tlak CO2 na hodnotě 5,35 kPa. Při průchodu krve plicními kapilárami se vyrovná pCO2 v alveolárním vzduchu s pCO2 v krvi, protékající plicními kapilárami a pCO2 v arteriální krvi je prakticky totožný s pCO2 v alveolárním vzduchu.
H2CO3 se v krvi vyskytuje jako:
1) fyzikálně rozpuštěný CO2
2) hydratovaný CO2, to znamená H2CO3.
Vzájemný poměr obou složek je 800 : 1 a jsou ve vzájemné rovnováze. Součet jejich koncentrací se označuje jako efektivní koncentrace kyseliny uhličité. Ke kvantitativnímu vyjádření velikosti respirační složky proto běžně používáme hodnotu pCO2, kterou můžeme přepočítat na koncentraci kyseliny uhličité, jak už bylo zmíněno. Normální hodnoty pCO2 v arteriální krvi jsou 5.3 kPa ± 0.5.
Hodnoty nad 5.8 kPa -----> hyperkapnie
Hodnoty pod 4.8 kPa -----> hypokapnie
Hydrogenkarbonátový anion (HCO3-)
Jeho koncentrace je označována jako metabolická složka Hendersonovy-Hasselbalchovy rovnice. Jeho vznik je dán vztahem
H2CO3 <-----> H+ +HCO3-.
Koncentrace hydrogenkarbonátového (bikarbonátového) aniontu v krvi je závislá na činnosti ledvin a na působení zákona elektroneutrality, respektive na vztahu koncentrace silných kationtů a aniontů a slabých netěkavých kyselin, jak bude zmíněno v dalším výkladu.
Ostatní nárazníkové systémy
V krvi se uplatňují při regulaci koncentrace H+ ještě další (nebikarbonátové) nárazníkové systémy, které jsou s hydrogenkarbonátovým systémem v určité rovnováze a jsou schopny regenerace tím, že mohou předat H+ hydrogenkarbonátovému nárazníkovému systému. Naopak jsou schopny v případě potřeby přijímat H+ z kyseliny uhličité a tím umožnit regeneraci hydrogenkarbonátového aniontu:
BUFF- + H2CO3 <-----> HBUFF + HCO3-
Nehydrogenkarbonátové nárazníkové systémy
1) Systém hemoglobin - oxyhemoglobin
Oxygenovaný hemoglobin se chová jako silnější kyselina, která proton odštěpuje, deoxygenovaný hemoglobin jako slabší kyselina, respektive jako silnější konjugovaná báze a proton váže.
2) Bílkoviny krevní plazmy
Za fyziologického pH jsou téměř všechny bílkoviny v oblasti pH vyššího, než je jejich izoelektrický bod. Proto mají negativní náboj (anionty), jsou schopny vázat proton (H+) a chovají se jako silné konjugované baze.
3) Systém primárních a sekundárních fosfátů (H2PO4- a HPO42-)
Uplatňuje se spíše intracelulárně, dále v prostředí kostí a zubů. Jako jeden z možných nárazníků se podílí na acidobázické regulaci v ledvinách.
Podíl jednotlivých nárazníkových systémů na celkové nárazníkové kapacitě krve.
V nazírání na problematiku acidobazické regulace došlo, jako ostatně v celé řadě jiných oborů, k určitému vývoji a posunu hodnocení úlohy některých složek podílejících se na regulaci ABR. Přispěly k tomu práce Stewarta a Fencla, které zejména zdůrazňují vliv zákona elektroneutrality, respektive vliv koncentrací silných kationtů a aniontů, slabých netěkavých kyselin a pCO2 na aktivitu H+ v krvi a intersticiální tekutině. Je zdůrazněna role plazmatických bílkovin, zejména albuminu v regulaci ABR. Je zvýrazněn podíl dalších orgánů (jater a střeva) na regulaci ABR. Zavádí se pojem silných iontů, které nevstupují do reakcí. Počítáme k nim silné kationty - Na+, K+, Ca++, Mg++, a silné anionty - Cl-, laktátový anion, SO42-, a anionty oxokyselin.
Definují se tyto nezávisle proměnné veličiny:
SID (strong ion difference) rozdíl v koncentraci silných kationtů a aniontů
Atot - koncentrace všech slabých netěkavých kyselin. Odpovídá především koncentraci plazmatických bílkovin a anorganických a organických fosfátů.
pCO2 - parciální tlak oxidu uhličitého v arteriální krvi.
Změny velikosti nezávisle proměnných veličin mají za následek změny v koncentraci závisle proměnných veličin, což jsou koncentrace HCO3- a H+. Tyto vztahy jsou odvozeny z fyzikálně chemických zákonů, platných pro vodné soustavy rozpuštěných látek.
Výpočet SID:
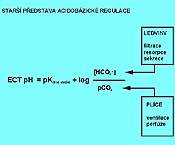 Při pohledu na grafické znázornění SID (Obr.3.2) je zřejmé, že jde o část sloupce aniontů vyplněnou hydrogenkarbonáty a plazmatickými bílkovinami. Změny velikosti SID jsou způsobeny hlavně změnami v poměru Na+ ku Cl-, eventuelně zmnožením reziduálních aniontů (RA). Každé zvětšení SID je sledováno z důvodů zachování elektroneutrality zvýšením koncentrace hydrogenkarbonátů, což vede ke zvýšení pH. Naopak zmenšení SID vede ke snížení koncentrace hydrogenkarbonátů v rozsahu nutném pro zachování elektroneutrality a druhotně k poklesu pH. Pokles koncentrace Atot vede ke zvýšení koncentrace hydrogenkarbonátů, což je příčinou vzniku metabolické alkalózy u stavů se sníženou koncentrací bílkovin, nebo jen albuminu.
Z následujících schémat, převzatých z práce Kováče a spol., vyplývá rozšíření pohledu na acidobazické regulace při použití parametru SID a Atot (Obr.3.3 a 3.4). Změny nezávisle proměnných veličin vedou ke změnám v koncentraci hydrogenkarbonátu a v pH. Hodnotu SID přímo nevypočítáváme. Z technických důvodů nelze rychle stanovit některé parametry z oblasti reziduálních aniontů. K hodnocení metabolických poruch acidobazické rovnováhy používáme některé parametry, které jsou vypočítávány z koncentrací jednotlivých kationtů, aniontů a bílkovin. Jde o BBS (buffer base séra), AG (anion gap) a RA (reziduální anionty, viz dále).
Při pohledu na grafické znázornění SID (Obr.3.2) je zřejmé, že jde o část sloupce aniontů vyplněnou hydrogenkarbonáty a plazmatickými bílkovinami. Změny velikosti SID jsou způsobeny hlavně změnami v poměru Na+ ku Cl-, eventuelně zmnožením reziduálních aniontů (RA). Každé zvětšení SID je sledováno z důvodů zachování elektroneutrality zvýšením koncentrace hydrogenkarbonátů, což vede ke zvýšení pH. Naopak zmenšení SID vede ke snížení koncentrace hydrogenkarbonátů v rozsahu nutném pro zachování elektroneutrality a druhotně k poklesu pH. Pokles koncentrace Atot vede ke zvýšení koncentrace hydrogenkarbonátů, což je příčinou vzniku metabolické alkalózy u stavů se sníženou koncentrací bílkovin, nebo jen albuminu.
Z následujících schémat, převzatých z práce Kováče a spol., vyplývá rozšíření pohledu na acidobazické regulace při použití parametru SID a Atot (Obr.3.3 a 3.4). Změny nezávisle proměnných veličin vedou ke změnám v koncentraci hydrogenkarbonátu a v pH. Hodnotu SID přímo nevypočítáváme. Z technických důvodů nelze rychle stanovit některé parametry z oblasti reziduálních aniontů. K hodnocení metabolických poruch acidobazické rovnováhy používáme některé parametry, které jsou vypočítávány z koncentrací jednotlivých kationtů, aniontů a bílkovin. Jde o BBS (buffer base séra), AG (anion gap) a RA (reziduální anionty, viz dále).
3. Laboratorní vyšetření nutná pro hodnocení poruch ABR
Jak vyplývá z poměrně rychlé dynamiky změn vzájemného působení složek vnitřního prostředí, je nutné odebírat krev na vyšetření všech parametrů současně.
3.1. Vyšetření parametrů ABR
Arteriální krev vyšetřujeme u pacientů, kde se z různých důvodů liší výrazně složení arteriální krve od krve arteriolární. K takovým rozdílům dochází zejména u pacientů s centralizací oběhu, kde výsledky vyšetření kapilární krve poskytují informace o poměrech ve tkáni, odkud byla krev odebrána, nelze je však vztahovat na celý organismus. Rovněž při posuzování hodnot pO2 je výhodnější vyšetření arteriální krve, neboť hodnoty v krvi kapilární jsou vždy poněkud nižší než hodnoty systémové.
Vyšetření se musí provést co nejdříve po odběru. Nastane-li z technických důvodů prodleva, je nutno odebranou krev uchovávat ve vodní lázni s ledem (nezmrazovat!), a to maximálně 2 hodiny od odběru. Déle skladovaný vzorek nemá smysl posílat do laboratoře a měřit.
Acidobazické analyzátory, tj. analyzátory pH a krevních plynů, jsou dodnes často nazývané podle jednoho z prvních autorů "Astrup". Jsou to složité přístroje, které pomocí elektrod umožňují přesné měření základních parametrů ABR, t.j. pH, pCO2 a pO2. Ostatní parametry jsou kalkulovány podle softwarového vybavení analyzátoru na bázi Hendersonovy-Hasselbalchovy rovnice. Modernější analyzátory umožňují kromě stanovení základních parametrů ještě stanovení koncentrace Hb, OxyHb a dalších derivátů hemoglobinu. Tato stanovení jsou základem pro výpočet ostatních parametrů, které jsou důležité pro posouzení oxygenace organismu.
3.1.1. Parametry a výpočty, používané při hodnocení poruch ABR
3.1.1.3. Koncentrace standardních hydrogenkarbonátů
3.1.1.4. Koncentrace aktuálních hydrogenkarbonátů
3.1.1.5. BE (Base excess, přebytek bazí), BD (Base deficit, nedostatek bazí)
3.1.1.6. Parciální tlak kyslíku (pO2)
3.1.2. Parametry umožňující posouzení smíšených poruch ABR
3.1.2.2. Anion gap, AGAP - aniontová mezera
3.1.2.3. RA - Reziduální anionty
4. Reakce organismu směřující k udržení stálého pH
4.1 Nárazníkové reakce
4.2 Kompenzační reakce
4.2.1. Kompenzační reakce ledvin při respirační acidóze
4.2.2. Kompenzační reakce ledvin při respirační alkalóze
4.2.3. Kompenzační reakce plic u metabolické acidózy
4.2.4. Kompenzační reakce plic u metabolické alkalózy
4.3 Korekční reakce
4.3.1. Korekce u metabolické acidózy
4.3.2. Korekce u metabolické alkalózy
Kromě pásem hodnot akutních poruch jsou zde vyznačena pásma hodnot ustálených poruch, kam se dostane 95 % pacientů s jednoduchými základními poruchami po rozvinutí všech kompenzačních a korekčních mechanismů. Graf umožňuje jednoduchý záznam změn parametrů ABR, posouzení kompenzačních a korekčních dějů. Vede nás případně k podezření na přítomnost některých smíšených poruch a umožňuje přibližný odhad terapeutických dávek vzhledem k BE a pCO2.
5. Jednoduché poruchy ABR
5.1.1 Hyperchloremická metabolická acidóza
Vyskytuje se při renálních ztrátách HCO3- a Na+, bez ekvivalentní ztráty Cl-. Např. podávání inhibitorů karboanhydrázy (Acetazolamid /Diluran/ používaný při léčbě glaukomu) inhibuje aktivitu karboanhydrázy buněk renálních tubulů a kartáčových lemů v tubulech. Inhibicí karboanhydrázy vázne resorbce HCO3-, Na+ a K+. Více se zpětně resorbují chloridy, což vede ke vzniku hyperchloremické acidózy. Při renální tubulární acidóze (RTA) proximální i distální se rozvíjí rovněž hyperchloremická acidóza. O RTA podrobněji v kapitole o ledvinách. Hyperchloremickou MAC způsobuje též podávání HCl nebo látek obsahujících Cl-, např. NH4Cl, arginin nebo lysin hydrochlorid, používaných k acidifikaci. Po zmetabolizování amoniaku, argininu nebo lysinu zůstává v organismu nadbytek Cl-. Stejný účinek má perorální podávání některých dalších látek, jako CaCl2, MgCl2, cholestyraminu.
Z ostatních příčin MAC: při rychlé expanzi extracelulární tekutiny, přívodem tekutiny , která neobsahuje HCO3-, dojde ke snížení koncentrace bikarbonátu a tím k diluční acidóze. Korekce ledvinami následuje velmi rychle.
5.1.2 Metabolická acidóza z nadprodukce reziduálních aniontů nebo z jejich zhoršeného vylučování
Podle vzniku rozlišujeme 2 druhy laktátové acidózy:
Laktátová acidóza typu B vzniká:
Alkoholická acidóza
Otrava salicyláty
Otrava metanolem a etylenglykolem
Acidóza při renálním selhání - akutním nebo chronickém
5.2 Metabolická alkalóza
5.2.1 Ztráty Cl- bez odpovídajících ztrát silných kationtů.
5.2.2 Zisk Na+ bez odpovídajícího zisku Cl-
5.2.3 Metabolická alkalóza ze snížení Atot
5.3 Respirační acidóza
5.3.1 Akutní respirační acidóza
5.3.2 Chronická respirační acidóza
Příčin chronické respirační acidózy může být celá řada, většina z nich však postihuje plíce, resp. plicní ventilaci:
U pacientů v ustálené chronické respirační acidóze může nastat náhle změna, sníží-li se rychle a výrazně schopnost odventilovat CO2. Např. u chronické bronchitidy ataka akutního infektu, kdy se pCO2 zvýší na novou vyšší hladinu. Pokles pH, který nastane, není úměrný vzestupu pCO2, jak tomu bývá u akutní respirační insuficience. Organismus plně adaptovaný na chronickou respirační acidózu má poměrně vysokou koncentraci bikarbonátů a dále reaguje promptně renální kompenzací, resp. zvýšeným vylučováním H+.
5.4 Respirační alkalóza
Příčiny respirační alkalózy:
Výrazná alkalémie způsobuje poruchu srdečního rytmu a díky poklesu koncentrace ionizovaného Ca i zvýšenou neuromuskulární dráždivost s tendencí ke křečím.
6. Smíšené poruchy ABR
Nejčastější smíšené poruchy ABR jsou:
6.1 Respirační acidóza a metabolická alkalóza
Metabolickou alkalózu můžeme ovlivnit podáním roztoků s NaCl a KCl, musíme však přihlédnout k možné retenci tekutin při ne zcela optimální činnosti srdce a dávkovat opatrně. Ovlivní se složka metabolické alkalózy, pCO2 ale zůstává nezměněno.
Laboratorně zjišťujeme zvýšené pCO2, BE, BBS. Pokud není výraznější hypoxemická laktátová acidóza, RA a AGap se nemění. Hodnota pH se mění podle toho, zda převládá metabolická alkalóza nebo respirační acidóza.
6.2 Respirační acidóza a metabolická acidóza
Laboratorně nalézáme snížení pH, BE, BBS. Zvýšeny jsou pCO2, RA, AGap a koncentrace laktátu.
6.3 Respirační alkalóza a metabolická acidóza
Laboratorně se zjišťuje výsledek stanovení pH zpravidla okolo normálních hodnot, snížené jsou BE, pCO2 a BBS, zvýšené RA a AGap.
6.4 Respirační alkalóza a metabolická alkalóza
Laboratorně: Vyšší pH, BE, BBS, snížené pCO2.
6.5 Metabolická acidóza a metabolická alkalóza
Diferenciální diagnostika kombinovaných poruch ABR je složitá. U celé řady pacientů i při posouzení všech parametrů a přihlédnutí ke klinickému průběhu je zpravidla zatížena mnoha omyly.
7. Terapie poruch ABR
7.1 Látky používané k alkalizační terapii
Roztoky NaHCO3
THAM (tris-[hydroxymetyl]-aminometan)
Roztoky solí organických kyselin
7.2 Látky používané k acidifikaci
Izotonický roztok NaCl (fyziologický roztok)
Chlorid amonný - NH4Cl
Arginin hydrochlorid
Kyselina chlorovodíková - HCl
Acetazolamid
Výpočet potřebné dávky roztoků korigujících acidózu nebo alkalózu
mmol hydrogenkarbonátu = BE . 0,3 . kg hmotnosti
Máme-li místo kladného BE záporný BE, neboli BD, pak místo mmol hydrogenkarbonátu dosadíme mmol kyseliny, resp. Cl-.
Podáním vypočteného množství bazí nebo kyselin upravíme BE nebo BD na hodnotu 0. Hodnota pH bude rovna 7,400 pouze tehdy, bude-li pCO2 rovno 5,35 kPa. Při nerespektování hodnoty pCO2 můžeme pacientovi sice upravit BE nebo BD na 0, ale pH krve se může od hodnoty 7,400 výrazně lišit a pacienta tato změna může spíše poškodit. Při úpravě pH na hodnotu, kterou si určíme, lze použít korigovaný vzorec podle Nejedlého, který zohledňuje aktuální pCO2 pacienta:
1) Vyšetření parametrů ABR
pH, pCO2, pO2, koncentrace standardních hydrogenkarbonátů, BE, koncentrace aktuálních hydrogenkarbonátů, saturace Hb kyslíkem.
2) Ostatní laboratorní vyšetření
Koncentrace kationtů: Na+, K+, Ca++, Mg++
Koncentrace aniontů: Cl-, laktátu, bílkovin, případně zvlášť albuminu
Koncentrace ostatních látek: Urea, kreatinin, glykemie, osmolalita, event. ketolátky
Vyšetřuje se arteriální krev, arteriolární, respektive kapilární krev nebo smíšená venózní krev. Arteriální krev odebírá lékař arteriální punkcí. Odběr se provádí do injekční stříkačky z plastiku, kde v konusu je malé množství heparinu a případně i skleněná kulička k promíchání krve. Krev musí být nabrána bez vzduchových bublin. I malé množství vzduchu je nutno okamžitě vypudit. Krev s ponechanými vzduchovými bublinami je pro vyšetření parametrů ABR nevhodná. Přítomnost vzduchu snižuje výsledky vyšetření pCO2, zvyšuje pO2 a posunuje pH na alkalickou stranu. Kapilární (arteriolární) odběr se provádí z ušního lalůčku nebo z bříšek prstů, u kojenců z patičky po předchozí hyperemizaci. Rozšíření arteriol lze dosáhnout použitím hyperemizačních mastí, jako např. Finalgon, nebo působením tepla. Z hlubokého vpichu sterilní lancetkou po předchozí desinfekci povrchu odebíráme krev do heparinizovaných kapilár. Krev odebíráme bez vymačkávání (příměs krve z venul a přítomnost lymfy není žádoucí). Sloupec krve v kapiláře nesmí být přerušen vzduchovou bublinou. Do kapiláry vložíme krátký drátek z nerez oceli, kapiláru uzavřeme plastikovými uzávěry a pomocí magnetu, kterým pohybujeme podél kapiláry, promícháme krev, aby se v ní rozpustil vysušený heparin ze stěn kapiláry. Sraženou krev nelze vyšetřit!
3.1.1.1.pH arteriální krve u dospělých: 7.400 ± 0.040
3.1.1.2. pCO2: 5.35 kPa ± 0.5
Je to koncentrace hydrogenkarbonátů v 1 litru krve za standardních podmínek (37 °C, plně okysličená krev, pCO2 = 5.35 kPa). Referenční rozmezí je 24.0 + - 2.0 mmol/l. Podle koncentrace standardních hydrfogenkarbonátů lze posuzovat kvalitu hydrogenkarbonátového nárazníkového systému krve.
Je to koncentrace hydrogenkarbonátů v 1 l plně okysličené krve, při
37 °C, při aktuálním pCO2, které pacient skutečně má v okamžiku odběru. Hodnoty referenčního rozmezí se kryjí s hodnotami standardních hydrogenkarbonátů. Je-li pCO2 vyšší než 5.35 kPa, pak i koncentrace aktuálních hydrogenkarbonátů je vyšší než koncentrace standardních hydrogenkarbonátů a naopak. Koncentrace aktuálních hydrogenkarbonátů ukazuje na aktuální stav hydrogenkarbonátového nárazníkového systému pacienta.
BE v mmol/l udává o kolik je v 1 litru plné a plně okysličené krve , při 37°C, při pCO2 5.35 kPa více bazí než má být, aby pH této krve bylo 7.400. Nedostatek bazí bývá označován zpravidla jako BD nebo také jako záporný BE. Pro BD platí, že jde o mmol/l kyseliny, které přebývají a proto mluvíme o deficitu bazí. Referenční rozmezí je od + 2.5 do - 2.5 mmol/l. Používají se při výpočtech dávek korekčních roztoků. Při úpravě BE nebo BD na hodnotu 0 dosáhneme pH 7.400 jen tehdy, je-li pCO2 rovno 5.35 kPa. Nulový BE při pCO2 nižším než 5.35 vede k alkalémii, při pCO2 vyšším k acidémii.
U vyšetření ABR je parciální tlak O2 běžně udáván spolu s ostatními parametry. I když sám o sobě není přímo údajem o ABR, jeho hodnota má pro posuzování poruch acidobazické rovnováhy velký význam. Snížený pO2 vede k úvaze o možnosti tkáňové hypoxemické metabolické laktátové acidozy, i když ani normální hodnota pO2 tuto možnost nevylučuje. Referenční rozmezí: 9.3 - 15.5 kPa. Rozmezí je závislé na věku, u starších osob se hodnoty fyziologicky snižují. Pro vyšetření pO2 je vhodný odběr arteriální krve, případně odběr z dobře hyperemizovaného ušního lalůčku. Odběr z bříška prstu není vhodný pro nestardandně falešně nižší hodnoty.
3.1.2.1. Buffer base séra = BBS
BBS = (Na+ + K+) - Cl-
BBS hodnotí vztah mezi hlavními kationty a Cl- aniontem. Zvýšená hodnota BBS svědčí o relativním poklesu Cl- a tím o zvýšení podílu hydrogenkarbonátů ve sloupci aniontů - tedy o přítomnosti složky metabolické alkalózy. Snížená hodnota BBS ukazuje na relativní hyperchlorémii vedoucí z důvodů elektroneutrality ke snížení koncentrace hydrogenkarbonátů a k hyperchloremické metabolické acidóze. Referenční rozmezí: 42 ± 2 mmol/l.
AGAP = (Na+ + K+) - (Cl- + HCO3-)
Anion gap prakticky odpovídá součtu koncentrací [RA + plazmatické bílkoviny]. Zvýšená hodnota AGAP svědčí o přítomnosti metabolické složky acidózy. Nevýhodou při používání parametru AGAP je, že mění-li se koncentrace bílkoviny a RA protichůdně, celková hodnota AGAP se nemění, přestože může být přítomna změna ABR. Referenční rozmezí = 18 ± 2 mmol/l.
RA = (Na+ + K+ + Ca++ + Mg++) - (Cl- + HCO3- + proteiny)
Hodnota reziduálních aniontů odpovídá koncentraci aniontů organických i anorganických kyselin. Použije-li se k výpočtu koncentrace RA koncentrace albuminu místo koncentrace celkových proteinů, respektive počítáme-li s jejich náboji, potom je referenční rozmezí 8 + - 2 mmol/l. Zvýšená hodnota reziduálních aniontů svědčí o podílu metabolické acidózy.
Poruchy ABR se dělí co do původu na poruchy metabolické a respirační. U poruch metabolických se primárně mění nezávisle proměnné veličiny SID a Atot a sekundárně koncentrace HCO3- a pH. U respiračních se primárně mění pCO2, koncentrace HCO3- zůstává prakticky nezměněna a mění se pH. Reakce organizmu na poruchy ABR směřují k zachování stálého pH a lze je rozdělit na
1) nárazníkové reakce,
2) kompenzační reakce,
3) korekční reakce.
Probíhají jako bezprostřední reakce organismu na vzniklou poruchu. Jejich kapacita je limitována a trvá-li příčina poruchy déle, nárazníková schopnost krve se vyčerpá a dochází k výraznějším změnám pH.
Kompenzační reakce jsou vždy zajišťovány orgány nepostižené složky, tj. u poruch respiračních ledvinami, u poruch metabolických plícemi a směřují k udržení pH. Jejich dynamika se liší. Kompenzační reakce zajišťované ledvinami se rozvíjejí postupně, maxima účinnosti dosahují do 5 dnů a po odeznění příčiny vyvolávající poruchu stejně dlouho odeznívají. Plíce kompenzují poruchu tak, že maxima účinnosti je dosaženo do 24 hodin od začátku poruchy a stejně dlouho trvá návrat k normě po odeznění.
1) Ve zvýšené míře se resorbuje a generuje HCO-
2) Zvyšuje se vylučování H+
a) Volný H+ (malé množství) - pH moči neklesá pod pH 4.4
b) Jako NH4+, který vzniká v buňkách tubulů. Co do kapacity jde o nejúčinnější mechanismus.
c) Jako H2PO4-, titrovatelná acidita moče.
3) Zvýšeně se resorbují Na+ a zvýšeně se vylučují Cl- jako (teoreticky) NH4Cl.
1) Zvyšuje se vylučování HCO3- a snižuje se jeho tvorba.
2) Klesá vylučování H+ ve formě NH4+ a titrovatelné acidity moče.
Zvýšeným drážděním dechového centra při metabolické acidóze dochází k hyperventilaci. Sníží se pCO2 v alveolárním vzduchu a tím i v arteriální krvi. Snížením koncentrace respirační komponenty Hendersonovy-Hasselbalchovy rovnice dochází k úpravě pH.
Organismus reaguje hypoventilací a zvýšením pCO2. V důsledku hypoventilace klesá i pO2, což je limitující faktor kompenzace, protože hypoxémie působí stimulačně na dechové centrum a další zvyšování pCO2 není možné.
Přicházejí v úvahu prakticky jen u metabolických poruch za předpokladu, že příčinou poruchy není onemocnění ledvin. Upravují koncentraci primárně změněné složky. U respiračních poruch je postižení funkce plic z různých důvodů vždy příčinou poruchy a nelze tedy o korekci plícemi uvažovat.
Intenzivní vylučování H+ všemi již dříve popsanými mechanismy. Retence HCO3- u některých typů metabolické acidózy.
Stoupá vylučování HCO3- ledvinami, moč je alkalická. Je-li zároveň s metabolickou alkalózou přítomna i hypovolémie, objevuje se zvýšená zpětná resorbce Na+, za které je v distálním tubulu secernován H+ a K+ a moč může být paradoxně kyselá.
K orientaci je vhodný záznamový list acidobazické regulace dle Engliše a Kazdy (Obr. 3.5). Zobrazuje jednak pásma hodnot základních akutních poruch ABR:
aMAC - akutní metabolická acidóza
aMAL - akutní metabolická alkalóza
aRAC - akutní respirační acidóza
aRAL - akutní respirační alkalóza
5.1 Metabolická acidóza
Příčinou metabolické acidózy může být snížení SID nebo zvýšení Atot. Můžeme rozlišovat metabolickou acidózu:
1. Hyperchloremickou
2. Z nadprodukce RA nebo z jejich zhoršeného vylučování.
Laboratorně se projeví snížením BBS, zatímco AG a RA jsou v referenčních mezích. Vyskytuje se při ztrátách HCO3- a Na+ gastrointestinálním traktem, při průjmech, při píštěli, při odsávání pankreatické sekrece a žluči, kde je koncentrace HCO3- vysoká. Pankreatická sekrece reprezentuje cca 2000 ml/24 h. s koncentrací HCO3- až 120 mmol/l. Může se objevit také po ureterosigmoideostomii, kdy se ve střevě zvyšuje zpětná resorpce Cl- a sekrece HCO3-.
Laboratorně: zpravidla nalézáme zvýšenou hodnotu AG a zvýšenou hodnotu RA. Vyskytuje se při diabetické ketoacidóze. Příčinou je zvýšená produkce kyseliny acetoctové a beta hydroxymáselné. Občas je diagnóza diabetické ketoacidózy ztížena tím, že nemusí být vždy přítomna výrazná hyperglykémie. Až 15% pacientů s diabetickou ketoacidózou má koncentraci glukózy v krvi nižší než 19 mmol/l. Kvalitativní zjišťování přítomnosti acetoctové kyseliny v krvi může být negativní nebo jen slabě pozitivní, protože dominuje kyselina beta hydroxymáselná, která nedává pozitivní reakci s činidly na bázi nitroprussidu. Někteří pacienti mohou mít normální hodnotu AG. Metabolická acidóza tohoto typu se rozvíjí také při ketoacidóze z hladovění, kde stoupá produkce ketokyselin v játrech a jejich utilizace ve tkáních je snížena, nebo při laktátové acidóze.
- Typ A laktátové acidózy podmíněný nedostatečnou oxygenací na úrovni mitochondrií. Zvýšená koncentrace laktátu je způsobena jak zvýšením jeho produkce, tak sníženým metabolizováním v játrech a ledvinách, kde je obvykle za normálního stavu konvertován na pyruvát a použit buď v glukoneogeneze nebo metabolizován aerobní cestou v Krebsově cyklu. Příčinou laktátové acidózy typu A jsou stavy, kdy vázne dodávka O2 do tkání - kardiogenní, hemoragický, hypovolemický, septický šok, selhání levé komory srdeční, mezenteriální vaskulární insuficience (zvýšená produkce laktátu tenkým střevem). Při klinickém podezření na laktátovou acidózu je třeba vyšetřit koncentraci laktátu, nejlépe v arteriální krvi. Referenční rozmezí koncentrace laktátu je 0.3 - 1.3 mmol/l. Jako závažný stav hodnotíme laktátovou acidózu, kde koncentrace laktátu je vyšší než 5 mmol/l a pH menší nebo rovno 7.250. Kazda se Zítkem sledovali prognostický význam koncentrace laktátu v šokových stavech a zjistili přímou závislost mortality na koncentraci laktátu.
- Typ B laktátové acidózy. Je vyvolán podáním celé řady látek, které zasahují na různých úrovních metabolismu. Působí buď na úrovni mitochondriální membrány nebo inhibicí aktivity některých enzymů. Při intenzivním metabolismu některých substrátů, které mají ve svých degradačních drahách NAD - dependentní kroky, jako např. sorbitol, fruktóza, etanol, stoupá poměr NADH : NAD+, a to vede ke snížení glukoneogeneze a sníženému odbourávání laktátu v játrech. Při podávání např. biguanidinových antidiabetik dochází k vystupňování metabolismu glukózy v cytosolu a k zásahu do respiračního řetězce na úrovni mitochondriálních membrán. Kongenitální laktátová acidóza typu B je podmíněna vrozenými defekty v glukoneogenezi, ev. defektem v oxidaci pyruvátu.
- Podáním toxických dávek biguanidinových antidiabetik,
salicylátů, Na-nitroprussidu.
- Podáním fruktosy a sorbitolu i.v.
- U otrav etanolem, metanolem, kyanidy, etylenglykolem, INH, CO, strychninem
- U diabetu, u některých maligních tumorů, u některých vrozených metabolických vad
- U respirační alkalózy
Jde buď o laktátovou acidózu nebo o ketoacidózu, případně o oba typy acidózy společně. U alkoholiků se jedná velmi často o smíšenou poruchu ABR, na jejímž vzniku se podílí jak laktátová acidóza, tak ketoacidóza z nedostatečného příjmu potravy. Hyperventilace a zvracení působí protichůdně a mohou vyvolat zároveň alkalózu respirační a metabolickou.
Požití větších dávek salicylátů vede, kromě jiného, i k metabolické acidóze. Na vzniku acidózy se podílejí kyseliny salicylová, mléčná a některé další kyseliny vznikající působením kyseliny salicylové. Porucha ABR, která při intoxikaci salicyláty vzniká, je vždy smíšená (MAC + RAL).
K podezření na otravu metanolem nebo etylenglykolem nás vede metabolická acidóza s hodnotou AG vyšší než 50 mmol/l. Metanol se pomalu oxiduje na kyselinu mravenčí cca 12 - 18 hodin po požití. Kyselina mravenčí působí toxicky zásahem do aerobního metabolismu a vede ke zmnožení organických kyselin včetně kyseliny mléčné. Při intoxikaci etylenglykolem je konečným produktem jeho degradace kyselina šťavelová. Acidóza jde na vrub kumulace této kyseliny. U otrav metanolem a etylenglykolem záleží velice na časné diagnóze, protože včasný terapeutický zásah může minimalizovat toxické poškození organismu a zabránit i rozvoji metabolické acidózy.
Neschopnost ledvin vylučovat denní produkci silných kyselin, respektive jejich aniontů (HSO4- a H2PO4-) způsobuje metabolickou acidózu se zvýšenými hodnotami AG a RA. Na regulaci metabolické acidózy při renálním selhání se výrazně podílí pufrovací kapacita kostního minerálu.
Příčinou metabolické alkalózy může být buď zvýšení SID nebo pokles Atot. V obou případech se zvyšuje koncentrace HCO3-, hodnota pCO2 se nemění a pH se zvyšuje.
a) Zvracení kyselého žaludečního obsahu, eventuálně odsávání kyselého žaludečního obsahu sondou. Za 24 hodin se v žaludeční šťávě odčerpá přibližně 40 až 160 mmol Na+, 15 mmol K+, 200 mmol Cl-, 25 až 100 mmol H+. Při zvracení nebo odsávání žaludečního obsahu jsou ztráty Cl- vyšší než ztráty Na+. Hypokalémie je způsobena spíše zvýšeným vylučováním K+ močí, než ztrátou žaludečního obsahu (sekundární hyperaldosteronismus ze sníženého objemu ECT).
b) Léčba diuretiky. Většina diuretik, která působí v oblasti vzestupného raménka (Furosemid, etacrinová kyselina, thiazidová diuretika), způsobují zvýšené vylučování Cl- a H+.
c) Zvýšené ztráty Cl- stolicí. U vrozených chloridy ztrácejících průjmů, dále u pacientů s adenomatózou tlustého střeva, obsahuje někdy stolice větší množství bílkovin, Na+, K+, ale hlavně Cl-.
d) Primární hyperaldosteronismus. Zvýšená sekrece aldosteronu vede ke zvýšené resorbci Na+, zvýšené sekreci H+ a K+, a k výrazně vyššímu vylučování Cl-. Výskyt metabolické alkalózy, hypokalémie a hypertenze bez známek deplece ECT vedou k podezření na hyperaldosteronismus.
e) Bartterův syndrom. Výskytuje se zpravidla u dětí, je způsoben zvýšenou hladinou reninu a aldosteronu při hyperplazii juxtaglomerulárního aparátu,a je charakteristický metabolickou alkalózou a hypokalémií bez hypertenze. Do jaké míry se na vzniku Bartterova syndromu podílí zvýšená produkce prostagladinů v ledvinách není jasné, avšak v řadě případů se osvědčila terapie inhibitory produkce prostaglandinů (indometacin). Pseudo Bartterův syndrom - převážně u dospělých, se projevuje trvající metabolickou alkalózou a hypokalémií nejasného původu.
f) Cushingův syndrom. Při nadprodukci glukokortikoidů, ale i mineralokortikoidů dochází k rozvoji mírné metabolické alkalózy a hypokalémie podobně jako u hyperaldosteronismu. Výraznou alkalózu a hypokalémii nacházíme u syndromu ektopické sekrece ACTH. Je to přičítáno silně zvýšené produkci deoxykortikosteronu a kortikosteronu.
g) Podávání preparátů z lékořice. Lékořice obsahuje látky, mající podobný účinek jako aldosteron. Vyvolávají hypertenzi, metabolickou alkalózu a hypokalémii.
a) Podávání NaHCO3 perorální, či parenterální. Při jednorázovém podání NaHCO3 ledviny velmi rychle vyloučí nadbytek hydrogenkarbonátů. Pouze trvalý přívod vede ke zvýšení jejich koncentrace a k metabolické alkalóze. U zdravého jedince při podávání větších dávek perorálně je vzestup koncentrace plazmatických hydrogenkarbonátů poměrně malý a to o 0.26 mmol/l pro 1 mmol hydrogenkarbonátu/kg hmotnosti/24 hodin. U pacientů s renální insuficiencí je snížena schopnost vylučování hydrogenkarbonátů a plazmatická koncentrace při perorálním podání stoupá výrazněji.
b) Parenterální podání solí organických kyselin. Na-acetát, Na-laktát, event. masivní transfúze krve s Na-citrátem jako antikoagulačním činidlem. Po zmetabolizování organických kyselin se zvětší SID, stoupne koncentrace hydrogenkarbonátů a projeví se metabolická alkalóza.
c) Náhlá úprava metabolické poruchy a metabolizace nahromaděných aniontů. Např. úprava diabetické ketoacidózy event. laktátové acidózy.
d) Podání velkých dávek solí léků jako např. Carbenicillin, PNC
e) Hyperkalcémie - ne při hyperparathyreóze. Hyperkalcémie při kostních metastázách nebo při myelomu je provázena alkalózou mírného stupně, která je připisována uvolňování nehydrogenkarbonátových nárazníků z kosti. U hyperparathyreózy se naopak působením parathormonu, který tlumí resorbci hydrogenkarbonátů v ledvinách, rozvíjí mírná acidóza, navzdory jeho destruktivnímu působení na kostní strukturu.
f) Koncentrační alkalóza, při zmenšení objemu ECT bez ztráty bazí.
Prakticky jde o stavy se sníženou koncentrací proteinů nebo samotného albuminu v krvi. Uvádí se, že pokles koncentrace albuminu o 10 g/l vede k vzestupu koncentrace HCO3- o 3 mmol/l. K poklesu koncentrace bílkovin plazmy dochází při zvýšených ztrátách, zejména GIT, při jejich nedostatečné syntéze a při vystupňovaném katabolismu.
Rozlišujeme akutní a chronickou respirační acidózu. Respirační acidóza je stav, který vzniká nerovnováhou mezi produkcí CO2 ve tkáních a jeho nedostatečným vylučováním v plicích. Denní produkce CO2 je přibližně 13000 - 15000 mmolů a stejné je i jeho vylučování plícemi. Při snížené účinnosti plicní exkrece CO2 stoupá pCO2 v alveolárním vzduchu, až se ustálí nová rovnováha mezi tvorbou a vylučováním. Se zvýšením pCO2 v alveolárním vzduchu se zvyšuje i pCO2 v krvi a klesá pH. Koncentrace hydrogenkarbonátů se sníží nepatrně.
Akutní nástup hyperkapnie je vždy provázen hypoxemií s určitým podílem laktátové acidózy. Podle druhu a stupně poruchy, která vyvolala akutní stav, objeví se u pacienta příznaky dechové tísně - neklid, tachypnoe, dyspnoe. Horší-li se stav, dochází až ke stuporu a kómatu. Příčiny akutní respirační acidózy můžeme rozdělit do několika skupin.
- Obstrukce dýchacích cest: laryngospasmus, bronchospasmus, aspirace cizího tělesa, aspirace zvratků, edém laryngu.
- Neuromuskulární příčiny: poškození mozkového kmene nebo prodloužené míchy s útlumem dechového centra, syndrom Guillan-Barré, myasthenia gravis, botulismus, tetanus, předávkování sedativy a narkotiky.
- Redukce dýchací plochy: pneumothorax, hemothorax, masivní pneumonie, těžký plicní oedém.
- Poruchy cirkulace: masivní plicní embolie.
- Špatně prováděná umělá ventilace.
Je způsobena chronickým snížením efektivní alveolární ventilace se vzestupem pCO2. V organismu dochází při trvající poruše k renální kompenzaci, která se rozvíjí a dosahuje maxima do 5 dnů. V rámci adaptace dochází k retenci Na+ a HCO3- a zvýšenému vylučování Cl2 nad 9 kPa dochází k jeho útlumu. Jako stimulační podnět působí v této fázi hypoxémie.
- nejčastější a nejobvyklejší příčinou chronické respirační acidózy je chronická obstruktivní choroba bronchopulmonální,
- chronické předávkování sedativy s následnou depresí dechového centra,
- primární alveolární hypoventilace,
- Pickwickův syndrom,
- neuromuskulární postižení - poliomyelitis, myopatie, roztroušená skleróza, paralýza bránice,
- anatomická postižení hrudníku omezující ventilaci - kyfoskolióza, hydrothorax, fibrothorax,
- další příčiny: terminální stádia intersticiální plicní fibrózy.
Vzniká, poklesne-li pCO2 v alveolárním vzduchu. K poklesu pCO2 dochází, když převládá exkrece CO2 plícemi nad jeho produkcí ve tkáních. Protože produkce CO2 ve tkáních je relativně konstantní, je pokles pCO2 primárně způsobován hyperventilací. K hyperventilaci může vést zvýšená neurochemická stimulace centrálními nebo periferními nervovými vlivy, hyperventilace při řízené ventilaci nebo vědomá hyperventilace pacienta. Nárazníková reakce u respirační alkalózy probíhá velmi rychle, aby se zabránilo výraznému vzestupu pH na hodnoty, které by mohly ohrozit životní funkce organismu. 99 % H+ pochází z nitrobuněčných zdrojů, tj. z laktátu a z organických kyselin, jejichž koncentrace v buňkách stoupá díky sníženému přísunu O2 (posun disociační křivky Hb doleva při alkalóze).
- Centrální stimulace dechového centra při strachu, bolesti, horečce, v těhotenství, při traumatech hlavy, mozkových tumorech, krvácení do CNS. Z léků vyvolávají hyperventilaci zejména salicyláty.
- Stimulace dechového centra z periferie. Plicní embolizace (menšího rozsahu nebo sukcesivní), městnavá slabost srdeční, intersticiální plicní fibróza, pneumonie, pobyt ve velké výšce.
- U pacientů s cirhózou mohou být příčinou zmnožené plicní zkraty, ev. zvýšená koncentrace amoniaku. U gramnegativní sepse a některých forem šoku patří respirační alkalóza k časným příznakům.
- Při umělé ventilaci se může nesprávným nastavením přístroje způsobit pokles pCO2 a respirační alkalóza.
Vyskytují se poměrně často. Jde o kombinaci dvou nebo více základních poruch nebo o více příčin, které vyvolávají tutéž poruchu ABR. Při hodnocení smíšených poruch je třeba vycházet z komplexního hodnocení anamnézy, fyzikálního nálezu a všech potřebných laboratorních vyšetření, ne pouze z hodnocení výsledků vyšetření parametrů ABR.
- respirační acidóza a metabolická alkalóza,
- respirační acidóza a metabolická acidóza,
- respirační alkalóza a metabolická acidóza,
- respirační alkalóza a metabolická alkalóza,
- metabolická acidóza a metabolická alkalóza.
U pacientů s chronickým plicním onemocněním, kde je rozvinutá ustálená respirační acidóza, se může objevit městnavá srdeční slabost (dekompenzované cor pulmonale). Podání diuretik způsobí zvýšenou ztrátu Cl-, zvětšení SID a následné zvýšení koncentrace HCO3- v míře větší, než odpovídá ustálené respirační acidóze. Rovněž ztráta kyselého žaludečního obsahu při zvracení přispívá u těchto pacientů k rozvoji metabolické alkalózy.
Tato smíšená porucha se nejčastěji rozvíjí u pacientů se zástavou srdeční, kteří vyžadují kardiopulmonální resuscitaci, u pacientů s těžkým plicním edémem a u pacientů s metabolickou acidózou, kde dojde k selhání plicních funkcí. U pacientů se zástavou srdeční jde o kombinaci respirační acidózy a metabolické hypoxemické tkáňové laktátové acidózy.
Tuto kombinaci vídáme u pacientů s hepatálním selháním. Složka respirační alkalózy je podmíněna hyperventilací z dráždění dechového centra, složka metabolické acidózy buď renálním selháváním nebo renální tubulární acidózou, případně laktátovou acidózou ze sníženého metabolizování laktátu v poškozených játrech. Dále u pacientů s chronickým renálním selháním s metabolickou acidózou, kteří při nasedající uroinfekci s bakteriémií hyperventilují. Otrava salicyláty vyvolává také smíšenou poruchu ABR typu respirační alkalózy (toxické dráždění dechového centra) a metabolické acidózy (jednak působením salicylové kyseliny, jednak mechanismem laktátové acidózy typu B).
Kombinace respirační a metabolické alkalózy se nejčastěji objevuje u pacientů s cirhózou, kteří hyperventilují, jsou léčeni diuretiky (ascites, edémy), jsou hypoproteinemičtí (pokles Atot) a případně zvrací. Může se také vyvinout u pacientů s chronickou respirační acidózou s rozvinutými kompenzačními ději se zvýšenou koncentrací bikarbonátu v krvi, kteří jsou náhle a prudce ventilováni s výrazným poklesem pCO2.
Jsou to poruchy působící proti sobě ve všech parametrech. Např. protrahované zvracení, které vyvolá metabolickou alkalózu a vede k hypovolémii a hypotenzi, které podmíní rozvoj metabolické acidózy z renálního selhání a event. tkáňovou laktátovou acidózu ze snížené perfuze a nedostatku O2. Přítomnost složek metabolické acidózy a alkalózy se snažíme diagnostikovat z klinického průběhu a z laboratorních parametrů a to zejména z BBS, AGap a RA. Pochopitelně může dojít i ke kombinaci více než dvou základních poruch: např. stav pacienta s metabolickou a respirační alkalózou při jaterním selhání se může komplikovat selháním renálním s metabolickou acidózou.
Obecné zásady terapie poruch ABR:
Terapie musí být především kauzální, to znamená odstranit příčinu, která poruchu ABR vyvolává. Musí být komplexní, neupravuje pouze pH, ale celé vnitřní prostředí. Pokud nelze vyvolávající příčinu odstranit, snažíme se upravit hodnotu pH krve k hodnotám optimálním. Řídíme se přitom zásadou, že organismu, který je adaptován na určité pH, prudká změna pH spíše uškodí než prospěje. Při úpravě pH je nutno počítat se stupněm rozvinutí kompenzačních a korekčních dějů a s předpokládanou dobou jejich trvání.
Působí zvýšení koncentrace hydrogenkarbonátů, buď jejich přímým podáním, nejčastěji ve formě roztoku hydrogenkarbonátu sodného nebo podáním roztoků, které obsahují sodné či draselné soli organických kyselin. Po zmetabolizování organických aniontů zůstává v nadbytku silný kation a dojde ke zvětšení SID.
Z důvodů elektroneutrality se generuje hydrogenkarbonát a jeho koncentrace v krvi se zvýší.
8.4 % roztok hydrogenkarbonátu sodného je roztok jednomolární, to znamená, že v 1 ml roztoku je 1 mmol NaHCO3 a 4.2 % roztok hydrogenkarbonátu je tedy 0.5 molární, v 1 ml roztoku je 0.5 mmol NaHCO3. Oba roztoky jsou výrazně hyperosmolární, proto se přidávají k hypotonickým ev. isotonickým infuzním roztokům. Při podávání větších dávek hydrogenkarbonátu sodného je třeba mít na zřeteli, že organismu dodáváme i nezanedbatelné množství Na. V poslední době se na základě experimentů na zvířatech i lidech dochází k názoru, že podání NaHCO3 vyvolává intracelulární acidózu, která vzniká proto, že podaný hydrogenkarbonát je titrován protony na H2CO3, která dává vznik CO2 a H2O. Za normálních podmínek perfuze tkání a za normální plicní ventilace je vzniklý CO2 z organismi odstraňován. Vázne-li ale perfuze nebo plicní ventilace, dochází k hromadění CO2 a intracelulární acidóze. Větší dávky NaHCO3 podané i.v. v akutních stavech vedou navíc ještě k hyperosmolalitě. Z těchto důvodů se názory na podávání hydrogenkarbonátů v akutních stavech liší. Někteří jeho podání nedoporučují, jiní jej naopak podávají k úpravě pH extracelulární tekutiny.
3.64 % roztok je izotonický a obsahuje v 1000 ml 300 mmol báze. Působí intracelulárně, váže H+ z H2CO3 a tím zvyšuje koncentraci hydrogenkarbonátu. Někdy vyvolává útlum dechového centra. Pomaleji se vylučuje z organismu. Při aplikaci THAMu je třeba mít možnost případné řízené ventilace pro přechodný útlum dechového centra. Popisovány bývají i přechodné hypoglykémie.
Na-laktát, Na, K-citrát, event. acetát působí alkalizačně jen tehdy, jsou-li předpoklady pro zmetabolizování aniontu organické kyseliny.
K úpravě metabolické alkalózy používáme acidifikující roztoky. U většiny těchto roztoků se dodává v nadbytku Cl-, tím dochází ke zmenšení SID a ekvivalentnímu poklesu koncentrace hydrogenkarbonátů.
Obsahuje 154 mmol/l Na+ a 154 mmol/l Cl-. Poměr Na:Cl je 1:1, zatímco v plazmě je tento poměr 1,4:1. Izotonický roztok NaCl obsahuje ve srovnání s plazmou relativní nadbytek Cl-. 1000 ml fyziologického roztoku je ekvivalentní 53 mmol Cl, tedy stejnému množství kyseliny. Kromě toho neobsahuje žádný hydrogenkarbonát, to znamená, že na 1000 ml schází ještě 24 mmol HCO3-. Dilucí stávající koncentrace hydrogenkarbonátů, při prakticky okamžité ekvilibraci CO2 působí též acidifikačně.
Používá se spíše perorálně, parenterální použití není vhodné. Podání je omezeno na pacienty, u kterých je předpoklad, že jsou schopni metabolizovat NH3. U pacientů s poškozením jaterního parenchymu je podání NH4Cl kontraindikováno.
4,2 % roztok, 1000 ml roztoku je ekvivalentní 200 mmol kyselin. I proti jeho používání jsou námitky. Bazická aminokyselina arginin působí v nitru buňky alkalizačně a teprve po její metabolizaci se uplatní acidifikační vliv Cl-. Kromě toho byly po podání Arginin hydrochloridu popsány i těžké hyperkalémie.
Podává se silně zředěná 0,1 - 0,15 mol/l katetrem do velkých žil, pomalu, aby nedošlo k poškození žilní stěny a erytrocytů.
Diuretikum, inhibitor karboanhydrázy, zvyšuje vylučování HCO3- a kalia ledvinami. Je vhodný k podávání u pacientů s metabolickou alkalózou spojenou s městnavou slabostí srdeční s neschopností snášet zátěž většími objemy tekutin např. fyziologickým roztokem.
Při úpravě pH vnitřního prostředí používáme některé výpočty potřebného množství korigujících roztoků. Základní vzorec pro úpravu BE nebo BD v krvi je vzorec podle Mellemgarda a Astrupa:
| mmol HCO3- = BD . 0,3 . kg . | pHcílové - pHzjištěné |
| --------------------- | |
| pHx - pHzjištěné |
Hodnotu pHx vyhledáme z tabulky podle pCO2 pacienta:
Vypočtenou dávku potřebnou ke korekci nepodáváme najednou. Po podání cca jedné poloviny vypočtené dávky zkontrolujeme parametry ABR a další dávkování řídíme podle zjištěných hodnot.
Doporučená literatura:
Biochemická vyšetření při onemocněních ledvin a močových cest patří k základním vyšetřením, nezbytným pro stanovení diagnózy, sledování průběhu onemocnění a hodnocení účinků terapie. Ledviny se podílejí jak na homeostáze vody a iontů, tak na exkreci odpadních látek a proto sledujeme pomocí biochemických vyšetření převážně změny postihující tyto základní funkce. Vyšetření ledvin musí být komplexní, postupujeme však většinou od vyšetření jednodušších ke složitějším. Potřebné informace získáváme vyšetřením moči, jako konečného produktu funkce ledvin, vyšetřením koncentrace některých látek v krvi a v moči s následnými výpočty a pomocí funkčních testů. Při vyšetření u urolithiázy je mimo jiné nutná i analýza močového konkrementu.
1. Chemické vyšetření moči a vyšetření močového sedimentu
Moč se získává nejlépe spontánní mikcí, od cévkování se ustupuje především pro možnost zanesení sekundární infekce do vývodných cest močových. Pacient musí být poučen o nutnosti očištění ústí uretry před mikcí. K vyšetření používáme tzv. střední proud moči. Močí se do suché, čistě vymyté, uzavíratelné nádoby, ve které nesmí být zbytky např. desinfekčních činidel, které by mohly ovlivnit výsledky chemické analýzy. U žen nevyšetřujeme moč v období menses nebo krátce před a po menses (erytrocyty v moči). Je-li v tomto období vyšetření moči nezbytné, je nutno vyšetřovat moč cévkovanou.
Moč je třeba k vyšetření dopravit co nejdříve, tak aby vyšetření močového sedimentu bylo provedeno maximálně do dvou hodin po vymočení.
1.1 Chemické kvalitativní vyšetření moči
K chemickému důkazu přítomnosti jednotlivých patologických složek se dnes používají nejčastěji testační papírky naší i zahraniční provenience, kterými lze současně provést vyšetření až 10 parametrů. To umožňuje ještě vyšetření dalších patologických součástí moče, jako jsou:
Tekutá činidla se v běžném rutinním vyšetřování moče používají jen vzácně.
1.1.1 Orientační stanovení pH
1.1.2 Orientační stanovení hustoty
1.1.3 Bílkovina v moči
a) U testačních proužků se využívá tzv. proteinové chyby acidobázického indikátoru. Proužek je impregnován acidobázickým indikátorem a pufrem s pH v oblasti normálního barevného přechodu acidobázického indikátoru. V přítomnosti bílkoviny reaguje indikátor, jako by pH bylo alkaličtější a mění barvu. Silně alkalické moče jsou k vyšetření indikátorovým proužkem nevhodné, protože dávají falešně pozitivní reakce. Změna zbarvení indikátorového proužku se srovnává s barevnou stupnicí a tak se odhaduje semikvantitativně koncentrace bílkoviny ve vyšetřované moči. Citlivost proužků je od 0.12 až 0.20 g/l.
b) Bílkovinu v moči lze denaturovat přidáním roztoku kyseliny sulfosalicylové. Projeví se to vznikem zákalu až sraženiny. Falešně pozitivní reakci dávají v moči přítomné sulfonamidy, perorální antidiabetika a vyšší koncentrace penicilinu.
1.1.4 Krev, krevní barvivo v moči
1.1.5 Leukocyty v moči
1.1.6 Glukóza v moči
1.1.7 Důkaz dusitanů
1.1.8 Ketolátky (kyselina acetoctová, beta-hydroxymáselná, aceton)
1.1.9 Urobilinogen
1.1.10 Bilirubin
1.2 Vyšetření močového sedimentu
Rozlišujeme:
Jak pro semikvantitativní vyšetření, tak pro kvantitativní vyšetření močového sedimentu se užívají standardizované postupy, aby výsledky jednotlivých laboratoří byly dobře vzájemně srovnatelné.
U semikvantitativních vyšetření močového sedimentu se bere ke zpracování ranní moč, která nemá být starší než 2 hodiny. Nelze-li dobu dodržet, konzervuje se moč přidáním několika kapek fenolu nebo 1 ml 10% roztoku thymolu v isopropanolu na 10 ml moči.
U semikvantitativního vyšetření vyjadřujeme výsledky v arbitrárních jednotkách:
Bedřich Nejedlý a spolupracovníci: Vnitřní prostředí, klinická biochemie a praxe.
Avicenum, zdrav. nakladatelství Praha 1980
Antonín Kazda: Biochemické monitorování nemocných v intenzivní a resuscitační péči. Avicenum, zdrav. nakladatelství Praha 1984
Jaroslav Masopust: Požadování a hodnocení biochemických vyšetření. Zdravotnické aktuality 216. Avicenum, zdrav. nakladatelství Praha 1990
Robert W. Schrier: Renal and Electrolyte Disorders. Little, Brown and Company 1992
Kolektiv autorů: Vybrané kapitoly z problematiky biochemického sledování v intenzivní péči. Účelová publikace, vyd. STAPRO,spol.s.r.o., Pardubice 1990
Biochemická syndromologie nemocí ledvin a močových cest
Autor kapitoly: MUDr.Pavel Pick, Ústav klinické biochemie VFN a 1.LF UK Praha
Provádí se z čerstvé, pokud možno ranní moči. Ranní moč vyšetřujeme proto, že v ní bývá nejvíce patologických součástí. Dáváme však přednost moči co nejčerstvější, hlavně proto, aby se v ní zachovalo co nejvíce intaktních buněčných elementů, případně válců.
Pro posouzení renální patologie mají z chemického kvalitativního vyšetření význam především:
Orientační zjištění hustoty (měrné hmotnosti)
Orientační stanovení pH moči
Zjištění bílkoviny v moči
Zjištění krve v moči
Průkaz leukocyturie
Zjištění glukózy
Zjištění nitritů
ketolátky
bilirubin
urobilinogen.
Zjišťuje se zpravidla testačním proužkem impregnovaným acidobázickým indikátorem. Změny barvy srovnáváne s barevnou stupnicí a vyjadřujeme s přesností ± 0.5 pH. Možné je i přesnější měření pH-metrem, které má své místo v diagnostice renálních tubulárních acidóz.
Provádí se testačním proužkem, který reaguje s ionty přítomnými v měřené moči. Jejich koncentrace dobře koreluje s hustotou moče. Komplexotvorné činidlo uvolňuje protony (H+) v přítomnosti kationtů. Uvolněné protony reagují s acidobázickým indikátorem, bromthymolovou modří, a mění barvu indikátoru. Pozor na falešně vyšší výsledky v močích, které mají vysokou koncentraci bílkovin!
Zjišťuje se nejčastěji
a) testačním proužkem
b) 20% roztokem kys. sulfosalicylové
K důkazu se používá testační proužek, který umožňuje orientační zjištění volného hemoglobinu, případně erytrocytů v moči. Hemoglobin volný nebo vázaný v erytrocytech uvolňuje z organického peroxidu kyslík a ten oxiduje redox indikátor, který je v redukované formě bezbarvý. Oxidovaný chromogen je na rozdíl od redukovaného zbarvený a to se projeví buď difuzním zbarvením proužku (volný hemoglobin) nebo vznikem barevných teček (erytrocyty). Falešně pozitivní reakce bývá v přítomnosti většího množství leukocytů nebo bakterií vybavených pseudoperoxidázovou aktivitou. Hodnocení je semikvantitativní srovnáním s barevnou stupnicí. Citlivost reakce je 5-10 erytrocytů v 1 ul moči.
Nepřímé zjištění přítomnosti leukocytů v moči se provádí testačním proužkem (Leukophan, Cyturtest a j.). Pozitivita testu se projeví změnou barvy a je způsobena esterázovou aktivitou leukocytů. Citlivost je nad 10 leukocytů v 1 ul moče.
Průkaz glukózy v moči má význam hlavně pro zjišťování diabetu a některých renálních poruch. Provádí se specificky testačním proužkem napojeným redox indikátorem a enzymy glukozaoxidázou a peroxidázou. Ty katalyzují oxidaci glukózy na glukonolakton. Současně vzniklý peroxid vodíku se působením peroxidázy štěpí na vodu a kyslík. Vzniklý kyslík oxiduje redox indikátor, jehož oxidace se projeví změnou barvy. Citlivost zkoušky je nad 2 mmol/l. Falešná pozitivita se objevuje u močí obsahujících oxidující látky (chloramin, persteril, peroxid). Falešně negativní může být vyšetření močí s vysokou koncentrací redukujících látek (kys. askorbová, palerol).
Tímto testem zjišťujeme přítomnost bakterií, které jsou schopny měnit dusičnany v moči normálně přítomné, na dusitany. Jde zejména o Escherichia colli, Proteus, Klebsiella, Aerobacter, a o řadu dalších, které mohou vyvolávat infekce ledvin a močových cest. Vzniklé dusitany reagují s modifikovaným Griessovým činidlem za vzniku červeného zbarvení. Vyšetření je třeba provádět z čerstvé ranní moči. Citlivost je od 105 mikrobů v 1 ml moče.
Ketolátky se dokazují reakcí s nitroprussidem sodným v alkalickém prostředí (Legalova zkouška). Pozitivita se projeví změnou barvy testační zóny do fialové. Reakce je senzitívnější pro kyselinu acetoctovou než pro aceton a beta-hydroxymáselnou kyselinu.
Stabilizovaná diazoniová sůl v kyselém prostředí reaguje s urobilinogenem téměř okamžitě za vzniku červeného azobarviva. To se projevuje změnou barvy testační zóny do růžovočervené. Falešně pozitívní reakci dávají některé léky. Test je specifičtější pro urobilinogen než dosud používaná zkouška s Ehrlichovým činidlem.
Průkaz bilirubinu je založen na kopulační reakci bilirubinu s diazoniovou solí. Falešně negatívní výsledky mohou být způsobeny vysokou koncentrací kyseliny askorbové ve vyšetřované moči. Moč, ve které vyšetřujeme bilirubin, nemá být delší dobu exponovaná přímému slunečnímu světlu (oxidace bilirubinu - falešně negatívní výsledek).
Je indikováno při pozitivním nálezu chemického vyšetření moče, při pozitivním výsledku vyšetření leukocytů, při nefrologické nebo urologické kontrole a při klinickém podezření na onemocnění ledvin a vývodných cest močových.
1. Semikvantitativní vyšetření močového sedimentu po odstředění moče za standardních podmínek.
2. Kvantitativní vyšetření močového sedimentu dle Hamburgera.
3. Kvantitativní vyšetření močového sedimentu dle Addise (dnes považováno za obsolentní).
pole za stand. podm. | |||||
U kvantitativního vyšetření dle Hamburgera se moč sbírá 3 hodiny. Dobu sběru je třeba udávat s přesností na minuty a do laboratoře se dodá celý objem nasbírané moče, který se přesně změří. Objem nemá být menší než 100 ml. Moč je nutné dodat do laboratoře co nejdříve po skončení sběru. U kvantitativního vyšetření močového sedimentu podle Hamburgera se hodnotí počet elementů za 1 minutu:
Erytrocyty do 2000/min.
Leukocyty do 4000/min.
Válce do 60 - 70/min.
Kvantitativní vyšetření močového sedimentu podle Addise se již neprovádí, protože doba sběru 12 hodin je pro zachování buněčných elementů a válců neúměrně dlouhá, elementy se rozpadají a dochází k chybným výsledkům.
1.3 Hodnocení patologických nálezů močového sedimentu
1.3.1.1 Glomerulární erytrocyturie
1.3.1.2 Neglomerulární erytrocyturie
b) Z močových cest
1.3.2 Leukocyty v moči, leukocyturie
1.3.3 Zmnožení válců
1.3.3.1 Hyalinní válce
1.3.3.2 Granulované válce
1.3.3.3 Válce voskové
1.3.3.4 Erytrocytární válce
1.3.3.5 Leukocytární válce
1.3.3.6 Válce z tubulárních epitelií
1.3.3.7 Válce tukové a válce z tukových buněk
1.3.4 Epitelie
1.3.4.2 Epitelie z ostatních částí urogenitálního ústrojí
1.3.4.3 Dlaždicové epitelie
1.4 Další elementy
2. Proteinurie a jejich dělení
Příklad:
Kromě kvantifikace ztrát bílkovin je výhodné znát i spektrum vylučovaných proteinů k posouzení selektivity a k rozlišení původu proteinurie. K tomu se používají hlavně metody elektroforézy v agarozovém nebo polyakrylamidovém gelu, dále stanovení albuminu a b2-mikroglobulinu.
2.1 Dělení proteinurií podle místa původu
2.1.1 Renální proteinurie
Selektivní glomerulární proteinurie
Neselektivní glomerulární proteinurie
U inkompletní tubulární mikroproteinurie se v moči objeví mikroproteiny s molekulovou hmotností od 10 000 do 40 000, t.j. b2-mikroglobulin, retinol vázající globulin, a1 kyselý glykoprotein (Obr. 4.1).
2.1.1.3 Smíšené proteinurie
2.1.2 Prerenální proteinurie
2.1.3 Postrenální proteinurie
2.2 Dělení proteinurií dle intenzity a příčin
2.2.2 Koncentrace okolo 1 g/l
2.2.3 Koncentrace do 5 g/l
2.2.4 Proteinurie nad 5 g/l
2.3 Klinicko-diagnostické hledisko třídění proteinurií
2.3.1 Intermitentní proteinurie
2.3.2 Perzistující proteinurie
2.4 Vyšetření albuminurie
3. Vyšetření koncentrace kreatininu v séru
Referenční hodnoty:
Kreatinin vzniká z kreatinu neenzymovou dehydratací. Protože jde o konečný produkt svalového metabolizmu, je velikost svalové hmoty jedním z určujících faktorů koncentrace kreatininu v krvi. Druhým faktorem je vylučování kreatininu z krve ledvinami. Výsledkem obou vzájemně protichůdně působících mechanizmů je nastolení určité rovnováhy a z ní rezultující koncentrace kreatininu v krvi.
Pro stanovení kreatininu v séru i v moči se dosud používají metody založené na nespecifické Jaffého reakci s kyselinou pikrovou v alkalickém prostředí. Kromě kreatininu se uplatňují i t.zv. nespecifické Jaffé-pozitivní chromogeny, jako jsou některé oxokyseliny, kyselina askorbová a pod. Různé metodické úpravy se sice snaží vliv nespecifických chromogenů eliminovat, přesto ale při stanovování koncentrace kreatininu dostáváme díky jim hodnoty až o 10 mmol/l vyšší. Koncentrace
nespecifických chromogenů ovšem nebývá konstantní. Plně specifické enzymové metody ke stanovení koncentrace kreatininu se začínají prosazovat až v poslední době.
Koncentrace kreatininu se mění v závislosti na svalové činnosti, na příjmu exogenního kreatininu potravou a na změnách v renálním vylučování. Vztah mezi koncentrací kreatininu a glomerulární filtrací je hyperbolický. Pokles glomerulární filtrace způsobí vzestup koncentrace kreatininu v séru až při poklesu na 50 % původní hodnoty. Z toho vyplývá, že pro včasnou diagnostiku snížení renálních funkcí je samotné stanovení koncentrace kreatininu v séru málo citlivé.
Zvýšení koncentrace kreatininu v krvi může svědčit o:
Pro dlouhodobé sledování pacientů s chronickou renální insuficiencí se doporučuje sledování reciproké hodnoty (1 : Skreatinin), spíše, než opakované glomerulární filtrace.
4. Stanovení urey
Urea vzniká jako produkt metabolismu bílkovin. Metabolizováním 2.9 g bílkovin vzniká 1 g urey. Kromě vylučování ledvinami, kde je většina močoviny z těla odstraňována, je ještě z malé části metabolizována ve střevě, kam difunduje zejména při renální insuficienci, a její -NH2 skupina je inkorporovaná do oxokyselin, ze kterých vznikají aminokyseliny a bílkoviny.
Na koncentraci močoviny v krvi má vliv:
Urea je vylučována glomerulární filtrací, na rozdíl od kreatininu je ale zpětně resorbována. Koncentrace sérové urey se mění v závislosti na poklesu filtrace pod 30 % původní hodnoty (kreatinin pod 50 %). V proximálním tubulu se zpětně resorbuje 40 - 50 % profiltrované urey. V distálním tubulu závisí resorbce na tom, zda je vylučována koncentrovaná, či zředěná moč. Za podmínek vodní diurézy je urea resorbovaná pouze v proximálním tubulu. Při antidiuréze se v distálním tubulu výrazně projeví zpětná resorbce až 60 % urey. Proto se dehydratace organizmu projevuje vzestupem koncentrace urey v séru. U pacientů dobře hydratovaných a při vyvážené dietě je clearance urey proporcionální glomerulární filtraci. Pokles koncentrace močoviny na základě poškození jaterního parenchymu nastává až v době, kdy jsou játra na pokraji selhání.
Stanovení močoviny má význam v diferenciální diagnostice prerenálního a renálního selhání. U prerenálního postižení způsobovaného hlavně dehydratací, stoupá koncentrace urey v séru výrazněji než koncentrace kreatininu. Zároveň je i vysoká koncentrace močoviny v moči, která má rovněž vysokou osmolalitu. Zvýšené koncentrace urey dále nacházíme u akutní i chronické renální insuficience, u zvýšeného katabolismu proteinů a při krvácení do zažívacího traktu.
5. Funkční vyšetření ledvin
5.1 Vyšetření glomerulární filtrace
Při výpočtech clearance kreatininu vycházíme ze vztahu
1.3.1 Zmnožení erytrocytů a hemoglobinu, erytrocyturie, hematurie
Samotný chemický nález krve v moči není dostatečně průkazný pro hematurii. Vždy je nutné mikroskopické vyšetření močového sedimentu, které je pro hematurii jedině průkazné. Hematurie může být buď mikroskopická nebo makroskopická. Podle původu rozeznáváme hematurii
1) glomerulární
2) neglomerulární
a) renální
b) z močových cest.
U glomerulární erytrocyturii dojde při průchodu erytrocytu glomerulární membránou k deformaci tvarové a ke změně ve struktuře erytrocytární membrány. Rozlišení mezi erytrocyty, které glomerulární membránou prošly a ostatními je vcelku spolehlivě možné vyšetřením močového sedimentu ve fázovém kontrastu, kde jsou změny tvaru erytrocytů a struktury erytrocytární membrány dobře hodnotitelné. U chronických glomerulopatií má význam současné posouzení stupně erytrocyturie a proteinurie, zejména pro diferenciálně diagnostické posouzení příčiny glomerulárního postižení.
a) Renální
Diferenciálně diagnosticky je třeba uvažovat o krvácení z prasklých cév při tumorech renálního parenchymu (nejčastěji Grawitzův tumor), při cystóze ledvin, nebo při tuberkulóze ledvin.
Bývá způsobena konkrementy, zánětlivým překrvením sliznic, tumory a poraněními.
Leukocyturie se vyskytuje u intersticiální nefritidy, zánětlivých onemocnění vývodných cest močových různé etiologie (bakteriální ev. virové infekce), u zánětů způsobených prvoky, plísněmi atd. Opakované leukocyturie bývají u malformací uropoetického ústrojí, při urolitiáze, event. u nádorů močových cest a močového měchýře. Při úporné leukocyturii je třeba myslet na TBC ledvin a vyšetřit opakovaně moč kultivačně na BK.
Válce vznikají výhradně v kanálcích ledvinových jako jejich odlitky. Matrix válců tvoří t.zv. Tammův-Horsfallův protein, což je mukoprotein secernovaný tubulárními buňkami. Rozlišujeme válce hyalinní, granulované, voskové, tukové a buněčné (erytrocytární, leukocytární, epiteliální).
Jsou tvořeny aglutinovaným proteinem, který vypadává z moči v kyselém prostředí, v blízkosti isoelektrického bodu bílkovin. Jejich nález v moči je projevem proteinurie. V malém množství se mohou nacházet i v moči zdravých osob. Větší množství hyalinních válců se může objevit po podání diuretik, při zvýšené tělesné námaze a při horečce.
Jejich matrix je tvořena Tammovým-Horsfallovým proteinem. Výklad vzniku granulovaných válců není jednotný. Soudí se, že granula jsou buď z rozpadlých tubulárních buněk, nebo z agregovaných sérových proteinů. Jejich výskyt svědčí pro patologický proces v ledvinách, není jednoty zda pro glomerulární či tubulární.
Vznikají patrně jako konečné stádium válců granulovaných, jsou silně světlolomné.
Vyskytují se u glomerulárních erytrocyturií. Jsou tvořeny erytrocyty nalepenými na základ hyalinního nebo jiného typu válce.
Jsou tvořeny leukocyty. Nacházíme je v močích pacientů s intersticiální nefritidou. Jsou velmi málo kontrastní a zachovají se pouze ve skutečně čerstvé moči. Abychom je nalezli, je po nich třeba důkladně pátrat.
Jsou tvořeny odloupanými a degenerovanými epiteliálními buňkami z tubulů a jejich nález ukazuje na tubulární poškození.
Prokazují se nejlépe v polarizovaném světle. Vyskytují se zároveň s masivní proteinurií. K lipidurii dochází díky zvýšené filtraci lipoproteinů. Pro nefrotický
syndrom jsou typické buňky naplněné anisotropními lipidy - oválná tuková tělíska t.zv. brown bodies.
1.3.4.1 Epitelie z renálních tubulů
Jsou buď kulaté, nepravidelně polygonální, kubické nebo fasetované, lehce větší než granulocyty s velkým jádrem a lehce granulovaným chromatinem, spíše basofilní. Jejich identifikace je obtížná. Zmnožení svědčí pro postižení tubulů.
U těchto epitelií není možná lokalizace jejich původu do určité části urogenitálního traktu. Jejich tvar záleží na vrstvě epitelu, ze které pocházejí. Zmnožení svědčí pro zánětlivý proces s intenzívnější deskvamací epitelu, bez možnosti lokalizace procesu.
Pocházejí ze zevního genitálu (vagina) a z uretry. Jsou charakteristické svými rozměry (velké), jsou ploché, event. kubické a mají ve srovnání s protoplazmou velmi malé jádro. S ostatními epiteliemi se nedají zaměnit. Výskyt dlaždicových epitelií je nejčastější v moči u žen, diagnostický význam je nulový.
Dalšími elementy, které se v močovém sedimentu mohou vyskytovat, jsou bakterie, krystaly, kvasinky, plísně, trichomonády, občas spermie, vlákna textilu, granule pudru apod. Odhad intenzity bakteriurie je možný pouze ve zcela čerstvých močích; ve starších močích dochází k výraznému pomnožení bakterií. Kvasinky se nalézají zejména v močích diabetiků. Trichomonády lze nalézt jen v čerstvé moči jako organismy s typickým vířivým pohybem bičíku. Z krystalů můžeme nacházet urátové, fosfátové, oxalátové a další. Jejich nález není pro diagnostiku příliš významný.
Při pozitívním nálezu bílkoviny v moči je užitečné zjistit i celkové množství bílkovin vyloučených za 24 hodin. Fyziologicky se močí vylučuje za 24 hodin 40 -
100 mg proteinů s maximem 150 mg. Část z toho množství tvoří bílkoviny plazmatické (albumin, IgG, IgA), část bílkoviny secernované v tubulech. Při normální diuréze je koncentrace bílkovin v moči tak nízká, že se běžnými metodami vůbec neprokáží. Pro diagnostiku proteinurií stanovujeme koncentraci bílkovin v moči v g/l a z objemu diurézy v litrech vypočítáváme ztráty bílkoviny v g/24 hodin.
Diuréza za 24 hod = 1450 ml, koncentrace bílkovin v moči = 0.81 g/l,
množství vyloučené bílkoviny za 24 hodin (ztráty)= 0.81x1.45 = 1.2 g/24 h.
Podle místa původu lze proteinurie rozdělovat na
renální
glomerulární,
tubulární,
smíšené,
prerenální a
postrenální.
2.1.1.1 Glomerulární proteinurie
Změněná permeabilita glomerulů umožňuje přestup molekul bílkovin do glomerulárního filtrátu a odtud do moči. Rozlišujeme selektivní a neselektivní typ glomerulární proteinurie.
Je způsobena postižením vnější části bazální membrány a podocytů. V moči nacházíme především albumin s Mr 67 000 a transferrin o Mr 89 000. Bílkoviny s větší molekulovou hmotností, tedy zejména imunoglobuliny, se v moči neprokazují.
Je způsobena postižením vnitřní části bazální membrány a mesangia. Do moči kromě albuminu a transferrinu pronikají i imunoglobuliny s větší molekulovou hmotností, především IgG.
 2.1.1.2 Tubulární mikroproteinurie
2.1.1.2 Tubulární mikroproteinurie
Tubulární proteinurie může být kompletní nebo inkompletní. U kompletních jsou vylučovány prakticky všechny mikroproteiny s mol. hmotností od 10 000 do 70 000, t. zn. a1-antitrypsin, albumin, b2-mikroglobulin, retinol vázající globulin, a1 kyselý glykoprotein.
Jde o kombinaci glomerulární a tubulární proteinurie, projevuje se nejčastěji u chronické renální insuficience.
Dochází k ní vždy při zmnožení nízkomolekulárních bílkovin a polypeptidů v plazmě. V moči se objevují monomery, eventuálně dimery lehkých řetězců, případně hemoglobin nebo myoglobin.
Tato proteinurie se vyskytuje při krvácení, růstu maligních tumorů a při zánětech v močových cestách či v močovém měchýři.
2.2.1 Proteinurie do 1 g/l
U této proteinurie s opakovanou mikroskopickou hematurií, nebo u intermitentní proteinurie s makroskopickou hematurií uvažujeme o glomerulárním původu, např. o chronické glomerulonefritidě, nebo o neglomerulárním původu např. při nefrolitiáze, tumoru, nebo tuberkulóze ledvin.
Tato proteinurie svědčí pro chronická poškození ledvin, zejména intersticiální nefritidou, nebo pro toxické poškození např. léky (fenacetin a j.)
Příčinou takové proteinurie je nejčastěji akutní glomerulonefritis nebo akutní toxické poškození ledvin. V sedimentu močovém bývá současně zmnožení erytrocytů a granulovaných válců.
Tato proteinurie svědčí pro nefrózu a nefrotický syndrom. Vyskytuje se i při masivním vylučování mikromolekulárního paraproteinu a při silné hematurii renálního i extrarenálního původu.
Z klinicko-diagnostického hlediska lze zmínit některé proteinurie, například intermitentní a perzistující.
a) Funkční proteinurie je přechodný vzestup koncentrace bílkovin v moči, který se projeví po jednorázové svalové námaze nebo po prochlazení.
b) Proteinurie po déletrvající svalové námaze v důsledku hemodynamických změn. U pacientů se zpravidla neprokáže žádné organické postižení ledvin.
c) Febrilní proteinurie při hyperpyrexii.
d) Posturální (ortostatická) proteinurie. Engliš ji zahrnuje do skupiny izolovaných asymptomatických proteinurií (viz přehled doporučené literatury). Proteinurie u postižených jedinců se objevuje pouze ve vztyčené poloze pacienta. Ve vzorcích moče získané vleže se bílkovina nenachází. Posturální proteinurii testujeme tak, že pacient sbírá moč ve striktně horizontální poloze 8 hodin (prakticky ranní moč) a po 16 hodin přes den při běžné tělesné aktivitě, a v obou vzorcích se stanoví proteinurie s extrapolací na 24 hodin. Posturální proteinurie je prognosticky benigním symptomem. U naprosté většiny postižených nebyly v průběhu desítek let nalezeny žádné známky ledvinového onemocnění. Posturální proteinurie je proteinurií glomerulární.
Jako perzistující proteinurii hodnotíme proteinurii trvale nalézanou v opakovaně vyšetřovaných vzorcích moče. Prakticky vždy svědčí o renálním onemocnění, i když jsou renální funkce intaktní a v sedimentu močovém je negativní nález. Do ztrát bílkovin 4 g denně může jít jak o postižení glomerulární, tak i o intersticiální
nefritidu, nad 4 g denně jde téměř jistě o glomerulární postižení. Na tomto místě je třeba zmínit nefrotický syndrom s minimálními lézemi, který je charakterizován selektivní glomerulární proteinurií a dobrou prognózou. Je prokázáno, že pacienti s perzistující proteinurií mají horší prognózu co do renálního selhání, než pacienti bez proteinurie. Horší prognózu mají pacienti s proteinurií spojenou s mikroskopickou hematurií, nebo s postupně progredující masivní proteinurií. Pro spolehlivé zjištění základního onemocnění, při němž se manifestuje proteinurie, se stále více uplatňuje renální biopsie.
Denní vylučování albuminu v moči se pohybuje v rozmezí do 20 až 30 mg za 24 hodin. Sledování albuminurie má dominantní význam pro hodnocení časných změn při diabetické nefropatii. Stoupá-li vylučování albuminu (mikroalbuminurie) nad 30 mg / 24 hod (30 až 150 mg), svědčí to s velkou pravděpodobností o vzniku diabetické nefropatie. V počátečních stadiích lze alespoň u některých pacientů vhodnou úpravou terapie rozvoj změn zpomalit, případně zvrátit a zabránit tak rozvoji diabetické nefropatie se všemi nepříznivými důsledky.
muži S-kreatinin 70 - 110 mmol/l
ženy S-kreatinin 60 - 100 mmol/l
1) renální insuficienci se snížením glomerulární filtrace pod 50%
2) postižení kosterního svalstva rozpadem, při traumatu, svalové dystrofii a.j.
3) akromegalii.
Referenční rozmezí: S-urea 1.7 - 8.3 mmol/l
a) obsah proteinů v dietě. Při dietě s vysokým obsahem proteinů stoupá koncentrace urey v krvi,
b) zvýšený katabolismus bílkovin - při horečce, sepsi, hladovění, krvácení do GIT, po podání kortikoidů atd. způsobí, že koncentrace urey je zvýšená,
c) změny ve vylučování urey ledvinami.
Vyšetření některých z mnoha funkcí, které ledviny v organizmu vykonávají umožňuje hodnotit rozsah fungujícího parenchymu, posoudit vztahy různých onemocnění ledvin, monitorovat změny funkcí v průběhu onemocnění, případně sledovat vliv léčby. V klinické praxi se nejvíce používají vyšetření
1) glomerulární filtrace,
2) koncentrační schopnosti ledvin a
3) některých dalších clearancových vyšetření.
K vyšetření glomerulární filtrace se nejčastěji používá měření clearance endogenního kreatininu. Tam, kde se požadují velmi exaktní informace a tam, kde to laboratoř umožňuje, lze vyšetřovat clearance inulinu. Velikost clearance nějaké rozpuštěné látky (solutu) odpovídá glomerulární filtraci za předpokladu, že se tato látka vylučuje pouze ultrafiltrací v glomerulech, nevstřebává se v kanálcích ledvin
a rovněž není v kanálcích do moči secernována. Kreatinin s určitým omezením splňuje předpoklady pro to, aby byla jeho clearance mírou glomerulární filtrace. Je to látka bezprahová, vylučuje se glomerulární filtrací, není zpětně resorbovaná a při normální plazmatické koncentraci se jen malý podíl (cca 10 %) vylučuje tubulární sekrecí. Kromě toho je koncentrace kreatininu v plazmě daného jedince za normálních okolností poměrně stálá.
který se upraví do vzorce pro výpočet glomerulární filtrace
| Gf = | U x V |
| ---------------- | |
| P |
P = koncentrace kreatininu v plazmě (tedy i v glomerulárním filtrátu),
Cl = objem glomerulárního ultrafiltrátu, resp. plazmy očistěné od kreatininu,
U = koncentrace kreatininu v (definitívní) moči,
V = objem (definitívní) moči.
Pro výpočet glomerulární filtrace potřebujeme znát koncentraci kreatininu v plazmě, koncentraci kreatininu v (definitívní) moči a objem (definitívní) moči za časovou jednotku. Vezmeme-li jako exaktní ukazatel velikosti glomerulární filtrace clearance inulinu, kterou ovšem rutinně běžně neměříme, pak clearance endogenního kreatininu dává hodnoty falešně vyšší a to o 7 - 10 %. Tento rozdíl se zvyšuje úměrně tomu, jak stoupá koncentrace kreatininu nad rozmezí normálních hodnot. Zvyšuje se totiž podíl kreatininu, který se tubulární sekrecí vylučuje do moči. Tak může hodnota kreatininové clearance ve srovnání s inulinovou clearancí vzrůstat až o 50 % i více. Vliv na hodnotu clearance endogenního kreatininu má i dieta (nadměrný přívod bílkovin v potravě zvyšuje hodnoty Gf), některé léky, jako například spironolakton, amilorid, cimetidin a trimetoprim, které snižují vylučování kreatininu močí. Rovněž těhotenství ovlivňuje velikost glomerulární filtrace. V prvním trimestriu může stoupnout až o 50 % a přetrvávat zvýšená až do porodu.
5.1.1 Praktické provedení
5.1.2 Rozmezí hodnot glomerulární filtrace podle věku a pohlaví
Moč se sbírá 24 hodin. Před započetím sběru moče se pacient vymočí a moč se vyleje. Potom se sbírá veškerá moč po dobu 24 hodin. Před ukončením sběru
moči se pacient vymočí, aby byla zachycena veškerá moč za 24 hodin. Po dobu pokusu se doporučuje dieta bez excesu v proteinech. Příjem tekutin se neomezuje. Pacienta je třeba důrazně upozornit, aby sebral veškerou moč, aby se vymočil vždy před stolicí, protože by došlo ke ztrátám moče. Moč se měří v odměrném válci s přesností na 10 ml. Na konci sběru moče odebereme na lačno i vzorek krve pro stanovení kreatininu. Do laboratoře se na žádance o vyšetření clearance kreatininu uvedou ještě údaje o výšce pacienta, tělesné hmotnosti, přesná doba sběru, přesný objem moči. Správnost výsledků ovlivňuje hlavně korektní sběr moče. U pacientů, kde není předpoklad dobré spolupráce při sběru moči, nemá smysl vyšetření provádět, neboť výsledky jsou špatné a zavádějící. Dalším faktorem je správné změření objemu vymočené moče. Ač je to k nevíře, sestry, které zaznamenávají objem vymočené moči, často objem odhadují přímo ve sběrné nádobě a nepoužívají odměrné válce. Tento prohřešek spolu s nízkou compliance pacienta, bývá nejčastější příčinou chyb. Dosazením nepřesného objemu do výpočtu clearance je znehodnoceno sebelépe provedené stanovení kreatininu a ošetřující lékař obdrží nesmyslný a nereprodukovatelný výsledek. Analytické chyby při laboratorním stanovení koncentrace kreatininu v krvi a v moči jsou způsobeny vesměs interferujícími látkami v séru i v moči, které zkreslují výsledky stanovení.
Vylučování kreatininu močí a koncentrace kreatininu v plazmě závisí na velikosti svalové hmoty a proto je snaha o korekci hodnot. Vypočítané výsledky clearance endogenního kreatininu korigujeme na standardní velikost tělesného povrchu 1.73 m2. Při výpočtu velikosti tělesného povrchu se vychází z výšky a tělesné hmotnosti pacienta a z nomogramů nebo tabulek, sestavených na bázi různých rovnic pro výpočet tělesného povrchu. Sledováním denního vylučování kreatininu v moči v závislosti na tělesné hmotnosti se alespoň zčásti můžeme přesvědčit, zda byl sběr moči korektní. Je-li kreatininurie nižší než 50 % předpokládané hodnoty, lze sběr moči označit za špatný.
Tabulka denního vylučování kreatininu v závislosti na věku a pohlaví
( mmol/kg/24 hod.)
K výpočtu clearance endogenního kreatininu patří i výpočet zpětné tubulární resorbce H2O:
| Tubul.resorbce = | Gf v ml/sec - sekundový objem def. moče (ml) |
| ----------------------------------------------- | |
| Gf ml/sec |
Referenční rozmezí hodnot: 0.998 - 0.988
Snížené hodnoty jsou při poruše zpětné resorbce vody.
5.1.3 Clearance kreatininu odhadnutá z kreatininémie a další
K výpočtu clearance kreatininu z koncentrace kreatininu v plazmě vede snaha o vyloučení vlivu nekorektního sběru moče na výsledek vyšetření. Vzorce pro výpočet přihlížejí k tělesné hmotnosti, věku a pohlaví a předpokládají pro tyto kategorie standardní odpad kreatininu v objemu vyloučené moči. Jako příklad může sloužit vzorec podle Cockrofta a Gaulta.
| Clearance kreatininu = | (140 - věk) x těl. hmotnost v kg |
| ----------------------------------------------- | |
| 48.9 x sérový kreatinin v mmol/l |
Existuje ještě celá řada dalších vzorců pro výpočet clearance, vyšetření glomerulární filtrace však nelze rozhodně výpočtem nahradit. Výrazná odchylka ve výsledku změřené glomerulární filtrace od hodnoty vypočtené musí budit pochybnosti o správnosti výsledku změřené glomerulární filtrace.
Z dalších clearancových technik se spíše výzkumně používá:
a) Vyšetření clearance inulinu umožňuje exaktní vyšetření glomerulární filtrace. Vyšetření je pracné a finančně nákladné. Ve srovnání s výsledky clearance endo
genního kreatininu jsou hodnoty nižší, protože inulin se vylučuje pouze glomerulární filtrací.
b) Vyšetření clearance PAH. Krev se při průchodu ledvinami prakticky zcela očistí od para-aminohippurové kyseliny (PAH), která se vylučuje glomerulární filtrací a tubulární exkrecí a není zpětně resorbována. Proto clearance PAH udává průtok krve ledvinami.
5.2 Měření hustoty a osmolality moče
5.3 Vyšetření koncentrační schopnosti ledvin
5.3.1 Koncentrační pokus klasickým postupem, žízněním
Maximální koncentrační schopnost ledvin u dospělých
Hustota (specifická, měrná hmotnost) moči je dána množstvím všech rozpuštěných látek vyloučených do moči. Osmolalita je dána množstvím osmoticky aktívních látek vyloučených do moči. Proto přímá korelace mezi osmolalitou a hustotou není možná, i když určitá vzájemná závislost existuje. Máme-li možnost měřit osmolalitu, dáváme jejímu měření přednost před zjišťováním hustoty. Metoda je exaktnější a výsledky umožňují provedení i dalších vyšetření (osmolární clearance). Je-li osmolalita moči nižší než osmolalita krve, tj. nižší než cca 290 mmol/kg H2O), jde o moč hypoosmolální. Isoosmolální moč má přibližně stejnou osmolalitu jako krev, hyperosmolální moč má osmolalitu vyšší. Osmolalita moči může kolísat od 50 do 1200 mmol/kg H2O.
Při tomto vyšetření se zjišťuje schopnost ledvin vytvářet koncentrovanou moč. Již v počátečních stadiích některých onemocnění ledvin bývá schopnost tvorby hyperosmolární moče narušena.
Pacient nesmí po dobu 36 hodin přijímat tekutiny, ani potraviny obsahující vyšší podíl vody. Po 12 hodinách od začátku pokusu se ve 4 hodinových intervalech pacient vždy vymočí. V každém vzorku moče se měří osmolalita nebo se zjistí hustota moče. Před posledním vzorkem odebereme i vzorek žilní krve pro určení koncentračního indexu. Koncentrační pokus končíme, jakmile pacient dosáhne alespoň v jednom vzorku maximální hodnoty hustoty nebo osmolality pro uvedenou věkovou kategorii. Pokus trvá maximálně 36 hodin. Je kontraindikován u pacientů v renální insuficienci, u dehydratovaných pacientů, u rozvratů vnitřního prostředí, u infekčních onemocnění ledvin a močových cest, u febrilních pacientů a všude tam, kde žíznění může nepříznivě ovlivnit zdravotní stav pacienta.
5.3.2 Adiuretinový test
Osmolální koncentrace moči pro hodnocení adiuretinového testu
Ve srovnání s klasickým postupem je adiuretinový test mnohem šetrnější a nezatěžuje příliš pacienta. Pacient po večeři bez tekutin přes noc nepije, ráno se aplikuje Adiuretin, 2 kapky (10 ug) do každého nosního průduchu. Pacient nesmí mít rýmu, aby vstřebání bylo kvantitativní. Moč se sbírá ve 4 jednohodinových intervalech a v každé porci měříme osmolalitu. Výsledek testu se hodnotí podle následující tabulky. Alespoň v 1 porci moče má být dosažena osmolalita udávaná v tabulce pro příslušnou věkovou kategorii.
Poruchy ve smyslu snížené koncentrační schopnosti ledvin se vyskytují u onemocnění postihujících převážně tubuly a intersticium, kde dochází k narušení protiproudového koncentračního gradientu. Z chorobných procesů je třeba na prvním místě zmínit intersticiální nefritidu, dále poškození tubulů nefrotoxickými léky a těžkými kovy, analgetickou nefropatii (fenacetinová ledvina), diabetes insipidus, jak centrální tak renální, vzácněji některé glomerulopatie.
5.4 Clearance osmolární
Výpočet:
Clearance osmolární informuje obecně o vylučování osmoticky aktivních látek, Její zvýšení svědčí pro osmotickou diurézu. Velikost osmolární clearance je závislá i na příjmu NaCl potravou a na proteinemii. Při sníženém příjmu NaCl a hypoproteinemii bývá snížena. Normální hodnoty osmolární clearance jsou do 0.05 ml/sec.
| Closm = | V x Uosm |
| --------------- | |
| Posm |
Uosm = osmolární koncentrace moči
Posm = osmolární koncentrace plazmy
V = objem moči v ml/sec
5.5 Clearance bezsolutové vody
Výpočet:
ClH2O = V - Closm
V = objem moči v ml/sec
Referenční hodnoty od - 0.030 do - 0.020 ml/sec.
Hodnocení: Clearance bezsolutové vody nás informuje o resorbci osmoticky aktivních látek v distálním tubulu. U normální moči, která je vůči plazmě hypertonická, je negativní. V kritických stavech a při hrozícím renálním selhání se hodnoty clearance H2O a clearance kreatininu mohou měnit již 12 - 24 hodin před vzestupem koncentrace urey a kreatininu. Při závažných poruchách postihujících dřeňový gradient může clearance H2O stoupnout až na hodnoty okolo - 0.004.
6. Biochemická vyšetření zaměřená na poškození tubulů
6.2 Stanovení aktivity N-acetyl-beta-D-glukosaminidázy (NAG)
6.3 Vyšetření při renální tubulární acidóze (RTA)
PŘÍČINY RENÁLNÍ TUBULÁRNÍ ACIDÓZY
V x Uosm
Dává informaci o objemu vody, která neobsahuje osmoticky aktivní látky. Vychází se z konceptu, že moč lze rozdělit na 2 komponenty. První komponenta odpovídá objemu moči potřebnému k vyloučení osmoticky aktivních látek a to v koncentraci, která odpovídá jejich koncentraci v plazmě, respektive je isoosmolární s plazmou. Tato komponenta odpovídá vlastně osmolární clearanci. Druhá komponenta reprezentuje clearance bezsolutové vody a udává nám teoretický objem vody, který se při tvorbě hypotonické moči přidává (kladná hodnota), nebo při tvorbě hypertonické moči odebírá (negativní hodnota).
6.1 Stanovení b2-mikroglobulinu v krvi a moči
b2-mikroglobulin je protein o relatívní molekulové hmotnosti 11800, který je vázán na povrchu všech buněk s výjimkou erytrocytů a je podjednotkou HLA. Jeho stanovení v krvi se používá při monitorování průběhu některých maligních a zánětlivých onemocnění a při renálním selhání. Referenční rozmezí v séru je 1.0 až 4.2 mg/l. Do moči se vylučuje glomerulární filtrací. V tubulech je zpětně resorbován. Při zhoršené tubulární resorbci stoupá jeho množství vylučované močí. Stanovení b2-mikroglobulinu v moči má proto význam při sledování funkce tubulů. U pacientů s transplantovanou ledvinou je zvýšené vylučování v moči indikátorem počínající rejekce. Fyziologické rozmezí v moči je 80 - 180 ug/l. b2-mikroglobulin je v moči málo stabilní. Rozkládá se při pH moče nižším než 5.5. Proto se moč během sběru musí alkalizovat. Také proteolytické enzymy z rozpadlých leukocytů snižují koncentraci b2-mikroglobulinu v moči. Z těchto důvodů se nověji doporučuje stanovovat raději a1-mikroglobulin, který je v moči výrazně stabilnější.
Enzym je lokalizovaný v lysozomech tubulárních buněk a podílí se na štěpení glykoproteinů. Je vylučován močí. Při náhlém poškození tubulárních buněk se jeho aktivita v moči výrazně zvyšuje. Příčinou poškození tubulárních buněk může být toxické působení některých látek, případně rejekce transplantované ledviny. Zvýšení aktivity NAG v moči se hodnotí jako nespecifický indikátor poškození tubulárních buněk. Z isoenzymů NAG je pro onemocnění ledvin nejspecifičtější isoenzym beta.
Charakteristické pro RTA je inadekvátně snížená sekrece H+, při jinak normální nebo přiměřené glomerulární filtraci. Podle místa vzniku se rozlišuje distální (I) a proximální (II) typ renální tubulární acidózy. Oba typy způsobují hyperchloremickou metabolickou acidózu s normální hodnotou anion gapu (AGap). Distální RTA (I) může být inkompletní a probíhat bez obrazu metabolické acidózy a manifestovat se pouze při zátěži. Patogeneze obou typů RTA se liší. U RTA II (proximální) je příčinou zhoršená zpětná resorbce HCO3- a Na+. U RTA I (distální) sběrné kanálky nejsou schopny secernovat dosti H+, které tvoří NH4+ a denní výdej H+ je nižší, než jejich produkce. Příčiny defektu mohou být různé: defekt sekrece H+, nedostatečná kapacita transportního mechanismu pro H+, porucha tvorby negativního luminálního potenciálu atd.
K diagnostikování jednotlivých typů RTA se provádí:
a) Acidifikační test. Perorálně se podá NH4Cl nebo CaCl2 v určené dávce. Moč se sbírá 24 hodin. Sleduje se pH moči, titrovatelná acidita moči.
b) Zátěž anorganickými fosfáty. Infúze Na2HPO4 (koncentrace 0.2 mol/l) v dávce 1.0 - 1.5 ml/min. po dobu 120 - 180 min. Za 3 hodiny se měří U -pCO2 a U - pH
c) Hydrogenkarbonátový test. Podá se NaHCO3 (0.5 - 2.0 mmol/kg hmotnosti) perorálně. Moč se vyšetřuje v hodinových intervalech a sleduje se U - pH,U - pCO2 a hodnoty ABR v krvi.
d) Natriumsulfátový test. Podává se 4 % roztok Na2SO4 v 500 ml infúzi. Před tím se večer podá 1 tableta 1 mg Dexamethasonu (zvýšení zpětné resorbce Na). Po infúzi se sbírá moč a měří se pH. Hodnocení testů viz tabulka.
| hypoaldosteron. | ||||
norm. konc. HCO3- v krvi | ||||
7. Nefrolitiáza
Klinicko-biochemická vyšetření se uplatňují zejména při zjišťování etiologie, vyhledávání rizikových faktorů, při analýze močových konkrementů a při sledování výsledků medikamentózní a dietní terapie. Při vzniku urolitiázy se uplatňují
genetické faktory, zejména u nefrolitiázy mladých jedinců, dále dlouhodobě nedostatečný přívod tekutin, složení stravy, charakter zaměstnání a sociální úroveň
a konečně i některá onemocnění ledvin a cest močových (infekce, městnání moči, malformace, hyperparatyreóza, nádorová onemocnění).
7.1.1 Příčiny vzniku kalciové nefrolitiázy
Příčinou bývá zvýšená saturace moči vápníkem, oxaláty a fosfáty. Poruchy metabolismu Ca vedoucí ke zvýšení jeho koncentrace v plazmě a k jeho zvýšenému vylučování močí jsou hyperparatyreóza, hyperfunkce nadledvinkové kůry, případně prolongovaná terapie kortikoidy, hypertyreóza, sarkoidóza, kostní postižení s převahou resorbce - metastázy maligních nádorů do kosti, poruchy metabolizmu vitaminu D. Podobný efekt má nadměrný příjem exogenního Ca, RTA distálního typu a další syndromy postihující tubulární funkce. Hyperoxalurie může být primární (idiopatická, hereditární) nebo sekundární při zvýšeném příjmu prekurzorů kyseliny šťavelové do organizmu, po velkých resekcích ilea, při otravách etylenglykolem nebo při použití anestetika metoxyfluoranu. Deficit fosforu způsobený endogenními i exogenními faktory zvyšuje riziko vzniku nefrolitiázy sníženým vylučováním pyrofosfátu do moči, který inhibuje krystalizaci, nebo vznikem poruch a degenerativních změn v buňkách ledvin s jejich následnou kalcifikací. Při deficitu magnezia vzniká nefrokalcinóza a nefrolitiáza v důsledku funkčních a degenerativních změn v buňkách ledvin. Zvyšuje se koncentrace Ca a fosfátů v moči.
7.1.2 Příčiny vzniku infekčních konkrementů
7.1.3 Příčiny vzniku urátové litiázy
7.1.4 Příčiny cystinové litiázy
7.1.5 Sekundární prevence
Vyšetřují se dále uvedené parametry v krvi, v séru a v moči.
Pacienti sledovaní ve specializovaných poradnách jsou kromě ambulantních kontrol zváni k diagnostickým hospitalizacím, kde jsou podrobněji vyšetřováni metabolicky. Podrobný popis je uveden v dále citované doporučené literatuře.
7.2 Složení močových konkrementů
7.1 Vznik a výskyt nefrolitiázy
Onemocnění postihuje relativně početnou skupinu populace. V ČR se incidence nefrolitiázy odhaduje asi na 1 % populace, ale celosvětově se odhady v závislosti na geografické oblasti výrazně liší, např. ve Švédsku až 10 %. I přes výrazný pokrok v terapii nefrolitiázy představuje toto onemocnění závažný problém.
Konkrementy:
kalciumoxalátové - whewellit, wedellit
kalciumfosfátové - apatit, whitelockit, brushit
karbonátapatit - (infekční) dahllit
Konkrementy struvitové, karbonátapatitové a močan amonný, vznikají nejčastěji při infekcích v močových cestách vyvolaných bakteriemi, které štěpí močovinu. Zvýšené pH moči a saturace moče amoniakem podporují vznik konkrementů.
Konkrementy z kyseliny močové, uricit a urátové konkrementy vznikají poměrně často, jejich vznik je podmíněn trvale kyselým pH 4.8 - 5.5 (kyselina močová vypadává z roztoku) a zvýšeným vylučováním kyseliny močové při její endogenní nadprodukci (dna, terapie cytostatiky). Méně častou příčinou je nadměrný přívod purinových látek potravou (viz kapitola 8).
Příčinou je nadměrné vylučování cystinu do moči při cystinurii, způsobené nedostatečnou zpětnou resorbcí cystinu v tubulech. Špatně rozpustný cystin krystalizuje zejména v kyselé moči.
Po odstranění konkrementu, ať litotrypsí nebo jiným postupem, je nutné pacienta dále sledovat. Sleduje se vliv dietního režimu a podávaných léků na koncentrace litogenních faktorů a inhibitorů krystalizace v krvi a jejich vylučování močí.
Sérum: Ca, Mg, P anorg, kyselina močová
Krev : ABR
Moč : pH, kultivační vyšetření moči, kvantitativní bakteriurie, chemické vyšetření moči + sediment močový, dU-Ca, dU-Mg, dU-kys. močová, dU-kreatinin, dU-oxaláty, dU-citrát.
Močové konkrementy se skládají z organické matrix (močové mukoproteiny) a z krystalické části. Rozeznávají se jednosložkové a vícesložkové konkrementy. Podle zastoupení je nejvíce dvousložkových (48.6 %) a jednosložkových (35.8 %), méně pak třísložkových a vícesložkových. Vzhledem ke krystalické struktuře konkrementů se běžně používá mineralogická nomenklatura.
hexahydrát (tripelfosfát) | ||
7.3 Analýza močových konkrementů a vyšetření litogenních faktorů
Vzhledem ke složení a struktuře většiny konkrementů se uplatňují některé fyzikální metody používané běžně v mineralogii.
Při analýze složených konkrementů je vhodné sledovat i jednotlivé vrstvy konkrementu, které se mohou skládat z různých komponent.
Přehled vyšetření vyvolávajících (litogenních) a inhibujících faktorů
8. Doporučená literatura:
1. Úvod
Chemická analýza podává informace o zastoupení hlavních kationtů a aniontů
Polarizační mikroskopie - analýza tenkého výbrusu nebo drtě
Infračervená spektroskopie
Rentgenová difrakce - k analýze stačí velmi malé množství konkrementu.
Vyšetření pH moči
Vyšetření koncentrace Ca v krvi a v moči a denní vylučování Ca močí
Vyšetření koncentrace oxalátů v moči a jejich denní vylučování
Vyšetření koncentrace močové kyseliny v krvi a v moči a její denní vylučování močí
Vyšetření koncentrace fosfátů a jejich denní vylučování močí
Vyšetření koncentrace a denního vylučování cystinu močí
Stanovení inhibitorů krystalizace
Stanovení koncentrace Mg v moči a denní vylučování
Stanovení citráturie
J. MASOPUST: Požadování a hodnocení biochemických vyšetření I a II. Zdravotnické aktuality 216. MZ ČR a Avicenum, zdrav. nakladatelství Praha 1990.
B. NEJEDLÝ, J. TOBIŠKA, L. ZAHRADNÍČEK: Základní a morfologické vyšetření moči. Účelová publikace MZ ČSR, 1986
J. P. COLOMBO (Ed.): Klinisch-chemische Urindiagnostik. Labolife-Verlagogemeinschaft, Rotkreuz, Schweiz 1994
M. ENGLIŠ: Proteinurie. Stapro s.r.o. Pardubice 1995
J. HYÁNEK: Klinické a biochemické aspekty vrozených metabolických poruch. Avicenum, zdrav. nakladatelství Praha 1980.
Biochemické vyšetřovací metody v hepatologii
Autor kapitoly: MUDr.Mgr.Milan Jirsa, Ústav klinické biochemie VFN a 1.LF UK Praha
Většina jaterních onemocnění bývá provázena poruchami jaterních funkcí nebo narušením integrity jaterních buněk. Tyto poruchy lze zjišťovat pomocí biochemických vyšetřovacích metod. Přestože byla navržena řada nejrůznějších biochemických vyšetření, klinická potřeba spolu s požadavky na rychlost, metodickou nenáročnost a cenovou dostupnost vedly k vytřídění základního souboru vyšetření, která jsou neodmyslitelnou součástí vyšetřovacího programu každého oddělení klinické biochemie (OKB) (Tab. 1). Rozdělení biochemických testů podle typu poruchy, kterou tyto testy postihují, ukazuje tabulka 2. Mezi biochemické vyšetřovací metody
jater je dále třeba zahrnout speciální vyšetření sloužící k vyšetřování metabolických nemocí jater, zátěžové a chromoexkreční testy a v širším kontextu i imunologická vyšetření, sérologická vyšetření a v poslední době i detekci virových nukleových kyselin technikou
polymerázové řetězové reakce. V následujícím textu jsou shrnuty podklady pro správnou indikaci a interpretaci výsledků jednotlivých
vyšetření uvedených v tabulce 2 podle schématu: patobiochemické poznámky-princip stanovení a omezení z něho vyplývající-referenční rozmezí-interpretace.
|
Tab. 5.2 Dělení biochemických vyšetření jater
|
|
A. Testy konjugace a jaterního transportu organických aniontů
S-celkový a přímý bilirubin U-bilirubin U-urobilinogen S-žlučové kyseliny |
|
B. Ukazatelé poškození hepatocytů
S-aspartátaminotransferáza (AST) S-alaninaminotransferáza (ALT) S-glutathion-S-transferáza (GST) S-laktátdehydrogenáza (LD) a její LD5 IZOENZYM |
|
C. Ukazatelé obstrukce žlučových cest
S-alkalická fosfatáza (ALP) a její jaterní izoenzym S-gammaglutamyltransferáza (GMT) S-5'-nukleotidáza (NTS) S-leucinaminopeptidáza (LAS) S-lipoprotein X (Lp-X) |
|
D. Ukazatelé syntetické funkce jater
S-albumin S-prealbumin S-cholinesteráza (CHE) S-lecithin-cholesterolacyltransferáza (LCAT) protrombinový čas (PT, Quickův test) parciální protrombinový čas (PTT) |
|
E. Ukazatelé zvýšené tvorby kolagenu
S-aminoterminální propeptid kolagenu III |
2. Jaterní konjugace a transport
Celkový bilirubin se ve většině laboratoří stanovuje diazoreakcí v přítomnosti metanolu, kofeinu nebo jiného akcelerátoru. Přímou reakci bez přidání akcelerátoru dává pouze bilirubin přímý. Stanovení přímého bilirubinu diazoreakcí vede k nadhodnocení nízkých a naopak k podhodnocení vysokých hodnot přímého bilirubinu. Spolehlivého stanovení přímého a nepřímého bilirubinu je možno dosáhnout chromatograficky, tato náročná metoda je však omezena na několik specializovaných laboratoří a v praxi se neuplatnila.
Normální hodnota celkového bilirubinu v séru je do 17 µmol/l přímého do 1 µmol/l. Možné příčiny hyperbilirubinémie jsou shrnuty v tabulce 3. Nekonjugovaná hyperbilirubinémie s hodnotami mezi 17-70 µmol/l spolu s normálním nálezem ostatních vyšetření je charakteristická pro chronickou hemolýzu a pro benigní hyperbilirubinémii Gilbertova typu. Stejné hodnoty bilirubinu spolu se zvýšenými hodnotami přímého bilirubinu a ostatních jaterních testů svědčí pro poškození hepatocytů. Při obstrukci žlučových cest (nekompletní i kompletní) se hodnoty bilirubinu pohybují mezi 170-500 µmol/l. S extrémními hodnotami kolem 1000 µmol/l je možno se setkat u fulminantně probíhajících onemocnění jater, často v kombinaci s renálním selháním, při masívní hemolýze u některých anémií (srpkovitá anémie, deficit G-6-PD) a při posttransfúzní hemolýze. Pozvolný vzestup bilirubinémie u nemocných s chronickým onemocněním jater je považován za nepříznivé prognostické znamení.
2.2. U-bilirubin
2.3. U-urobilinogen (UBG)
2.1. S-bilirubin
Pojem sérový bilirubin zahrnuje složitou směs chemických sloučenin. Z praktických důvodů rozlišujeme jednak bilirubin nepřímý, jehož hlavní komponentu tvoří ve vodě nerozpustný, na albumin vázaný, nekonjugovaný bilirubin IX a, jednak ve vodě rozpustný bilirubin přímý. Ten sestává ze dvou hlavních komponent. První z nich tvoří diester bilirubinu s kyselinou glukuronovou, v menší míře jsou zastoupeny monoestery a dále estery s glukózou a s xylózou. Druhou komponentu, tzv. D-bilirubin, představuje kovalentně (peptidovou vazbou) vázaný bilirubin na albumin a v menší míře na jiné plazmatické proteiny. D-bilirubin vzniká neenzymovou reakcí esterů bilirubinu s bílkovinami. D-bilirubin bývá hlavní složkou přímého bilirubinu u nemocných s ustupující žloutenkou postmikrosomálního typu. Tím se vysvětluje nepřítomnost bilirubinu v moči u těchto nemocných.
Močí se vylučují pouze estery bilirubinu. Přítomnost bilirubinu v moči se projeví jejím tmavě hnědým zbarvením. Bilirubin v moči se vyšetřuje semikvantitativně testačním proužkem na principu přímé diazoreakce. Mez detekce činí 1-2 µmol/l. Normálně je nález vyšetření negativní. Bilirubin je v moči prokazatelný ještě před rozvojem klinicky manifestního ikteru postmikrosomálního typu. V jeho odeznívající fázi, např. u akutní virové hepatitidy, naopak nemusí být v moči prokazatelný, neboť v séru převládá D-bilirubin. Opakovaná nepřítomnost bilirubinu v moči u ikterického nemocného svědčí pro premikrosomální ikterus.
Pojmem urobilinogen se v klinické biochemii rozumí směs produktů bakteriálního metabolismu bilirubinu. UBG vzniká v ileu a v tlustém střevě, je zčásti vylučován stolicí, zčásti prodělává enterohepatální cyklus a malá část se vylučuje močí. Vylučování UBG v moči se provádí semikvantitativně testačním proužkem na
principu Ehrlichovy aldehydové reakce. Reakce není příliš specifická. Normálně je nález negativní.
| Tab.5.3 Rozdělení hyperbilirubinémií podle příčin |
I. Převážně nekonjugovaná hyperbilirubinémie
(premikrosomální typ)
2. inefektivní erytropoéza
2. žloutenka nedonošených 3. žloutenka Gilbertova typu 4. Crieglerův-Najjarův syndrom 5. získané poruchy - inhibice léky |
II. Převážně konjugovaná hyperbilirubinémie
(postmikrosomální typ)
2. intrahepatální cholestáza - léky, těhotenství, idiopatická benigní cholestáza 3. benigní pooperační žloutenka 4. kongenitální konjugované hyperbilirubinémie - syndromy Dubin- Johnsonův a Rotorův
2. extrahepatální obstrukce - kámen, nádor, striktura |
Zvýšené vylučování urobilinogenu může provázet nekonjugovanou žloutenku z nadprodukce bilirubinu (zvýšení nabídky) a choroby s primárním poškozením hepatocytů (porucha vychytávání). Vylučování UBG je naopak sníženo při kompletní obstrukci žlučových cest. Jelikož vylučování UBG může být snadno ovlivněno stavem střevní flóry nebo zpomalením střevní pasáže, je význam vyšetření UBG v moči nevelký.
2.4. S-žlučové kyseliny
3. Poškození hepatocytu
Stanovení aktivity S-ALT a celkové aktivity S-AST se provádí kineticky při 37 °C. Princip kontinuálního (kinetického) stanovení ALT spřaženou reakcí s laktátdehydrogenázou (LD) ukazuje následující schéma:
Při různých onemocněních jater byla pozorována řada změn v metabolismu žlučových kyselin (ŽK). Obstrukce žlučových cest je provázena zvýšením koncentrace primárních ŽK (cholové a chenodeoxycholové) a snížením koncentrace sekundárních ŽK (deoxycholové, litocholové). Při poškození jaterního parenchymu se v krvi vedle změn koncentrací normálních ŽK objevuje řada abnormálních ŽK. Žádná z těchto změn však není specifická pro určitou chorobu. Výjimku tvoří několik vzácných dědičných poruch metabolismu ŽK, které se projevují v raném dětském věku. Společným projevem většiny jaterních chorob je snížené vychytávání ŽK z portální krve, jehož důsledkem je zvýšení sérové hladiny ŽK, resp. její zpomalený postprandiální pokles. Celkové S-ŽK se obvykle vyšetřují enzymově pomocí 3 a-hydroxysteroiddehydrogenázy. Normální hodnota do 10 umol/l. Vyšetření je sice možno považovat za indikátor hepatocelulárního poškození, avšak hladina S-ŽK může být ovlivněna řadou zásahů do enterohepatálního cyklu, např. zrychlenou pasáží, střevním onemocněním s poruchou resorpce aj. Vyšetření se proto běžně neužívá.
 3.1. S-aspartátaminotransferáza (AST) a S-alaninaminotransferáza (ALT)
3.1. S-aspartátaminotransferáza (AST) a S-alaninaminotransferáza (ALT)
AST (dříve GOT) se vyskytuje v řadě orgánů: kromě jater též v myokardu, kosterním svalstvu, ledvinách, pankreatu a v erytrocytech. Zatímco její orgánový původ nelze zjišťovat, je možno rozlišit mitochondriální a cytoplazmatický isoenzym. ALT (dříve GPT) se vyskytuje v cytosolu hepatocytů a její obsah v jiných orgánech je nízký. ALT a cytoplazmatický isoenzym AST se dostávají do krve již při narušení permeability hepatocytární membrány, zatímco uvolnění mitochondriální AST provází hepatocelulární nekrózu.
| L-alanin + 2-oxoglutarát | ALT | glutamát + pyruvát |
| <---------> | ||
| pyruvát + NADH + H + | LD | laktát + NAD+ |
| <---------> | ||
Rychlost přeměny NADH na NAD+ se monitoruje fotometricky při 340 nm jako pokles absorbance NADH. Při stanovení S-AST se místo redukce pyruvátu laktátdehydrogenázou používá redukce oxalacetátu malátdehydrogenázou. K reakční směsi se přidává koenzym transamináz pyridoxalfosfát, který má aktivující účinek. Referenční hodnoty katalytické koncentrace aminotransferáz jsou při tomto způsobu stanovení jsou pro S-AST do 0,87 µkat/l a pro S-ALT do 0,96 µkat/l.
Více než dvacetinásobné zvýšení aktivity sérových aminotransferáz je charakteristické pro akutní virovou hepatitidu, akutní toxické poškození jater a stavy spojené s jaterní hypoperfúzí resp. hypoxií (šok, akutní pravostranné srdeční selhání). Hodnoty transamináz obvykle klesají v průběhu 2. týdne onemocnění a normálních hodnot bývá dosaženo mezi 6. a 8. týdnem, někdy až do 6 měsíců od začátku onemocnění. Mnohem vzácněji přichází v úvahu obstrukce žlučových cest provázená cholangitidou nebo chronická aktivní hepatitida. Několikanásobné zvýšení transamináz provází řadu jaterních chorob. Mírné (ne více než dvojnásobné) zvýšení hodnot ALT a AST lze někdy zastihnout po alkoholickém excesu a u obézních osob. U nemocných s kompenzovanou jaterní cirhózou nebo s krátce trvající či neúplnou obstrukcí žlučových cest mohou být hodnoty sérových transamináz v normě. Poměr AST/ALT, označovaný někdy jako de Ritisův index, přesahuje hodnotu 2 u nemocných s alkoholickou hepatitidou (obr. 5.1) a s cirhózou, kritérium je však málo spolehlivé.
3.3. S-laktátdehydrogenáza (LD) a její LD5 isoenzym
Jaterní onemocnění se s výjimkou časného stádia akutní virové hepatitidy a stavů spojených s jaterní hypoperfúzí resp. hypoxií neprojevují výrazným zvýšením S-LD. Zvýšení S-LD5 provází onemocnění jater, kosterního svalstva a některá nádorová onemocnění. Infekční mononukleóza se může projevit zvýšenou hodnotou isoenzymu S-LD3.
4. Obstrukce žlučových cest
Ke stanovení S-ALP se jako substrát používá 4-nitro-fenylfosfát. Referenční rozmezí katalytické koncentrace S-ALP u dospělých je 0,66 - 2,2 µkat/l, v dětském věku 1,1 - 7,5 µkat/l.
Podstatná část jaterní ALP se nachází v buněčných membránách výstelky žlučových cest. Při cholestáze dochází k narušení membrán jednak mechanickými vlivy, jednak detergenčním účinkem žlučových kyselin. Uvolněná ALP se pak dostává do krve. Vedle uvedeného mechanismu existují ještě další, např. zvýšení jaterní syntézy ALP. Vysoká hodnota S-ALP s převahou jaterního izoenzymu je charakteristická pro cholestázu a obstrukční ikterus. Vzácněji může provázet infekční mononukleózu. Mírné zvýšení S-ALP může být průvodní známkou řady jaterních onemocnění bez výraznější cholestatické složky. U některých nemocných s jaterní cirhózou převažuje střevní izoenzym, což se vysvětluje jeho sníženým vychytáváním v játrech. Hodnoty S-ALP je třeba vždy posuzovat v kontextu s ostatními ukazateli obstrukce, zejména s S-GMT.
4.2. S-gammaglutamyltransferáza (GMT)
Jako substrát pro stanovení S-GMT slouží gammaglutamyl-4-nitroanilid. Množství enzymem odštěpeného 4-nitroanilinu se monitoruje fotometricky. Referenční rozmezí katalytických koncentrací S-GMT u dospělých je do 0,89 µkat/l.
S-GMT je citlivým, avšak nepříliš specifickým markerem jaterního onemocnění. Více než 10tinásobné zvýšení obvykle provází cholestázu, obstrukční ikterus a primární i metastatické nádory jater. U ostatních onemocnění jater bez cholestázy bývá S-GMT zvýšena méně. Izolované zvýšení S-GMT lze pozorovat u alkoholiků bez známek jaterního poškození, což se vysvětluje enzymovou indukcí mikrosomální GMT. Po několikatýdenní abstinenci se hodnota normalizuje. Podobně je tomu při podávání některých léků (fenobarbital, paracetamol aj.). Zvýšení S-GMT může též provázet akutní pankreatitidu.
4.3. S-5'-nukleotidáza (NTS), S-leucinaminopeptidáza (LAP), S-lipoprotein X (Lp-X)
5. Syntetické funkce
Albumin se stanovuje fotometricky reakcí s bromkresolovou zelení nebo violetí. Normální sérová koncentrace činí 30 - 50 g/l. Hypalbuminémie může mít řadu příčin. Primární snížení jaterní syntézy provází řadu jaterních chorob. K dalšímu prohloubení hypalbuminémie může vést sekvestrace albuminu v extravaskulárním prostoru např. při ascitu nebo zvýšený katabolismus při horečce nebo traumatu. Mezi další příčiny hypalbuminémie patří snížený přívod bílkovin, malabsorpce a zvýšené ztráty při onemocněních ledvin, popáleninách, při exsudativní gastroenteropatii (tzv. protein-losing enteropathy), aj.
5.2. S-prealbumin
5.3. S-cholinesteráza (CHE)
5.4. S-lecithin-cholesterolacyltransferáza (LCAT)
5.5. Protrombinový čas (PT, Quickův test) a parciální protrombinový čas (PTT)
5.6. S-aminoterminální propeptid kolagenu III
6. Vyšetření dalších analytů
6.2. P-amoniak
Hyperamonémie provází řadu jaterních chorob. Hodnot kolem 60 - 80 µmol/l se dosahuje u nemocných s vyvinutým kolaterálním oběhem, avšak korelace se stupněm encefalopatie není vysoká. Klinický význam nemá jednotlivá absolutní hodnota amonémie, nýbrž sledování hodnot v průběhu léčby. 20 až 30násobné zvýšení amoniaku je charakteristické pro některé enzymopathie ureasyntetického cyklu. Větší váhu má opakované vyšetření provedené v denních, popř. několikadenních intervalech.
6.3. S-cholesterol
7. Zátěžové a chromoexkreční testy
8. Vyšetření metabolických nemocí jater a některá další speciální vyšetření
Vyšetření sérové hladiny mědi a ceruloplazminu má v hepatologii význam pro stanovení diagnózy Wilsonovy nemoci. Zatímco referenční hodnota S-ceruloplazminu je 300 - 500 mg/l, většina nemocných s Wilsonovou chorobou má hladinu podstatně nižší, často téměř nulovou. Snížení sérové hladiny vázané mědi (rozumí se na ceruloplazmin) bývá zčásti kompenzováno vzestupem volné, tj. na albumin vázané mědi, takže hodnoty celkové Cu mohou být jak snížené, tak normální (referenční rozmezí u dospělých je 14 - 25 µmol/l). Pro diagnózu m. Wilson je rozhodující vyšetření obsahu mědi v bioptickém vzorku jaterní tkáně. Zatímco normální obsah Cu v játrech je 20 - 50 µg/g sušiny, u nemocných s Wilsonovou chorobou se pohybuje od 250 do 3000 µg/l sušiny. Hodnoty 50 - 250 µg/g sušiny jsou necharakteristické a mohou provázet řadu onemocnění jater. Nejvyšší hodnoty, které však obvykle nepřesahují 300 µg/g sušiny, bývají u primární biliární cirhózy.
Vyšetření sérového železa, celkové vazebné kapacity pro železo (CVK, TIBC z angl. Total Iron Binding Capacity) resp. saturace transferinu (UIBC z angl. Unbound Iron Binding Capacity, vypočtené jako S-Fe/CVKx100) a sérového ferritinu má význam pro diagnózu hemochromatózy. Jak u nemocných s hereditární hemochromatózou, tak u nemocných se získanou hemochromatózou z nadměrného parenterálního přívodu železa přesahuje hladina S-Fe 30 µmol/l (referenční rozmezí pro muže 10 -28 µmol/l, pro ženy 7 - 26 µmol/l), saturace transferinu přesahuje 60 % (referenční rozmezí 15 - 50 %) a mnohonásobně zvýšená hladina sérového transferinu (referenční rozmezí pro muže 20 - 399 µg/l, pro ženy poloviční hodnoty) odráží zvýšený obsah železa v organismu.
Vyšetření metabolismu porfyrinů zahrnuje několik základních vyšetření a některá vyšetření specializovaná. Mezi základní vyšetření patří:
Ke speciálním vyšetřením se řadí:
V klinické praxi přichází v úvahu setkání s některou s následujících porfyrií v pořadí podle četnosti výskytu:
Porfyrii může imitovat otrava olovem. Ostatní poruchy porfyrinového metabolismu jsou z praktického hlediska málo významné. Klinická i biochemická diagnostika poruch porfyrinového metabolismu si klade tyto cíle:
9. Doporučená literatura:
1. Specifika biochemické diagnostiky v gastroenterologii
Základní funkcí trávicího ústrojí je příjem a zpracování potravy procesem trávení (digesce) a vstřebávání (absorpce) jednotlivých složek potravy. Trávicí proces je možno rozdělit do tří fází.
Orální fáze začíná v dutině ústní kde již probíhá první fáze štěpení škrobů slinnou a-amylázou.
Gastrická fáze probíhá v žaludku a zahrnuje sekreci žaludeční šťávy, HCl, žaludečních proteináz (pepsiny) a štěpení bílkovin.
Enterální fáze začíná v duodenu alkalizací kyselého žaludečního obsahu hydrogen karbonátem pankreatické šťávy, sekrecí pankreatických enzymů, které vedou k hydrolýze peptidů (trypsin, chymotrypsin, elastáza, karboxypeptidázy), škrobů (a -amyláza) i tuků (lipáza). K další hydrolýze a vstřebávání dochází pomocí enzymů kartáčového lemu enterocytu (disacharidázy, dipeptidázy, aminopeptidázy...).
2. Kategorizace metodik a testů
2.1 Anatomická kategorizace
2.1.2 Pankreas
2.1.3 Tenké střevo
2.1.4 Tlusté střevo
2.2 Klinicko-diagnostická kategorizace
2.3 Laboratorně-metodická kategorizace
3. Rutinní stanovení v séru a moči
Stanovovat lze jednak koncentraci imunologickými technikami (tj. stanovení koncentrace proteinu) nebo enzymovou, katalytickou koncentraci pomocí specifických substrátů. Při stanovení jak hmotnostní, tak katalytické koncentrace enzymu je nutno zvažovat přítomnost inhibitorů v séru a vznik makroforem enzymů. Běžně používané stanovení aktivity a-amylázy je založeno na štěpení chromogenního substrátu. Starší postupy, které používaly deriváty přirozeného substrátu-škrobu, byly obtížně standardizovatelné a již se nepoužívají. Současné syntetické substráty jsou odvozeny od maltózy, jako chromogen je nejčastěji používán 4-nitrofenylfosfát. Stanovení isoenzymů a-amylázy je umožněno inhibicí jednoho z obou isoenzymů specifickou monoklonální protilátkou.
Makroamyláza je příčinou asi 8-12% případů hyperamylazémie. Pro detekci makroamylázy je nutno použít gelové filtrace nebo jiné separační techniky k oddělení vysokomolekulární a nízkomolekulární formy enzymu, např.elektroforézy. K diagnostice lze použít indexu amylázy a kreatininu.
Klinický význam. Zvýšená hladina celkové aktivity a-amylázy je prokazatelná u celé řady onemocnění. Nejčastějším diagnostickým důvodem je dg. akutní pankreatitidy. Hladina celkové a-amylázy je sice zvýšena ve 100% onemocnění akutní pankreatitidou, zvýšena je však i v 80% všech případů akutních bolestí břicha. Podstatně větší diagnostický přínos má stanovení pankreatického izoenzymu (P-amylázy), jehož hladina je rovněž zvýšena ve 100% případů akutní pankreatitidy, u akutních bolestí břicha je zvýšena jen v 10%. V běžné klinické praxi se používá kriteria 5-násobného zvýšení celkové amylázy, které je dg.indikátorem akutní pankreatitidy. Zvýšená sérová hladina je samozřejmě prokazatelná u akutních i chronických onemocnění ledvin, u střevních zánětů ve 30% případů akutní apendicitidy. Zvýšení hladiny a-amylázy v moči u akutní pankreatitidy přetrvává déle a nastupuje později, než zvýšení hladiny v séru. Slinný typ a-amylázy (S-amyláza) je zvýšen u onemocnění slinných žlaz, u některých plicních chorob, u řady maligních tumorů, ovariální cysty, mimoděložního těhotenství. Normální hodnoty poměru clearance amylázy a kreatininu jsou mezi 2-4%, při pankreatitidě stoupá index na 10%. Zvýšený index clearance amylázy-kreatininu byl prokázán např. u diabetické ketoacidózy, popáleninách, myelomu a u ledvinných poruch. Snížení indexu clearance je diagnosticky významné pro makroamylázemii.
3.1.2 Lipáza
Stanovení aktivity lipázy zahrnuje různé postupy - enzymové štěpení přirozeného substrátu, chromogenních a fluorogenních substrátů a metody imunologické (ELISA, latex-aglutinační). Nejčastěji se používá nefelometrických a turbidimetrických postupů postupů založených na štěpení přirozeného substrátu triacylglycerolu, většina souprav pro enzymové stanovení lipázy obsahuje i ko-lipázu. Turbidimetrické stanovení aktivity lipázy je založeno na vyčeření olejové emulse působením lipolytické aktivity. Tento proces však může být ovlivněn i dalšími složkami séra např. tzv. vyčeřovacím faktorem - pseudolipázou. Nejčastěji se jedná o cirkulující imunokomplexy typu IgM. Pro diferenciální stanovení sérové pankreatické lipázy vedle pseudolipázy s použitím standardního turbidimetrického postupu je vypracován postup založený na inaktivaci pseudoplipázy ß merkaptoetanolem, který vede k disociaci IgM komplexů. Novější chromogenní testy jsou založeny na enzymové kaskádě lipázy štěpící 1,2-diacylglycerol, glycerol-kináze, glycerol-3-fosfátoxidáze a peroxidáze s chromogenním produktem. Zcela nový typ techniky stanovení pankreatické lipázy je založen na změně vodivosti roztoku uvolněním mastných kyselin ze substrátu-trioleinu; detekována je akustickým snímačem a měřenou veličinou je frekvenční odpověď.
Makrolipáza (makroforma enzymu) byla prokázána u 2 ze 20 pankreatitid se zvýšenou hodnotou lipázy a tvořila 10-18% celkové aktivity. Poprvé byla popsána v roce 1987 u non-Hodgkin lymfomu, kdy katalytická aktivita lipázy byla zvýšena v séru 7x.
Klinický význam. Stanovení lipázy je diagnosticky využíváno podstatně méně než stanovení a-amylázy. Důvodem jsou především technické problémy, které stanovení lipázy donedávna přinášelo. Z těchto důvodů vznikla celá řada velmi odlišných metodik k stanovení lipázy, jejichž výsledky lze velmi obtížně vzájemně porovnávat a standardizovat např. referenční meze. Diagnostický přínos stanovení sérové hladiny pankreatické lipázy je však podstatně vyšší než stanovení a -amylázy. Hladina lipázy v séru zůstává po atace akutní pankreatitidy zvýšena podstatně déle než hladina amylázy (popsána je zvýšená aktivita lipázy po 14 dnech). Vzhledem k tomu, že lipáza v séru má svůj původ především v buňkách pankreatu, poskytuje její stanovení podstatně vyšší specificitu, srovatelnou se specificitou pankreatického isoenzymu a-amylázy. V moči je lipáza běžnými posupy nedetegovatelná a nestanovuje se, makroforma existuje u lipázy také, diagnosticky se však opět toto stanovení nepoužívá. Vzhledem k vysoké specificitě je pro praxi, především v oblasti akutní medicíny, navržen imunologický průkaz lipázy jednoduchým latexovým testem.
3.1.3 Další pankreatické enzymy
Elastáza-1
3.2 Tumorové markery
Karcinoembryonální antigen (CEA), a1-fetoprotein (AFP), kyselý a1-glykoprotein, pankreatickou elastázu-1, sacharidové antigeny CA 19-9, CA 50, CA 72-4 a CA 242. Z hlediska orgánové lokalizace má pro karcinom žaludku nejvyšší pozitivitu CA 72-4, pro kolorektální karcinom CEA a CA 242, a pro karcinom pankreatu CA 19-9 a CA 242. Stanovení více tumorových markerů paralelně zvyšuje specificitu vyšetření, snižuje však jeho senzitivitu.
3.3 Jiné testy
Hladinu gastrinu v séru stanovujeme většinou RIA metodou, existují i ELISA varianty imunochemického průkazu. Normální hodnoty 66±2 ng/l jsou výrazně zvýšeny především u Zollinger-Ellisonova syndromu (gastrinom, tumor pankreatu s nadprodukcí gastrinu), kdy prokazujeme 10-1000 násobné zvýšení hladiny gastrinu, která však výrazně kolísá i v průběhu dne; u 20-40% lze zachytit i normální hladinu gastrinu. Vzhledem k existenci tří forem gastrinu závisí výsledek stanovení na typu protilátky použité v testu. Metody stanovení gastrinu jsou standardizovány na syntetický gastrin G-17, stanovení forem G-34 a G-13 závisí na zkřížené reaktivitě s příslušnou protilátkou. Normální poměr forem G-13:G-17:G-34 je 8:2:1, na lačno je vyšší zastoupení formy G-34, po jídle forem G-17 a G-13.
3.3.2 Pepsin, pepsinogen
4. Funkční testy
4.1 Vyšetření funkce žaludku
Provedení testu. Pacient přichází na lačno a je mu zavedena žaludeční sonda, jejíž pozici je nutno ověřit skiaskopií. Pomocí odsávačky je odčerpáván žaludeční obsah a jednotlivé porce jsou sbírány po 15 minutách, celkem 2 hodiny. Nejprve je odebrána veškerá žaludeční šťáva na lačno - porce T0 a pak následuje sběr nestimulované, basální sekrece T60 4 x 15 minut. Po 1 hodině testu je provedena stimulace 6 µg pentagastrinu/kg váhy subkutánně (histamin podáváme jako 1% roztok v dávce 0.1 ml/10kg váhy, insulin podáváme i.v. 10-20 IU NI). Následuje odběr dalších 4 porcí po 15 minutách - stimulovaná sekrece T120.
Analýza žaludečního obsahu a stanovení koncentrace HCl. Ve všech porcích změříme pH, objem porce a titračně stanovíme koncentraci HCl. Titrujeme 10 ml (minimálně 5 ml) žaludeční šťávy pomocí 0.1 mol/l NaOH v přítomnosti barevného pH-indikátoru (např. diethylaminoazobenzen). V každé frakci stanovujeme koncentraci HCl, vypočítáme celkový výdej HCl a sekreční rychlost mmol HCl/hodinu. Indexy používané v diagnostice jsou označeny BAO (Basal acid output), stanoven z basální frakce T60 před stimulací; PAO (Peak acid output) stanovený průměrem ze dvou frakcí s nejvyšší koncentrací HCl a MAO (Maximum acid output) jako výsledek hodinové stimulované sekrece T120. Při insulinovém testu se stanovuje i koncentrace pepsinu jako BPO (Basal pepsin output) a MPO (Maximal pepsin output).
Referenční hodnoty testu s pentagastrinem: BAO 1-5 mmol HCl/hod, MAO 10-23 mmol HCl/hod, PAO 8-40 mmol HCl/hod. Hodnoty u mužů jsou vyšší než u žen (PAO u mužů je 11-40, u žen 8-33 mmol HCl/hod). Po stimulaci histaminem hodnotíme celkový objem žaludeční štávy, normální hodnoty jsou 150-250 ml/2 hod a celková acidita 72-80 mmol HCl/l. Hodnoty insulinového testu jsou u mužů BPO 32 ± 29 mg/hod, MPO 320±170 mg/hod; u žen BPO 60±81 mg/hod, MPO 170 ± 150 mg/hod.
Klinický význam. Hypochlorhydrie (hypoacidita) až achlorhydrie (anacidita) je signifikantním příznakem perniciózní anemie, podezření na malignity (karcinom žaludku vykazuje však v časných stádiích hyperaciditu i normoaciditu). Dg.významné je stanovení žaludeční acidity při Zollinger-Ellisonově syndromu, kdy prokazujeme vysokou bazální i maximální sekreci (BAO>15, MAO>60), ve více než 50% případů Zollinger-Ellisonova syndromu je index BAO/MAO > 0.60.
4.2 Vyšetření exokrinní funkce pankreatu
4.2.1 Sekretinový přímý funkční test
Provedení testu. Pacient přichází nalačno a je odebrán vzorek séra. Pod RTG kontrolou je zavedena nejprve žaludeční sonda (slouží k odčerpávání žaludečního šťávy a zamezení kontaminace duodenálního obsahu) a poté druhá sonda do duodena. Přítomnost žluče v aspirátu a alkalické pH je rovněž kontrolou správného zavedení. Po odčerpání 1.frakce (lačný vzorek pro stanovení basálních hodnot) je podána i.v. stimulace cholecystokininem (nejčastěji 1 IU/kg váhy i.v.) a je proveden odběr duodenální šťávy - 20 minut. Následuje stimulace sekretinem (nejčastěji se podává 1 IU/kg váhy) a odčerpání dalších 3 frakcí po 20 minutách. Laboratorní zpracování zahrnuje změření objemu, stanovení pH, podle barevné škály zhodnocení tzv. ikterického indexu, stanovení koncentrace HCO3-, a aktivity pankreatických enzymů a-amylázy, lipázy a trypsinu běžnými enzymovými metodami.
Hodnocení a klinický význam. Sekretin-CCK test poskytuje ze všech dostupných testů nejpřesnější informace o sekrečních poměrech pankreatu. Přes nestandardnost jeho uspořádání je považován za "zlatý standard" funkčních testů pankreatu ke zhodnocení především pankreatické insuficience. Normální hodnoty závisí na způsobu stimulace, odběru i analýze duodenálního obsahu. Uvedené hodnoty jsou jednou z variant. Objem sekrece stimulované sekretinem 165-536 ml/hod, koncentrace HCO3- 9.8-39.7 mmol/hod, aktivita trypsinu 9.3-171 j/20 minut, aktivita amylázy 34-204 j/20 minut.
4.2.2 Nepřímé funkční testy
Provedení testu. Pacient přichází nalačno a je odebrán vzorek séra a moče. Následuje podání substrátu (Ac-Tyr-PAB ve 4 tabletách) a stimulační pokrm (modifikace Lundhovy snídaně - hydrolyzát kaseinu s olivovým olejem). Po dobu 6 hodinového sběru moče pacienta saturujeme tekutinami (minimálně 3x250 ml čaje). Po 3 hodinách se odebere další vzorek krve, po 6 hodinách poslední porce moče, změří se celkový objem moče za 6 hodin a pro analýzu se vezme vzorek cca 10ml moče. Laboratorní zpracování zahrnuje změření objemu moče za 6 hodin a stanovení koncentrace HPAB ve vzorcích séra a moče po hydrolýze. HPAB se stanovuje diazotační reakcí podle Bratton-Marshala s fotometrickým měřením.
Klinický význam. Nepřímé funkční testy mají význam jako screeningové testy k průkazu pankreatické insuficience. Normální hodnoty výdeje močí za 6 hodin > 30.7% podaného množství pankreatickou nedostatečnost vylučují. Pomocnou hodnotou je hladina v séru ve 3.hodině testu s hranicí normálních hodnot > 25 µmol/l. Pankreatickou insuficienci lze vyloučit i při sníženém výdeji močí za 6 hodin tj. < 30.7% je-li prokázána normální hladina v séru. PABA test (ALTAB-test) se také s výhodou používá pro stanovení účinnosti pankreatické substituce enzymovými preparáty (např. Pankreolan, Panzynorm, Panpur, Kreon aj.). Při interpretaci výsledků PABA testu je nutno zvažovat komplexně možnosti falešně snížených hodnot v důsledku porušené funkce dalších orgánů, které se na výsledku testu uplatňují. Falešně pozitivní výsledeky jsme prokazovali při podání tablet s nižším obsahem substrátu (např. v důsledku přítomnosti racemátu tj. D,L-formy tyrosinu). Vzhledem k obtížím při interpretaci výsledků PABA-testu a relativně vysokému počtu falešně pozitivních výsledků již byla popsána celá řada modifikací. Jedná se především o stanovení tzv. PABA-indexu, stanovení PABA spolu s dalším markerem např. PAS nebo radioizotopu 14C ze značeného substrátu.
4.2.3 Chymotrypsin a elastáza-1 ve stolici
Stanovení chymotrypsinu (CHT) ve stolici. Pacient odebere vzorek stolice do specielní odběrové nádobky se stabilizujícím reagens a detergentem (pro CHT), který je předán do laboratoře. Laboratorní stanovení chymotrypsinu je založeno na jednoduché reakci s chromogenním substrátem, Suc-Ala-Ala-Pro-Phe-pNA. Chymotrypsin katalyzuje hydrolýzu a uvolnění barevného 4-nitroanilinu, který je stanoven fotometricky při 405 nm. Referenční hodnoty jsou > 140 nkat/g, hraniční pásmo je v rozmezí 70-140 nkat/g, patologické hodnoty < 70 nkat/g (hodnoty jsou pro stanovení při 30°C). Souprava byla donedávna vyráběna firmou Boehringer, v současné době není dostupná.
Stanovení elastázy-1 (EL-1) ve stolici je založeno na imunologickém průkazu ELISA metodou s monoklonální protilátkou k lidské, pankreatické elastáze. Vzorek stolice je v laboratoři homogenizován v extrakčním nárazníkovém roztoku a po ředění 1:500 dále zpracován běžným ELISA postupem na mikrotitrační destičce s detekcí pomocí POD-streptavidin. Souprava obsahuje 5 kalibračních standardů v rozmezí 0.3-10.0 ng/ml. Referenční hodnoty jsou 200-500 µg/g stolice, hraniční pásmo je 100-200 µg/g, závažná pankreatická insuficience je stanovena při hodnotách < 100µg/g stolice. Imunochemické stanovení elastázy-1 není ovlivněno pasáží tlustým střevem, substituční terapií ani jinými faktory, které ovlivňují enzymové stanovení chymotrypsinu ve stolici.
4.3 Vyšetření funkce tenkého střeva
4.3.1 Beta-karoten
Stanovení ß-karotenu se provádí pomocí HPLC nebo extrakční metodou (vytřepání do petroléteru/chloroformu, nebo jiných organických rozpouštědel) se spektrofotometrickým měřením. Referenční hodnoty závisí na postupu stanovení, běžně je uváděno rozmezí pro extrakční metodu tj.stanovení celkových sérových karotenoidů, 0.90-4.60 µmol/l, užší pásmo referenčních hodnot je 1.12-3.72 µmol/L. Pro screening malabsorpčního syndromu u dospělých se uvádí pouze dolní hranice 0.93 µmol/l.Přestože extrakční metodika stanovuje celkové karotenoidy, hodnoty jsou uváděny jako ß-karoten. Pro HPLC techniku specificky stanovující pouze ß-karotén je popsáno referenční pásmo 0.37-74 µmol/l. Hladina ß-karotenu není signifikantně rozdílná v závislosti na pohlaví, u mužů jsou však hodnoty nižší než u žen.
Klinický význam má stanovení ß-karotenu především jako screeningový test při podezření na malabsorpční syndrom. Zvýšená hladina ß-karoténu je popsána u hypothyreózy, diabetes mellitus, myxedému, nefrotického syndromu, hyperlipoproteinémií a u žen v těhotenství.
Zátěžový test s ß-karotenem porovnává hladinu nalačno a vzestup po zátěži. Pacientovi je podávána dávka 15000 IU s jídlem po dobu tří dnů. Normální hodnotou je vzestup oproti hodnotě nalačno o > 65 µmol/l. Tento zátěžový test je klinicky používán velmi zřídka, běžněji je používán zátěžový test s A-vitaminem.
4.3.2 Toleranční test s A-vitaminem
Provedení zátěžového testu. Pacient přichází nalačno, je odebrán vzorek krve a pak je podána zátěž 5000 IU A-vitaminu/kg váhy a tekutina (čaj). Za 3 a 5 hodin po podání A-vitaminu je odebrán vzorek krve pro analýzu.
Stanovení A-vitaminu v séru je možno provádět extrakční metodou se spektrofotometrickým měřením. Základní metodika podle Carr-Price je založena na reakci s chloridem antimonitým, nutná je korekce na ß-karoten. Moderní metodiky stanovení A-vitaminu využívají separačních možností HPLC.
Referenční hodnoty A-vitaminu v séru jsou v rozmezí 1.8-2.3 µmol/l, klinicky se prosté stanovení sérové hladiny využívá jen zřídka. Zátěžový toleranční test s A-vitaminem je hodnocen vzestupem hladiny v séru za 3 a 5 hodin po podání testovací zátěže. Normální hodnoty za 3 hodiny jsou v pásmu 3.6-12.6 µmol/l, za 5 hodin 7.2-24.6 µmol/l. Patologický výsledek testu je při hodnotách < 3.6 µmol/l za 3 hodiny resp. < 7.2 µmol/l za 5 hodin.
Klinický význam má toleranční test s A-vitaminem při diferenciální diagnostice malabsorpčního syndromu. Pozitivita testu koreluje s vylučováním tuku ve stolici.
4.3.3 Toleranční test s D-xylózou
Provedení testu. Pacient přijde nalačno, odebere se vzorek krve a moče a podá se zátěž D-xylózou. U dospělých osob se podává 25g D-xylózy, u dětí 5g; alternativní postup (především u dětí) doporučuje 0.5g/kg váhy. Po dobu 5 hodinového sběru moče pacienta saturujeme tekutinami (minimálně 2x250 ml čaje). Po 2 hodinách se odebere další vzorek krve, po 5 hodinách poslední porce moči. Změří se celkový objem moče za 5 hodin a pro analýzu se vezme vzorek cca 10ml moče. Variantní uspořádání testu umožňuje odběr krve i v jiném intervalu než 2 hodin, u dětí se odebírá obvykle krev již za 1 hodinu.
Stanovení D-xylózy je založeno na reakci 4-bromanilinu s furfuralem, který vzniká dehydratací D-xylózy v kyselém prostředí. Vzniklý barevný produkt je měřen fotometricky při 520nm. Reakce probíhá v přítomnosti thiomočoviny, která minimalizuje tvorbu interferujících barevných produktů. Vzorky krve je nutno před stanovením D-xylózy deproteinovat, doporučená je procedura se síranem zinečnatým a hydroxidem barnatým. Alternativní postupy pro stanovení D-xylózy jsou plynová chromatografie, HPLC a enzymová metoda s D-xylózo-oxidoreduktázou (s NADP+).
Referenční hodnoty D-xylózy. Hladina v séru za 1 hod po podání D-xylózy je 1.40-3.80 mmol/l, za 2 hodiny 2.13-3.86 mmol/l, za 3 hodiny 1.27-2.80 mmol/l, za 4 hodiny 0.73-1.93 mmol/l za 5 hodin 0.40-1.20 mmol/l. Patologickým výsledkem je hladina za 2 hodiny u dospělých po podání 25g < 1.67 mmol/l u dětí po podání 5 g < 1.33 mmol/l. V 5ti hodinovém sběru moče je u dětí 5-12 let po podání 5g D-xylózy patologickým výsledkem hodnota < 0.8g/5hod (širší rozmezí normálních hodnot je 0.5-1.65 g/5hod), u dospělých osob po podání 25g hodnota < 4g/5 hod (podle některých autorů je jako patologický hodnocen nález <5g/5 hod), u osob starších 65 let klesá hraniční hodnota na 3.5g/5hod. Při podání D-xylózy podle váhy (především u malých dětí) je normální rozmezí xylózy vyloučené močí za 5 hodin 10-33% podaného množství.
Klinický význam. Toleranční test s D-xylózou je obvykle indikován k potvrzení střevní malabsorpce u gluténové enteropatie (céliakální sprue), tropické sprue. Výsledek výdeje močí je ovlivněn funkcí ledvin. Falešně pozitivní výsledek může být stanoven např. při zvracení, dehydrataci, myxedému, ascitu, edému. Celá řada léků snižuje exkreci D-xylózy ledvinami - např. kyselina aminosalicylová, acetylosalicylová, digitalis, indomethacin, neomycin a další. 14C-D-xylózový dechový test je variantou xylózového absorpčního testu.
4.4 Dechové testy
V současné době existuje široká škála značených substrátů pro funkční testy žaludeční pasáže (13C-acetát), pankreatické funkce (14C-cholesteryl-octanoid, 13C-triolein, amylóza), střevní malabsorpce (14C/13C-xylóza,laktóza,palmitát), jaterních funkcí (13C-aminopyrin, leucin),13C-močovina k detekci ureázy při infekci Helicobacter pylori. K provedení dechových testů jsou dodávány soupravy, které obsahují definované množství substátu, 2 až 6 odběrových nádobek pro vzorky vydechovaného vzduchu (podle uspořádání testu) a odběrovou trubičku. Screeningové testy jsou dodávány v balení, ve kterém může nemocný po odběru vzorky zaslat do laboratoře poštou.
5. Screeningové programy
5.1 Okultní krvácení
Průkaz okultního krvácení lze provádět s využitím pseudoperoxidázové vlastnosti hemoglobinu nebo imunochemickým průkazem. Pseudoperoxidázová reakce hemoglobinu je základem řady testů, které obsahují testovací médium (papírek) impregnované guajakovou pryskyřicí nebo derivátem benzidinu - např. dimethylbenzidinem (o-tolidin). Bezbarvá leukoforma těchto látek je v přítomnosti peroxidu vodíku a hemoglobinu oxidována na barevnou (chromogenní) formu. Vzhledem k chemickému principu oxidační reakce jsou testy ovlivněny přítomností jiných oxidačních látek (C-vitamin), přítomností hemoglobinu z potravy (maso, krev), falešně pozitivní výsledek může být způsoben i přítomností rostlinných peroxidáz (některé druhy kořenové zeleniny). V závislosti na uspořádání testu je proto doporučováno definované, dietní omezení. Citlivost testů s guajakovou pryskyřicí je řádově nižší ve srovnání s testy imunochemickými. Mezi nejčastěji používané testy patří především Haemoccult, HemoCare, HemDetect, HemaCheck, ColoScreen a další. Detekční papírek impregnovaný o-tolidinem je v soupravě dříve často používaného německého Krypto-Haem-SSW testu.
Druhým přístupem je imunochemická detekce hemoglobinu reakcí s monoklonální protilátkou proti lidskému hemoglobinu. Na imunochemickém principu jsou založeny testy hemaglutinační, latexové imunoprecipitace, radiální imunodifúze i imunoafinitní chromatografie. Detekce proteinu (lidského hemoglobinu) monoklonální protilátkou vylučuje možnost ovlivnění jiným zdrojem hemoglobinu (potrava), odpadá interference chemických látek, není nutna specielní dieta. Citlivost imunochemických testů je výrazně vyšší; v závislosti na technice i < 0.1 mg hemoglobinu/g stolice. K imunochemickým testům patří např. latexový test Hemolex, na principu reversní pasivní hemaglutinace Heme-Select, imunoafinitní chromatografie ImmoCare.
Provedení testu. Pro screening jsou dodávány soupravy, které obsahují většinou 3 testy a plastové nebo dřevěné špátle na odběr stolice. Pacient odebere vzorky stolice, které rozetře na označená místa testu, testovací okénka uzavře a testy odešle do laboratoře. Laboratorní zpracování spočívá v aplikaci detekčního reagens na opačnou stranu okének a zhodnocení případné barevné změny. Hodnocení je kvalitativní, jako pozitivní je hodnocen každý test, kde dochází ke specifickému modro-zelenému zabarvení (u Haemoccult testu).
Imunochemické testy se výrazně liší podle typu použité techniky. V poslední době je nejrozšířenější varianta imunoafinitní chromatografie. Pacient odebere 1 vzorek stolice do odběrové nádobky se stabilizujícím roztokem. Laboratorní zpracování spočívá v aplikaci kapky extraktu na test a odečtení 1 nebo 2 barevných proužků, které detekují přítomnost pouze protilátky s barevným markerem (negativní test, 1 barevný proužek) nebo vznik komplexu antigenu-protilátky (pozitivní test, 2 barevné proužky). Hodnocení je opět kvalitativní.
Klinický význam screeningu je v záchytu časných fází kolorektálního karcinomu (Dukes stadium A a B) s možností radikální chirurgické léčby a v detekci prekanceróz tlustého střeva, především adenomových polypů, které je možno při následném diagnostickém programu endoskopicky odstranit.
5.2 Helicobacterová infekce
Stanovení protilátek k Helicobacter pylori. Protilátky v séru lze detekovat celou řadou imunologických a sérologických technik jako je imunobloting, imunofluorescence, hemaglutinace, fixace komplementu, latexové testy apod. Nejrozšířenější metodou je však bezesporu ELISA - jednoduchá, rychlá, levná a spolehlivá technika. Specificita a senzitivita metody je však značně závislá na použitém antigenu - od celých buněk, přes ultrazvukový sonikát, glycinový extrakt až k purifikovaným proteinům. V roce 1989 byla popsána izolace vysokomolekulárního povrchového proteinu (označovaný HM-CAP, high molecular weight cell-associated protein), jehož specificita a senzitivita dosahuje 95%.
Klinický význam. Sérologický průkaz protilátek k Helicobacter pylori má klinický význam především pro dlouhodobé sledování po léčbě, k monitorování úspěchu eradikace Helicobacter pylori, pokles IgG po 6 měsících léčby na hodnoty < 50% vykazuje specificitu 95% a senzitivitu 97%. Mezi indikace patří screening rizikových pacientů, např. u nemocných s transplantací ledvin, kdy Helicobacterová infekce zvyšuje riziko vzniku peptického vředu a krvácení. V současné době probíhá diskuse o širším screeningu populace především u nižších věkových kategorií s následnou léčbou chronické infekce.
5.3 Glutenová enteropatie
Klasická forma, diagnostikovaná často již v dětském věku, je provázena hubnutím, průjmy a histologickým průkazem atrofické, ploché sliznice tenkého střeva (průkaz enterobiopsií). Základní léčbou je dietní režim s vyloučením lepku, tzv. bezlepková (gluten-free) dieta. Po nasazení této léčby dochází u klasické formy k normalizaci klinického stavu i laboratorních testů. Další formy nejsou běžně diagnostikovány a tvoří téměř 80% případů, které jsou schematicky rozděleny do dalších skupin v modelu ledovce
(obr. 6.7).
Latentní forma je charakterizována patologickými hodnotami sérologických testů, při enterobiopsii se však často nalézá normální histologický obraz i při návratu k normální dietě obsahující lepek.
Němá forma (silent CS) je charakterizována pouze pozitivními sérologickými testy.
Jako potenciální forma je označena populace s genetickou predispozicí tj. HLA Dqw2 antigenem a zvýšeným počtem intraepiteliálních lymfocytů resp. g/d IEL sybtypů. Incidence všech forem sumárně je podle současných evropských studií 1:200 až 1:250.
Detekce protilátek ke gliadinu (AGA), k retikulinu (ARA) a endomysiu (EmA) byla v nedávné době zařazena mezi diagnostická kriteria céliakie Evropskou společností pro dětskou gastroenterologii a výživu (ESPGAN).
Stanovení antigliadinových protilátek (AGA) třídy IgA a IgG je základním diagnostickým testem pro screeningové studie. Nejčastěji používanou technikou k detekci protilátek je ELISA test s Anti-IgA resp. Anti-IgG protilátkou (konjugovanou s peroxidázou), existuje i citlivější a-Gliatest s fluorogenní detekcí. Specificita a senzitivita v rozmezí 80-95% závisí na typu použitého antigenu, který se liší u různých výrobců. Námi doporučený test je založen na purifikované frakci a -gliadinu.
Stanovení antiendomysiálních protilátek (EmA). Detekce antiendomysiálních autoprotilátek vykazuje nejvyšší (téměř 100%) specificitu i když vlastní molekulární substrát definován zatím nebyl. Průkaz je prováděn imunofluorescenční technikou na substrátu hladkého svalu. Nejlepší výsledky poskytují řezy opičího jícnu, existují i varianty s jiným typem hladkého svalu.
Klinický význam screeningu spočívá v časné diagnostice i u asymptomatických (bezpříznakových) jedinců, kdy dodržování bezlepkové diety snižuje riziko rozvoje onemocnění včetně zvýšeného výskytu maligních nádorů (především lymfomu).
6. Doporučená literatura:
1. Jednoduché a složené lipidy a lipoproteiny v plazmě
1.1 Jednoduché lipidy a lipoproteiny
Fosfolipidy mají na 3.uhlíku glycerolu místo mastné kyseliny fosfomonoesterově vázaný fosfocholin, fosfoetanolamin, fosfoserin nebo fosfoinositol. Bisfosfatidylglyceroly se nazývají kardiolipiny. Sloučeniny, které nesou na 1.uhlíku základní fosfolipidové struktury namísto acylu vinyléterově vázaný alkyl, se nazývají plasmalogeny.
Cholesterol je zoosterol, jehož strukturní základ tvoří steranový (gonanový) skelet čtyř kondenzovaných isocyklických jader s jednou nenasycenou vazbou vycházející z 5. uhlíku, s -OH skupinou na 3. uhlíku, se dvěma methylovými skupinami v polohách 10 a 13 a s rozvětveným uhlovodíkovým řetězem na 17. uhlíku. V našem organismu se vyskytuje buď jako "volný", nebo jako esterifikovaný na hydroxylové skupině v poloze 3 vyššími mastnými nenasycenými kyselinami. Vžitý pojem "volný" zde znamená neesterifikovaný. Z celkového cholesterolu v plazmě jsou přítomny asi 2/3 v podobě esterifikované.
Hydrofóbní charakter lipidů způsobuje, že se jejich molekuly samotné nemohou v hydrofilním vnitřním prostředí organizmu volně vyskytovat. V plazmě se pohybují buď ve vazbě na nosič (NEMK ve vazbě na albumin) nebo ve formě částic proměnlivého složení, lipoproteinů, jimž určitou skupinovou charakteristiku poskytuje přítomnost specifických bílkovinných složek, apoproteinů. Lipoproteiny zaujímají v prostoru přibližně kulovitý tvar. Mají jednovrstevný povrch složený z molekul cholesterolu a fosfolipidů, uspořádaných tak, že jejich hydrofilní části jsou orientovány ven a hydrofóbní dovnitř partikule. Molekuly apoproteinů jsou uloženy na
tomto povrchu, nebo jsou do něho zanořeny a jenom jejich část vyčnívá navenek. Jádro částice tvoří neuspořádané nepolární triacylglyceroly a estery cholesterolu.
Klasifikace a názvosloví lipoproteinů jsou poznamenány historickým vývojem metodologie jejich analýzy. Z praktických důvodů se stále používá názvů odvozených z ultracentrifugace v gradientu hustoty: lipoproteiny o vysoké hustotě (high density lipoproteins, HDL), lipoproteiny o nízké hustotě (low density ..., LDL), lipoproteiny o střední hustotě (intermediate ..., IDL) a lipoproteiny o velmi nízké hustotě (very low..., VLDL). Částice, které při této technice "plavou" vždy na povrchu, flotují, se jmenují chylomikrony. Poněkud jiné jsou názvosloví a třídění podle pohyblivosti lipoproteinů při agarózové elektroforéze
(viz též část 5.3 této kapitoly). Kdybychom srovnávali s elektroforézou bílkovin séra, potom nejrychleji, tj. na úrovni alfa-globulinové frakce, se pohybují alfa-lipoproteiny, které odpovídají frakci HDL. Pomalejší jsou prebeta-lipoproteiny, odpovídající frakci VLDL a na úrovni beta-globulinové frakce migrují
beta-lipoproteiny, tedy částice LDL. Částice IDL, které vznikají katabolismem VLDL, vytvářejí na elektroforeogramu obraz "široké" beta zóny.
Chylomikrony vzhledem ke svému složení a velikosti v agarózovém gelu neputují a zůstávají na startu. Elektroforetické vlastnosti lipoproteinů a z části i jejich chování v tíhovém poli ultraodstředivky jsou vysvětleny jejich velikostí a složením, zvláště poměrem triacylglycerolů a cholesterolu vůči proteinům
(tab. 7.1). Chylomikrony jsou v průměru o jeden řád větší než LDL, IDL a VLDL a až o dva řády větší než HDL. Nejvyšší relativní podíl proteinů mají HDL a nejnižší chylomikrony, největší relativní podíl cholesterolu obsahují LDL, největší relativní podíl triacylglycerolů mají chylomikrony a hned po nich VLDL, atd.
Nejmladší je názvosloví samotných proteinových složek lipoproteinových částic, tedy apoproteinů (někdy nazývány také "apolipoproteiny"). Začaly se označovat velkými písmeny abecedy, ale jak přibývalo znalostí o odlišnosti jejich struktury (podtřídy, isoformy) a o specifitě účinku, přibyla k odlišení arabská a římská čísla a v jednom případě též malé písmeno (tab. 7.2).
 3.2. S-glutathion-S-transferáza, GST
3.2. S-glutathion-S-transferáza, GST
Glutathion-S-transferáza má dvě molekulové formy s rozdílnou lokalizací: a-GST je přítomna v hepatocytech a p-GST (obr. 5.2) je v epitelu žlučových cest. Podobně bilokulární je tento enzym i v ledvinách ( a-GST v proximálním a p-GST v distálním tubulu). Hepatocelulární, tzv. kationická B forma glutathion-S-transferázy, dříve též protein Y nebo ligandin, představuje specifický a velmi citlivý ukazatel poškození hepatocytů. Akutní onemocnění jater bývají provázena jeho 100 až 200-násobným zvýšením. Dnes existují dostupné imunochemické metody vyšetření GST a proto lze brzo očekávat širší klinické využití tohoto parametru.
LD je všudypřítomný cytoplazmatický enzym tvořený 4 podjednotkami dvou možných typů: M (z angl. muscle) a H (heart). Podle zastoupení jednotek uvedených typů lze rozlišit 5 isoenzymů, které jsou do určité míry orgánově resp. tkáňově specifické. V hepatocytech převládá isoenzym LD5. Celková aktivita S-LD se stanovuje kineticky při 37° C (viz stanovení ALT), vyšetření isoenzymů se provádí elektroforeticky. Referenční rozmezí katalytické koncentrace S-LD je 2,5 - 7,7 µkat/l, normální zastoupení S-LD5 činí 6-16%.
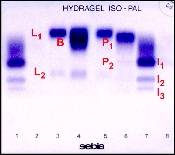 4.1. S-alkalická fosfatáza (ALP) a její jaterní isoenzym
4.1. S-alkalická fosfatáza (ALP) a její jaterní isoenzym
ALP je enzym přítomný v mnoha tkáních a je známa řada normálních i za patologických okolností se vyskytujících isoenzymů (obr. 5.3). Praktický význam mají normální isoenzymy kostní, jaterní a střevní, které představují podstatnou část sérové aktivity ALP. V dětském věku převažuje kostní izoenzym, v dospělosti je jeho podíl i celková hodnota S-ALP nižší. V těhotenství k nim přistupuje isoenzym placentární a hodnota S-ALP se zvyšuje.
GMT je přítomna ve všech tkáních. Enzym přenáší g-glutamylový zbytek na aminoskupiny některých L-aminokyselin. Reakce poředstavuje první krok v přeměně konjugátů některých xenobiotik s glutathionem na S-substituovaný N-acetylcystein. V játrech se GMT vyskytuje jednak v mikrosomální frakci hepatocytů, jednak v buněčných membránách buněk výstelky žlučových cest. Nejvíce GMT je obsaženo v játrech, ledvinách, pankreatu a ve střevě. Přestože je známa řada isoenzymů GMT, nemá jejich vyšetřování praktický význam.
Místo vyšetření isoenzymů ALP se v některých laboratořích provádí vyšetření NTS a LAP. Jejich zvýšené hodnoty spolu s vyšší hodnotou S-ALP obvykle potvrzují jaterní původ ALP. U nás se tato vyšetření příliš nerozšířila stejně jako vyšetření Lp-X, abnormálního lipoproteinu obsahujícího neesterifikovaný cholesterol.
5.1. S-albumin
Albumin tvoří 40-60% krevních bílkovin. Je syntézován výlučně v játrech. Na udržení stálé krevní hladiny albuminu se podílí jaterní syntéza spolu s tkáňovým katabolismem. Normální poločas albuminu je 15-20 dní.
Hodnoty S-prealbuminu (stanovuje se imunochemickými metodami, nejčastěji imunoturbidimetricky) se mění ze stejných příčin jako hodnoty S-albuminu. Ke změnám hladiny S-prealbuminu dochází díky jeho krátkému poločasu (1,9 dne) rychleji než u albuminu. Normální hodnota je 0,2 - 0,3 mg/l.
Cholinesterázová aktivita se vyskytuje v řadě orgánů a je podmíněna několika izoenzymy. Praktický význam má stanovení celkové S-CHE, nazývané též pseudocholinesteráza (štěpí substrát butyrylthiocholinjodid), která je převážně jaterního původu a jejíž fyziologická funkce je na rozdíl od tzv. pravé čili acetylcholinesterázy nejasná. S-CHE bývá jen mírně zvýšena u akutní virové či toxické hepatitidy. Chronická hepatitida, cirhóza, novotvary jater a infiltrativní procesy bývají provázeny výrazným snížením hodnot S-CHE. Sledování S-CHE u těchto onemocnění má prognostický význam: náhlý nebo výrazný pokles aktivity je nepříznivým znamením. Kromě jaterních onemocnění může být snížení hodnot S-CHE způsobeno otravou organofosfáty a některými léky.
LCAT je syntézována v hepatocytech, odtud se dostává do krve a zde vytváří komplex s HDL a katalyzuje přenos mastné kyseliny z lecithinu na neesterifikovaný cholesterol uvolněný z buněčných membrán. Parenchymové jaterní léze bývají provázeny poklesem plazmatické koncentrace LCAT, která je některými autory považována za nejcitlivější ukazatel jaterní dysfunkce. Stanovení LCAT nepatří mezi běžně dostupná vyšetření.
Z koagulačních faktorů I - XIII se v játrech nesyntézují pouze faktory III (tkáňový faktor), IV (Ca 2+), VI (u člověka není) a zčásti VIII (antihemofilický faktor). V játrech rovněž vznikají dva proteiny fibrinolytického systému (plazminogen a a2-antiplazmin) a antitrombin III. Faktory II, VII, IX a X vyžadují k posttranslační karboxylaci v hepatocytech vitamin K. Onemocnění jaterního parenchymu provázená poruchou proteosyntézy nebo obstrukční ikterus s poruchou vstřebávání tuků a v nich rozpustných vitamínů, mohou být příčinou poruchy koagulace. Koagulační poruchu u obstrukčního ikteru lze na rozdíl od parenchymové léze rychle upravit parenterálním podáním K vitaminu. Vyšetřování koagulačních parametrů sice nepatří mezi skríningová vyšetření, avšak především opakované vyšetřování protrombinového času má význam pro sledování průběhu chronických jaterních chorob. Jelikož je hodnota PT závislá na více faktorech (II, V, VII, X), nepřináší současné vyšetřování PTT žádnou další podstatnou informaci o jaterním onemocnění. Vyšetření jak PT, tak PTT spolu s vyšetřením počtu trombocytů musí předcházet invazívní diagnostické popř. léčebné výkony (biopsii, laparoskopii aj.)
Zvýšená tvorba kolagenu v játrech je dobrým indikátorem aktivity zánětlivého jaterního onemocnění a bývá provázena zvýšením sérové hladiny aminoterminálního propeptidu kolagenu III. Stanovení se provádí RIA nebo jinými imunoanalytickými metodami, orientační fyziologické rozmezí činí 2,8 - 13 µg;/l.
6.1. Elektroforéza sérových bílkovin (ELFO bílkovin)
U jaterní cirhózy bývá nižší hodnota albuminu a vyšší hodnota gammaglobulinů, albumin/globulinový kvocient (A/G) je snížen. Obstrukce žlučových cest bývá provázena zvýšením a2 a bglobulinů. Deficience a1-antitrypsinu bývá provázena snížením a1 globulinů. U nemocných s intravaskulkární hemolýzou bývá snížena hladina a2 globulinů v důsledku spotřebování haptoglobinu.
Stanovení amoniaku je nejčastěji založeno na glutamátdehydrogenázou katalyzované reakci amoniaku s a-ketoglutarátem. Normální hodnoty jsou 6,5 - 35 µmol/l. Vyšetření plazmatického amoniaku musí být provedeno ihned po odběru. Nemocný nesmí alespoň 8 hodin kouřit a materiál nesmí být odebírán ani zpracováván v zakouřeném prostoru.
Zvýšení hodnot S-cholesterolu se pozoruje u obstrukčního a cholestatického ikteru, zatímco u pokročilé jaterní cirhózy mohou být hodnoty S-cholesterolu snížené. O cholesterolu je podrobněji pojednáno v kapitole o poruchách lipidového metabolismu.
Slouží ke kvantitativnímu posouzení některých jaterních funkcí. O metabolické kapacitě jater informuje galaktózový eliminační test. Mezi testy mikrosomálních funkcí patří kofeinová a antipyrinová clearence. Clearence indocyaninové zeleně (ICG) a sorbitolu informují o jaterním průtoku krve. Uvedené testy nejsou běžnou součástí vyšetřovacího programu nemocných s jaterními chorobami a až na výjimky nemají diagnostický ani diferenciálně diagnostický význam. Testy však mohou přispět k posouzení stupně jaterního onemocnění a v případě opakovaného provedení s časovým odstupem mají i význam prognostický. Na některých pracovištích patří např. antipyrinová clearence mezi kritéria, podle kterých se rozhoduje o indikaci k transplantaci jater.
Mezi vyšetření metabolických nemocí jater počítáme vyšetření mědi v séru a v moči, sérového ceruloplazminu, obsahu mědi v jaterní tkáni, sérového železa, vazebné kapacity pro železo a sérového ferritinu a dále vyšetření porfyrinů a jejich prekurzorů v moči, porfyrinů ve stolici a v plazmě a vyšetření aktivit některých enzymů metabolické dráhy porfyrinů. K dalším speciálním vyšetřením počítáme např. vyšetření -fetoproteinu (AFP), jehož středně zvýšené hodnoty v séru (50 - 500 µg/l, norma je do 20 µg/l) bývají pozorovány u nemocných s jaterní cirhózou. Hodnoty 1000 µg/l a více signalizují obvykle přítomnost hepatocelulárního karcinomu.
- vyšetření odpadu porfyrinů v moči (referenční rozmezí do 200 µg/24 h)
- vyšetření kyseliny d-aminolevulové (ALA) a porfobilinogenu (PGB) ve vzorku čerstvé moči (referenční rozmezí ALA do 7,6 mg/l, PBG do 3,3 mg/l)
- vyšetření obsahu porfyrinů ve vzorku nesbírané stolice (norma do 200 nmol/g sušiny)
- určení plazmatického fluorescenčního maxima (normálně negativní),
- chromatografické vyšetření porfyrinů v moči a ve stolici metodou vysokoúčinné kapalinové chromatografie (HPLC),
- vyšetření aktivity erytrocytární porfobilinogendeaminázy,
- vyšetření protoporfyrinu a jeho Zn-komplexu v erytrocytech,
- vyšetření některých dalších enzymů dráhy porfyrinového metabolismu.
- porphyria cutanea tarda (PCT)
- akutní porfyrie:
akutní intermitentní porfyrie (AIP)
porphyria variegata (PV)
hereditární koproporfyrie (HC).
1) Spolehlivě rozpoznat ataku akutní porfyrie. Tu odhalí vyšetření ALA a PBG, jejichž hodnoty bývají v atace několikanásobně vyšší. Zvýšené vylučování ALA spolu s normálním vylučováním PBG budí podezření na otravu olovem. Dále bývá v atace zvýšené vylučování uro- a koproporfyrinu močí i stolicí.
2) Spolehlivě diagnostikovat PCT. Pro tuto nejčastější porfyrii je typická kombinace kožních příznaků a pěti- až padesátinásobné zvýšení vylučování porfyrinů močí, ve které převažuje uroporfyrin. Vzhledem k tomu, že se kožní příznaky mohou objevit i u PV nebo HC, výskyt atak(y) může v anamnéze chybět a zvýšené vylučování porfyrinů močí může být rovněž přítomno (zejména u HC), bývá třeba provést chromatografické vyšetření porfyrinů ve stolici. Pro PCT je diagnostický nález řady abnormálních porfyrinů (isokoproporfyrin, deethylisokoproporfyrin, porfyriny s 5-7 COOH skupinami).
3) Poznat akutní porfyrii v období mimo ataku. Nemocní s PV trvale vylučují stolicí zvýšené množství protoporfyrinu a mají pro tuto chorobu charakteristické plazmatické fluorescenční maximum (627 nm, ostatní porfyrie 619 nm). Nemocní s HC trvale vylučují stolicí a někdy i močí zvýšené množství koproporfyrinu. Normální nález v moči i ve stolici svědčí pro AIP, kterou je nutno potvrdit nálezem snížené aktivity defektní porfobilinogendeaminázy v erytrocytech.
Jindra A., Kovács P., Pšenák M., Šípal Z.: Biochémia. Molekulárnobiologické a farmaceutické aspekty. Osveta n.p., Martin 1995.
Karlson P., Gerob W., Gross W.: Patobiochemie.Academia Praha 1987.
Kaplan L.A., Pesce A.J.: Clinical Chemistry. Theory, analysis, and correlation.
The C.V.Mosby Company St. Louis 1989.
Musil J., Nováková O.: Biochemie v obrazech a schématech.
Avicenum Praha 1990.
Masopust J.: Vybrané kapitoly z patobiochemie orgánů I.
Medprint Praha 1993
Isselbacher K.J., Braunwald E. et al.: Harrison's Principles of Internal Medicine.
Mc. Graw-Hill Inc. New York, London 1994
Biochemická diagnostika v gastroenterologii
Autor kapitoly: MUDr.Petr Kocna CSc, Ústav klinické biochemie VFN a 1.LF UK Praha
Klinicko-diagnostický proces v oblasti zažívacího ústrojí je založen na řadě specializovaných vyšetření, ke kterým patří zejména moderní zobrazovací metody (endoskopie, sonografie, RTG, CT, NMR) poskytující morfologický obraz orgánů. Nedílnou součást diagnostiky však přesto tvoří metody biochemické. Přínos biochemických testů pro klinicko-diagnostický proces je především v oblasti funkčních testů, screeningových programů a sledování dynamiky procesů v průběhu léčby resp. dlouhodobého sledování nemocného (follow-up). Při interpretaci výsledků, především funkčních testů je třeba zvažovat dobu pasáže, tj. dobu od polknutí potravy (např. testačního pokrmu) k dosažení cílového (testovaného) úseku trávicího ústrojí.
Doba pasáže (obr 6.1) je individuelní a může být výrazně ovlivněna jak vlastním patologickým procesem tak i psychickým stavem nemocného (stres, strach z vyšetření apod.).
Při interpretaci výsledků, především funkčních testů je třeba zvažovat dobu pasáže, tj. dobu od polknutí potravy (např. testačního pokrmu) k dosažení cílového (testovaného) úseku trávicího ústrojí.
Doba pasáže (obr 6.1) je individuelní a může být výrazně ovlivněna jak vlastním patologickým procesem tak i psychickým stavem nemocného (stres, strach z vyšetření apod.).
Biochemické testy a metodiky, které využíváme v diagnostice chorob zažívacího ústrojí tvoří velmi heterogenní skupinu, ze které lze velmi obtížně vytvořit jednoduchou kategorizaci. Nejčastěji se používá členění anatomické, orgánové, které neumožňuje jednoznačné zařazení všech testů, resp. řada testů musí být přiřazena duplicitně k několika anatomickým lokalizacím. Druhým kriteriem je klinicko-diagnostické, tj. přiřazení testu podle diagnostického problému. Třetí variantou je laboratorně-metodický přístup, který jsme zvolili jako optimální, s ohledem na zaměření této publikace.
2.1.1 Žaludek
Základním biochemickým vyšetřením je funkční test stanovení sekrece HCl (žaludeční acidita), v krevním séru stanovujeme hladinu gastrinu, pepsinogenů. Průkaz infekce Helicobacter pylori se provádí v biopsii sliznice rychlým ureázovým CLO testem (viz část 5.2), pro screening a dlohodobé sledování jsou vhodné serologické metody stanovení protilátek a dechové testy. Z klinických indikací je nejčastější vředová chroba gastroduodenální, karcinom žaludku, Zollinger-Ellisonův syndrom, akutní nebo chronická infekce Helicobacter pylori.
Běžným laboratorním testem je stanovení hladiny celkové a-amylázy v séru, vyšší specificitu poskytuje pankreatický izoenzym a -amylázy, stanovení lipázy a dalších pankreatických enzymů (trypsin, chymotrypsin, elastáza-1, fosfolipáza-A2). K vyšetření exokrinní funkce pankreatu slouží přímý test sekretin-cholecystokininový, nepřímé testy s chromogenním substrátem (PABA test), s fluorogenním substrátem, nebo testy dechové. Další variantou je stanovení chymotrypsinu nebo elastázy-1 ve stolici. Z tumorových markerů lze pro diagnostiku karcinomu pankreatu využít CA 19-9 a CA 242, případně CEA. Pro hodnocení závažnosti akutní pankreatitidy lze využít běžně používaných markerů zánětlivých procesů (reaktanty akutní fáze - CRP, LDH, a1-antitrypsin) zvláště výhodným markerem je leukocytární (polymorfonukleární) PMN-elastáza. Z klinických indikací je nejčastější akutní nebo chronická pankreatitida, karcinom pankreatu, malabsorpční syndrom.
Základním biochemickým testem je sérová hladina ß-karotenu a funkční testy s perorálně podaným A-vitaminem nebo xylózou. V dg.procesu se významně uplatňuje histochemické a imunohistochemické stanovení řady enzymů v bioptickém vzorku sliznice tenkého střeva. Při podezření na glutenovou enteropatii (céliakální sprue) stanovujeme sérovou hladinu protilátek ke gliadinu, antiretikulinových a antiendomysiálních protilátek, které mají význam i pro screeningové programy. Při malabsorpčním syndromu stanovujeme hladinu vápníku, železa, celkovou bílkovinu, alkalickou fosfatázu.
Biochemická diagnostika v oblasti tlustého střeva zahrnuje především testy okultního krvácení, a to jak pro screeningové programy tak pro dispensarizaci rizikových skupin populace. Další metody jsou zaměřeny na průkaz proliferační aktivity sliznice tlustého střeva a to v diagnostice malignity, nebo zhodnocení aktivity zánětlivého procesu při Crohnově chorobě nebo idiopatické proktokolitidě. Z tumorových markerů je pro tuto lokalizaci vhodný CEA, CA 19-9 a CA 242.
Správná volba vhodných biochemických testů a kvalifikovaná interpretace výsledků by měla být samozřejmou součástí klinicko-diagnostické rozvahy. Z tohoto klinického pohledu je výhodná kategorizace testů podle jejich vztahu k jednotlivým patologickým procesům nebo diferenciálně-diagnostickým otázkám (obr.6.2). Patologickým procesem může být např. malabsorpční syndrom, jehož příčiny mohou být v porušené absorpci tenkého střeva nebo v insuficienci exokrinní sekrece pankreatu. Klinicko-diagnostickou otázkou může být rozlišení karcinomu pankreatu od chronického zánětu. Diagnostickýmproblémem může být nalezení zdroje krvácení do zažívacího systému, které může být lokalizováno v jícnu, žaludku, tenkém i tlustém střevě. Velmi častou dg. otázkou je stanovení aktivity procesu (zánětlivého, nádorového) a odpověď na léčbu tj. dlouhodobé sledování nemocného.
Patologickým procesem může být např. malabsorpční syndrom, jehož příčiny mohou být v porušené absorpci tenkého střeva nebo v insuficienci exokrinní sekrece pankreatu. Klinicko-diagnostickou otázkou může být rozlišení karcinomu pankreatu od chronického zánětu. Diagnostickýmproblémem může být nalezení zdroje krvácení do zažívacího systému, které může být lokalizováno v jícnu, žaludku, tenkém i tlustém střevě. Velmi častou dg. otázkou je stanovení aktivity procesu (zánětlivého, nádorového) a odpověď na léčbu tj. dlouhodobé sledování nemocného.
Laboratorní metody používané v gastroenterologii zahrnují stanovení řady enzymů a metabolitů v séru a v moči, imunologický průkaz protilátek, imunochemická stanovení hormonů, tumorových markerů, biochemické separační postupy detekce izoenzymů a makroforem enzymů, vyšetření žaludeční, duodenální a pankreatické šťávy, histochemické a imunohistochemické průkazy v bioptickém materiálu, kultivační a mikroskopický průkaz. Funkční testy mají složku prováděnou lékařem nebo zdravotní sestrou na lůžku či v ambulanci. Tímto stručným výčtem směřujeme k označení laboratorní medicíny; tj. metody používané v gastroenterologii nebudeme dělit na enzymologické, imunologické, histologické atd. Laboratorně-metodická kategorizace člení metody na 3 skupiny. Testy a metody prováděné rutinně ve smyslu běžné laboratoře klinické biochemie, metody aplikovatelné na automatické analyzátory. Funkční testy jsou druhou skupinou, testy specializované, prováděné většinou v návaznosti na vlastní funkční zátěž pacienta a odběr materiálu, který probíhá mimo laboratoř (na lůžku, ambulantně v ordinaci lékaře). Laboratorní analýza odebraných vzorků je většinou složitějším, manuálním procesem. Třetí skupinu tvoří screeningové programy, u kterých velmi často provádí odběr vzorku pacient sám, doma. Tato kategorizace je tedy členěním metodickým, technicko-organizačním.
3.1. Pankreatické enzymy
3.1.1. Alfa-amyláza
a-amyláza ( a-1,4-glukan-4-glukan-hydroláza, EC 3.2.1.1) hydrolyzuje a-1-4 glykosidovou vazbu; pH optimum a-amylázy je mezi 7.0-7.2. V organizmu se vyskytuje ve dvou formách - slinný a pankretický izoenzym, podle jejich orgánového původu. a-amyláza je tvořena v acinárních buňkách pankreatu a hromadí se v zymogenních granulech. Do střevního lumen se dostává ve formě pankreatického sekretu (pankreatické šťávy) spolu s dalšími trávicími enzymy. Za fyziologických podmínek není molekula enzymu absorpována střevním povrchem a sérová hladina je nízká, odpovídající aktivitě enzymu uvolněného do cirkulace přímo ze žlázových buněk resp. lymfatickou drenáží. Molekulová hmotnost a-amylázy je 55.000. Z cirkulace je a-amyláza eliminována v ledvinách glomerulární filtrací. Makroforma enzymu - makroamyláza vzniká vazbou enzymu na některé bílkoviny krevního séra, především imunoglobulíny, cirkulující imunokomplexy nebo jiné glykoproteiny. Makroforma enzymu má podstatně vyšší molekulovou hmotnost (od 150 000 do 2 000 000) a není proto eliminována glomerulární filtrací. Pro klinickou diagnostiku se stanovuje hladina a-amylázy v séru, v moči a vypočítává se index clearance amylázy/kreatininu.
Lipáza (triacylglycerol acyl hydroláza EC 3.1.1.3.) je rovněž glykoproteinem se 420 449 aminokyselinovými zbytky a molekulovou hmotností 46000 56000 u pankreatické lipázy a 32000 - 39000 u sérové lipázy. Lipáza je hydrolytickým enzymem štěpícím triacylglyceroly s mastnými kyselinami o delším řetězci než 12C, v přítomnosti žlučových kyselin štěpí tuk na monoacylglyceroly a diacylglyceroly. Predilekčně jsou štěpeny mastné kyseliny v polohách 1 a 3. Tak jako a-amyláza je i lipáza produkována žlázovými buňkami pankreatu a secernována do střevního lumen v pankreatické šťávě. Koncentrační gradient mezi pankreatickou tkání a sérovou lipázou je cca 20000:1. Pro enzymovou hydrolýzu je nezbytný serin v řetězci Asp His Ser, pH optimum je mezi 7.5 a 10.0, v závislosti na podmínkách reakce; pl hodnota popsaných forem enzymu je v rozmezí 5.80 a 7.4. Kromě pankreatické lipázy existují další formy triacylglycerolové lipázy např.lipáza jaterní, kterou lze odlišit inaktivcí atoxylem (pankreatická lipáza je rezistentní).
Trypsin
Trypsin (ve formě trypsinogenu) je obdobně jako další pankreatické enzymy produkován acinózními buňkami pankreatu a cestou pankreatického vývodu je secernován do duodena. Část přechází do krevního oběhu, kde jej lze stanovit imunologickými metodami (RIA). Většinou je stanoven trypsin spolu s trypsinogenem a komplexem trypsinu s a1-proteinázovým inhibitorem (a1-antitrypsin), v závislosti na použité detekční metodice (specificita protilátek). Fyziologické hodnoty se pohybují v rozmezí 100-400 µg/l opět v závislosti na typu použité detekční soupravy. U akutní pankreatitidy prokazujeme několikanásobné zvýšení (až 20000 µg/l), lehké zvýšení je u cholelitiázy. Snížené hodnoty svědčí pro chronickou pankreatitidu, mukoviscidózu. U karcinomu pankreatu lze prokázat snížené i zvýšené hodnotu trypsinu.
Elastáza (EC 3.4.21.11) je secernována jako proelastáza a aktivována trypsinem. Rozlišujeme elastázu-1 (Mr 30000; anodická frakce), která se vyskytuje v séru ve volné formě a v komplexu s a1-proteinázovým inhibitorem, a elastázu-2 (Mr 25000; katodická frakce). Hladina elastázy-1 je zvýšena u akutní i chronické recidivující pankreatitidy, přičemž zvýšení přetrvává déle a lépe koreluje s klinickým stavem než hladina a-amylázy. Ke stanovení elastázy-1 se používá RIA metody se 125I-značenou elastázou nebo novějších ELISA technik s monoklonální protilátkou k elastáze-1. Nejnovější studie prokazují význam stanovení elastázy-1 v diferenciální diagnostice karcinomu pankreatu. Elastáza-1 (stanovená ELISA technikou) má ze všech pankreatických enzymů pro karcinom pankreatu nejvyšší specificitu i sensitivitu. Referenční rozmezí (pro RIA metodiku) je 1.3-4.3 µg/l.
Tumorové markery představují značně heterogenní skupinu, do které patří onkofetální antigeny, specifické nádorové proteiny, proliferační proteiny, hormony, enzymy resp. isoenzymy a reaktanty akutní fáze. Stanovení tumorových markerů pro časnou diagnostiku nádorových onemocnění se v gastrointestinální oblasti neosvědčilo. Indikací vyšetření je především monitorování úspěšnosti terapie a dlouhodobé sledování nemocných, kdy změny hladiny tumorových markerů mohou signalizovat rozvoj metastatického procesu nebo recidivu tumoru. Pro přesnější vyhodnocení těchto změn lze s výhodou využít moderních expertních systémů, které pracují na základě statistických a predikčních algoritmů. Ze široké nabídky tumorových markerů lze pro uvedené indikace využít tyto tumorové markery:
3.3.1 Gastrin
Gastrin je hormon polypeptidového charakteru (molekula je tvořena 17 aminokyselinami, Mr = 2100), který se vyskytuje ve třech formách. Základní molekula G-17 (little gastrin), G-34 (big gastrin) a G-13 (mini gastrin) zkrácený řetězec na 13 aminokyselin. Pentapeptid s C-terminální sekvencí gastrinu (ß-Ala-Trp-Met-Asp-Phe-NH2) - pentagastrin se používá ke stimulaci při vyšetření žaludeční acidity.
Stanovení gastrinu je součástí gastrinového stimulačního testu, kdy stanovujeme 90ti minutový profil (v 9 vzorcích séra) po stimulaci insulinem, sekretinem nebo Ca-glukonátem.
Pepsin resp. pepsinogen je obecné označení pro řadu proteináz (pepsin A,B,C - EC 3.4.23.1,2,3) a jejich prekurzory (proenzymy). Aktivace pepsinogenu A na pepsin A probíhá v kyselém prostředí, vznikající pepsin A je schopen další aktivace pepsinogenu a vede k tzv. autokatalýze. Při elektroforetické separaci v agarovém gelu je možno stanovit 8 frakcí, frakce 1-5 tvoří skupinu pepsinogenů I (PG-I, odpovídající PG-A), další tři frakce pepsinogeny skupiny II (PG-II, odpovídající PG-C). Klinický význam má stanovení pepsinu při insulinovém testu a sérová hladina pepsinogenů A a C. Ke stanovení se používá RIA metodik s 125I-pepsinogenem v kompetitivním uspořádání. Pepsinogen A je markerem slizniční atrofie a je používán v genetických studiích jako subklinický marker vředové choroby duodena. Pepsinogen C je používán jako marker stavu žaludeční sliznice (případně v poměru PG-A/PG-C) a rovněž jako marker eradikace infekce Helicobacter pylori. Snížení hladiny pepsinogenu A prokazujeme u nemocných s achlorhydrií např. u perniciózní anémie.
Funkční testy tvoří významnou složku klinicko-diagnostického procesu v gastroenterologii. Doplňují výsledky zobrazovacích technik o podstatnou informaci, kterou je funkce orgánu, resp. schopnost reagovat na stimulaci. Funkční test zahrnuje přesně definovanou stimulaci a výsledek je interpretován jako odpověď orgánu na stimulaci s přihlédnutím k bazálním hodnotám analytu před stimulací. U nepřímých funkčních testů je nutno navíc při interpretaci posuzovat funkci dalších orgánů nebo systémů, které se na procesu podílejí. Např. u nepřímého testu, kdy je analyt vylučován ledvinami, je nutno výsledek interpretovat se znalostmi renálních funkcí; u dechových testů je nutno znát ventilační poměry, je-li analyt metabolizován v játrech - jaterní funkce apod. Komplexní zhodnocení a interpretace u funkčních testů vyžaduje úzkou spolupráci s indikujícím lékařem.
4.1.1 Stanovení žaludeční sekrece, acidity
Parietální buňky žaludeční sliznice produkují kyselinu chlorovodíkovou o koncentraci cca 0.5 mmol/l). Zdrojem vodíkového iontu H+ je voda,která je disociována membránovou hydrolýzou v součinnosti s reakcí karboanhydrázy produkující CO2. Karboanhydráza je limitujícím faktorem tvorby HCl v žaludeční sliznici. Regulace žaludeční sekrece je řízena neurohumorálně, významným faktorem je hladina gastrinu. Vyšetřování žaludeční acidity je založeno na stimulaci parietálních buněk, odběru žaludeční šťávy a stanovení obsahu volné a celkové HCl. Ke stimulaci je nejvhodnější pentagastrin
(viz část 3.3.1)
, použít lze i histaminu (Lamblingův test) nebo insulinu. Hodnocení funkčního testu je však závislé na typu stimulace tj. výsledek se liší po podání gastrinu, histaminu nebo insulinu.
Vyšetření exokrinní funkce pankreatu je zaměřeno ke stanovení pankreatické insuficience. Jako tzv. "zlatý standard" je označováno vyšetření přímé, kdy provádíme analýzu duodenálního obsahu po stimulaci enterohormóny. Jedná se o test, jehož výsledky poskytují jednoznačně nejvyšší specificitu i sensitivitu, test je však invasivní, náročný pro nemocného a vyžaduje náročnou laboratorní analýzu duodenálního obsahu. Proto se stále více uplatňují testy nepřímé, jednodušší a vhodné i pro screeningové účely.
Na stimulaci pankreatu se podílejí dva hormony, sekretin a cholecystokinin. Sekretin stimuluje vlastní sekreci pankreatické šťávy a produkci hydrogenuhličitanu, cholecystokinin stimuluje sekreci trávicích enzymů. Sekretinový test proto umožňuje zhodnocení pouze objemu pankreatického sekretu a koncentraci hydrogenuhličitanu, ke zhodnocení sekrece trávicích enzymů je nutné použít kombinované stimulace tj. sekretin-cholecystokininový test (PZS test; cholecystokinin = pankreozymin). Ke stimulaci může být použito místo cholecystokininu i ceruleinu. Sekretin-CCK test je prováděn v mnoha modifikacích, které se liší jak v množství stimulačních hormonů, ve formě podání (i.v., v infúzi), podání vnitřního markeru pro korekci objemu i ve způsobu analýzy duodenální šťávy.
 Nepřímé funkční testy
(obr. 6.3) jsou založeny na principu, kdy perorálně je podán chromogenní (nebo fluorogenní) substrát, který je štěpen pankreatickými enzymy (chymotrypsinem, lipázou). NBT-PABA test (Bentiromid, Roche; není již vyráběn) obsahoval substrát N-benzoyl-L-tyrosyl-4-aminobenzoovou kyselinu (Bz-Tyr-PAB), u nás byl vyráběn ALTAB test (Spofa-Gnost Pankenzan, Léčiva) se susbtrátem N-acetyl-L-tyrosyl-4-aminobenzoovou kyselinou (Ac-Tyr-PAB), který poskytoval lepší diskriminaci mezi souborem nemocných s insuficiencí pankreatu a kontrolním souborem. Fluorogenní variantou je preparát Pankreolauryl (substrátem je fluorescein-di-laurylester). Koncentrace chromogenu (fluorogenu) vyloučeného močí, resp. jeho koncentrace v séru je mírou aktivity enzymu v duodenu. Mezi nepřímé testy patří i stanovení chymotrypsinu nebo elastázy-1 ve stolici. V poslední době se objevují další nové funkční testy - dechové testy, kdy perorálně podaný substrát je značen izotopem uhlíku 13C (starší testy izotopem 14C). Mírou aktivity pankreatických enzymů je koncentrace 13C (nebo 14C) ve vydechovaném vzduchu.
Nepřímé funkční testy
(obr. 6.3) jsou založeny na principu, kdy perorálně je podán chromogenní (nebo fluorogenní) substrát, který je štěpen pankreatickými enzymy (chymotrypsinem, lipázou). NBT-PABA test (Bentiromid, Roche; není již vyráběn) obsahoval substrát N-benzoyl-L-tyrosyl-4-aminobenzoovou kyselinu (Bz-Tyr-PAB), u nás byl vyráběn ALTAB test (Spofa-Gnost Pankenzan, Léčiva) se susbtrátem N-acetyl-L-tyrosyl-4-aminobenzoovou kyselinou (Ac-Tyr-PAB), který poskytoval lepší diskriminaci mezi souborem nemocných s insuficiencí pankreatu a kontrolním souborem. Fluorogenní variantou je preparát Pankreolauryl (substrátem je fluorescein-di-laurylester). Koncentrace chromogenu (fluorogenu) vyloučeného močí, resp. jeho koncentrace v séru je mírou aktivity enzymu v duodenu. Mezi nepřímé testy patří i stanovení chymotrypsinu nebo elastázy-1 ve stolici. V poslední době se objevují další nové funkční testy - dechové testy, kdy perorálně podaný substrát je značen izotopem uhlíku 13C (starší testy izotopem 14C). Mírou aktivity pankreatických enzymů je koncentrace 13C (nebo 14C) ve vydechovaném vzduchu.
Mezi nepřímé funkční testy lze zařadit i stanovení aktivity chymotrypsinu nebo elastázy-1 ve vzorku stolice. Tato testy se provádějí bez standardní stimulace, není porovnávána bazální a stimulovaná sekrece. Testy jsou však ze všech dostupných metod nejjednodušší pro nemocného i laboratorní zpracování. Klinický přínos je však odpovídající vzhledem k uvedeným omezením test - tj. nestimulované testy neposkytují dostatečnou diferenciaci mezi normálním a patologickým stavem.
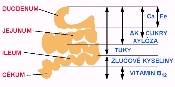 Funkční vyšetření tenkého střeva slouží především k diferenciální diagnostice malabsorpčního syndromu, k objasnění příčiny malabsorpce (primární, sekudární malabsorpční syndrom). Biochemické testy zahrnují zátěžové, toleranční testy s perorálním podáním D-xylózy nebo A-vitaminu, testy střevní permeability s podáním laktózy, manitolu, biochemické vyšetření vzorků sliznice odebrané enterobiopsií a testy sekreční funkce se značeným albuminem (51Cr-albuminový test). Variantou funkčních testů jsou i dechové testy s izotopově značenou (13C, 14C) xylózou, laktózou resp. dalšími substráty. K funčním testům může být použito i jiných látek např. železo a vitamin B12 (Schillingův test). Pro odběr vzorků po podání testované látky a při interpretaci je nutno zvažovat nejen dobu pasáže ale i rozdílnou lokalizaci v tenkém střevu (od duodena po terminální ileum), kde dochází ke vstřebávání testovaného substrátu
(obr. 6.4)
.
Funkční vyšetření tenkého střeva slouží především k diferenciální diagnostice malabsorpčního syndromu, k objasnění příčiny malabsorpce (primární, sekudární malabsorpční syndrom). Biochemické testy zahrnují zátěžové, toleranční testy s perorálním podáním D-xylózy nebo A-vitaminu, testy střevní permeability s podáním laktózy, manitolu, biochemické vyšetření vzorků sliznice odebrané enterobiopsií a testy sekreční funkce se značeným albuminem (51Cr-albuminový test). Variantou funkčních testů jsou i dechové testy s izotopově značenou (13C, 14C) xylózou, laktózou resp. dalšími substráty. K funčním testům může být použito i jiných látek např. železo a vitamin B12 (Schillingův test). Pro odběr vzorků po podání testované látky a při interpretaci je nutno zvažovat nejen dobu pasáže ale i rozdílnou lokalizaci v tenkém střevu (od duodena po terminální ileum), kde dochází ke vstřebávání testovaného substrátu
(obr. 6.4)
.
ß-karoten je retinoid, prekursor vitaminu A (z jedné molekuly ß-karotenu vznikají 2 molekuly A-vitaminu), jeho zdrojem je především ovoce a zelenina. A-vitamin i ß-karoten jsou rozpustné v tucích, jejich hladina v séru je proto závislá na trávení a vstřebávání tuků. V cirkulaci je ß-karotén vázán z 80% na LDL, 8% na HDL a z 12% na VLDL lipoproteiny. Ze sérových karotenoidů tvoří ß-karoten asi 25%. Z klinického hlediska je významný velmi krátký poločas ß-karotenu resp. jeho rychlá konverze na A-vitamin.
 A-vitamin je v tuku rozpustný vitamin, molekulové hmotnosti 286.44 existující ve dvou přirozených formách
(obr. 6.5) - retinol (A1) a 3-dehydroretinol (A2); prekursorem A-vitaminu je ß-karoten. A-vitamin (Axeroftol) je podán ve formě esteru rozpustného v tucích, který je hydrolyzován pankreatickými enzymy a v enterocytu pak dochází k jeho reesterifikaci nejčastěji s kyselinou palmitovou; v plazmě se váže na specifický lipoprotein (retinol vázající protein).
A-vitamin je v tuku rozpustný vitamin, molekulové hmotnosti 286.44 existující ve dvou přirozených formách
(obr. 6.5) - retinol (A1) a 3-dehydroretinol (A2); prekursorem A-vitaminu je ß-karoten. A-vitamin (Axeroftol) je podán ve formě esteru rozpustného v tucích, který je hydrolyzován pankreatickými enzymy a v enterocytu pak dochází k jeho reesterifikaci nejčastěji s kyselinou palmitovou; v plazmě se váže na specifický lipoprotein (retinol vázající protein).
Zátěžový test s D-xylózou (xylózový absorpční test) je indikován v diferenciální diagnostice malabsorpčního syndromu. D-xylóza je 5-uhlíkový monosacharid (pentóza), který je asi ze 60% pasivně absorpován v proximální části tenkého střeva (duodenojejunální) a z cirkulace je eliminován ledvinami. Clearance cca 87% je dána tubulární resorpcí D-xylózy. Stanovujeme hladinu v séru a v moči, nalačno a za 5 hodin po podání zátěže (pro stanovení odpadu močí je prováděn 5 hodinový sběr moče).
 Variantním uspořádáním funkčních testů jsou testy dechové. Po podání testovaného substrátu jsou odebírány vzorky vydechovaného vzduchu a je měřena koncentrace vodíku nebo CO2 podle, typu testu
(obr. 6.6). U H2 dechových testů je měřena koncentrace H2 plynovou chromatografií, u testů značených izotopem uhlíku 14C je nutné měření radioizotopové. Moderní dechové testy jsou proto založeny na izotopu 13C, který je stanovován ve vydechovaném vzduchu hmotnostní spektrometrií.
Variantním uspořádáním funkčních testů jsou testy dechové. Po podání testovaného substrátu jsou odebírány vzorky vydechovaného vzduchu a je měřena koncentrace vodíku nebo CO2 podle, typu testu
(obr. 6.6). U H2 dechových testů je měřena koncentrace H2 plynovou chromatografií, u testů značených izotopem uhlíku 14C je nutné měření radioizotopové. Moderní dechové testy jsou proto založeny na izotopu 13C, který je stanovován ve vydechovaném vzduchu hmotnostní spektrometrií.
Screeningové (vyhledávací) programy jsou zaměřeny na časnou diagnostiku onemocnění, které jinak zůstávají, v této časné fázi, nerozpoznány. Screeningové programy se provádějí u asymptomatických osob (bez příznaků onemocnění). U definovaných tzv. vysokorizikových skupin se jedná o programy dispensarizační. Pro tyto vyhledávácí programy se musí přesně definovat populace, která má být screeningem testována, interpretace použitých testů a způsob dalšího vyšetření resp. léčby při pozitivním výsledku testu. Velmi detailně je propracován screening okultního krvácení ve vyhledávání kolorektálních nádorů, kde je stanoven interval screeningu, věkové rozmezí i následný koloskopický vyšetřovací program při pozitivním průkazu okultního krvácení. Screening Helicobacterové infekce pomocí serologických nebo dechových testů je ve fázi vývoje, obdobně i screening glutenové enteropatie (céliakální sprue) detekcí protilátek ke gliadinu resp. endomysiálních protilátek.
Zásadní otázkou pro použití testů detekce okultního krvácení je indikace tohoto stanovení. Screening, jako úvodní metoda depistážních programů pro vyhledávání kolorektálních nádorů u asymptomatických jedinců, je nutno provádět testem, který splňuje stanovená kriteria. Depistážní programy jsou založeny na opakovaném stanovení v pravidelných intervalech jednoho až dvou let. V případě pozitivního výsledku testu musí následovat cílené gastroenterologické (endoskopické) vyšetření k objasnění příčiny pozitivity testu. Z těchto důvodů nelze pro screening použít testů imunochemických, které mají výrazně vyšší citlivost a poskytují 4 - 7% falešnou pozitivitu. Haemoccult testem jsme ve studii našeho pracoviště prokázali u > 95 tisíc asymptomatických osob pozitivitu 2.8%, falešná pozitivita testovaná při srovnání s imunochemickými testy byla nulová. Imunochemické testy jsou vhodné pro detekci (vyloučení) krvácení u symptomatických nemocných, kde test okultního krvácení je jedním z řady vyšetřovacích postupů.
Bakterie Helicobacter pylori (dříve Campylobacter) je známa řadu desetiletí, její klinický význam však vzrostl teprve v roce 1982, kdy Warren a Marshal popsali přímý vztah k epithelu žaludeční sliznice u nemocných s gastritidou nebo žaludečními vředy. Pro diagnostiku infekce Helicobacterem pylori lze použít mikrobiologický kultivační postup, mikroskopický průkaz bakterie v bioptickém materiálu nebo jednoduchý ureázový test. Kultivační test vykazuje nejvyšší sensitivitu i specificitu, nevýhodou je však značná citlivost bakterie Helicobacter pylori ke kyslíku, což vyžaduje specielní podmínky odběru a transportu. Rychlý ureázový (CLO) test je založen na intensivní aktivitě ureázy (povrchový marker bakterie Helicobacter pylori). Mezi nepřímé testy patří jednak serologický průkaz protilátek k Helicobacter pylori v séru, jednak dechový test založený opět na aktivitě ureázy, kdy je stanovován 14C nebo 13C ve vydechovaném vzduchu po rozštěpení izotopově značené močoviny jako substrátu pro ureázu.
 Céliakální sprue (CS, glutenová enteropatie) je onemocněním, které se projevuje intolerancí k pšeničnému gliadinu (lepku) resp. dalším zásobním proteinům (prolaminům) příbuzných obilovin, ječmene, žita a ovsa. Glutenová enteropatie je geneticky podmíněným autoimunitním onemocněním. Současné poznatky přinášejí doklady o heterogenitě klinické prezentace tohoto onemocnění.
Céliakální sprue (CS, glutenová enteropatie) je onemocněním, které se projevuje intolerancí k pšeničnému gliadinu (lepku) resp. dalším zásobním proteinům (prolaminům) příbuzných obilovin, ječmene, žita a ovsa. Glutenová enteropatie je geneticky podmíněným autoimunitním onemocněním. Současné poznatky přinášejí doklady o heterogenitě klinické prezentace tohoto onemocnění.
Burtis C.A., Ashwood E.R. editors: Tietz Textbook of Clinical Chemistry, W.B.Saunders Comp.1994
Frič P.: Klinickobiochemická diagnostika chorob trávicího ústrojí. Biochem.Clin.Bohemoslov. 1985, 14:209
Frič P.: Pokroky v diagnostice chorob exokrinního pankreatu. Pokroky v gastroenterologii 2, Mařatka Z. editor, Avicenum, zdrav. nakladatelství Praha 1983
Friedman R.B., Young, D.S.: Effects of Disease on Clinical Laboratory Tests, Lexi-Comp.Inc. AACC Press 1989
Hořejší J. a spol.: Základy klinické biochemie ve vnitřním lékařství, Avicenum, zdrav. nakladatelství Praha 1989
Howanitz J.H., Howanitz P.J. editors: Laboratory Medicine, Test Selection and Interpretation, Churchil Livingstone 1991
Jacobs D.S. editor et al.: Laboratory Test Handbook. Lexi-Comp.Inc. Williams & Wilkins 1990
Masopust J.: Požadování a hodnocení biochemických vyšetření. Zdravotnické aktuality 90/216, Avicenum, zdrav. nakladatelství Praha 1990
Musil J.: Molekulové základy klinické biochemie, Grada-Avicenum, Praha 1994
Poruchy metabolismu lipidů
Autor kapitoly: doc.MUDr.Petr Schneiderka CSc., Ústav klinické biochemie VFN a 1.LF UK Praha
Do heterogenní skupiny "lipidů" nebo "lipoidních látek" v krvi se tradičně řadí nejen triacylglyceroly (TG), fosfolipidy (PL), sfingolipidy a glykosfingolipidy, ale také neesterifikované mastné kyseliny (NEMK, nazývané též volné mastné kyseliny, FFA) a nověji též eikosanoidy (prostaglandiny, tromboxany a prostacykliny). S ohledem na lipofilní povahu se k nim obvykle řadí i cholesterol (CH) a jeho estery (CHE). Mohly by sem patřit také steroidní hormony a vitamíny rozpustné v tucích. Jejich fyziologické funkce i metabolismus ve zdraví a v nemoci jsou však vesměs natolik odlišné od funkcí a metabolismu ostatních lipidů, že budou probírány zvlášť.
Základem struktury neutrálních lipidů a fosfolipidů je glycerol. U triacylglycerolů (neutrálních lipidů) jsou jeho tři alkoholové skupiny esterifikovány vyššími mastnými kyselinami. Z nasycených mastných kyselin se může jednat o 16-uhlíkovou kyselinu palmitovou, 18-uhlíkovou kyselinu stearovou, nebo 20-uhlíkovou kyselinu arachovou, z nenasycených potom o 16-uhlíkovou palmitolejovou (s jednou dvojnou vazbou), 18-uhlíkové olejovou, linolovou a linolenovou (s jednou, dvěma, resp. třemi dvojnými vazbami) a o 20-uhlíkovou kyselinu arachidonovou se čtyřmi dvojnými vazbami. Hlavními a nejčastějšími mastnými kyselinami v přirozených lipidech savců jsou kyseliny palmitová, stearová a olejová.
| chylomikrony | LDL | IDL | VLDL | HDL | |
|---|---|---|---|---|---|
| Agarózová ELFO (mobilita) | na startu | beta | široké beta | pre-beta | alfa |
| Hustota (g/l) | < 940 | 1063 | 1019 | 1006 | > 1210 |
| Průměrná velikost (nm) | 700-12 000 | 220 | 315 | 280-750 | 70-1100 |
| Obsah cholesterolu (%) | 3 | 59 | 41 | 17 | 38-43 |
| Obsah triacylglycerolů (%) | 88 | 7 | 32 | 56 | 6-7 |
| Obsah proteinů (%) | 1-2 | 25 | 18 | 10 | 40-55 |
Základní funkci apoproteinů lze označit jako strukturální, neboť svou přítomností na povrchu částice do značné míry určují fyzikální a chemické vlastnosti "svého" typu lipoproteinu a dávají mu druhovou imunologickou identitu. S tím souvisí také jejich úloha jako ligandu pro vazbu lipoproteinu s příslušným receptorem na buněčné membráně. Neméně důležitá je však i funkce koenzymů nebo aktivátorů, které vykazují některé z nich vůči lecithin-cholesterolacyltransferáze (LCAT) nebo vůči lipoproteinové lipáze (LL). Ojediněle mají apoproteiny i další účinky a u části z nich jsou naopak funkce dosud neznámé.
1.2 Složené lipidy
Mezi nejvýznamnější složené lipidy řadíme sfingomyeliny a glykolipidy, jejichž největší část tvoří glykosfingolipidy. Základem struktury těchto složených lipidů je aminoalkohol sfingosin (2-amino-4-oktadecen-1,3-diol). Ve sfingomyelinech je sfingosin esterifikován fosfocholinem a obsahuje amidově vázanou vyšší mastnou kyselinu. Sfingomyelin je přítomen v myelinu v axonech nervových buněk a je součástí buněčných membrán v ostatních tkáních. Bazální strukturou glykosfingolipidů je ceramid, skládající se ze sfingosinu s amidově vázanou mastnou kyselinou. Na hydroxylovou skupinu v poloze 1 se může vázat sacharid, zejména Glc nebo Gal. Výsledná struktura se nazývá cerebrosid. Ty z nich, které osahují galaktózu, jsou součástí membrán nervových buněk a ty, které obsahují glukózu, jsou v buněčných membránách ostatních tkání. Gangliosidy mají na tomto místě oligosacharidový řetěz, který často obsahuje jeden nebo více zbytků N-acetylneuraminové kyseliny (NeuNAc, nazývané též sialová, podle toho se pak hovoří o sialylaci gangliosidů) a N-acetylgalaktosamin. Podle počtu NeuNAc se rozeznávají tetrasialo-, disialo-, monosialo- a asialogangliosidy (GQ, GD, GM a GA). Při katabolismu gangliosidů a neutrálních glykosfingolipidů odštěpuje neuraminidáza jeden nebo více zbytků NeuNAc, beta-galaktosidáza hydrolyzuje vazbu s galaktózou a hexosaminidáza uvolňuje vázaný aminosacharid. Gangliosidy tvoří asi 6% membránových lipidů v šedé hmotě mozkové a menším podílem jsou přítomny i v membránách dalších buněk.
| Apoprotein | Hlavní funkce |
|---|---|
| A-I | Strukturální pro HDL, ligand pro vazbu HDL, koenzym LCAT. "Antiaterogenní". |
| A-II | Strukturální pro HDL, ligand pro vazbu HDL, modulátor aktivity LL a HTGL. |
| A-IV | Ligand pro vazbu HDL, aktivátor LCAT. |
| Apo (a) | Strukturální pro lipoprotein Lp(a), snižuje fibrinolýzu. Vysoce atherogenní. |
| B-48 | Strukturální pro chylomikrony. |
| B-100 | Strukturální pro VLDL, LDL a IDL, ligand pro LDL-receptor. Atherogenní. |
| C-I | Aktivátor LL a LCAT. |
| C-II | Aktivátor LL a LCAT. |
| C-III | Inhibitor LL, modulátor vazby lipoproteinů bohatých na TG na "protein podobný LDL-rec.", LRP |
| D | Neznámá. |
| E | Ligand pro LDL-receptor a pro LRP. Atherogenní. |
| F | Neznámá. |
| H | Neznámá. |
| J | Ochrana membrán ? |
2. Metabolismus lipoproteinů
Estery cholesterolu totiž slouží v hepatocytu k syntéze žlučových kyselin, obnově membrán a zejména k vlastní jaterní produkci VLDL. Zde vytvořené částice VLDL ("nascent VLDL") jsou bohaté na triacylglyceroly, pocházející z jaterní syntézy, nebo vychytané z cirkulujících lipoproteinů. Velikost nabídky triacylglycerolů rozhoduje o velikosti VLDL. Ty dále obsahují fosfolipidy a apoprotein B-100. Malá množství apo C-I, C-II, C-III a apo E přítomná v nascentním VLDL, doplňuje tato částice později dalšími, získanými od HDL. Úkolem VLDL je, podobně jako u chylomikronů, také poskytovat volné mastné kyseliny uvolněné intenzívní intravaskulární lipolýzou, kterou katalyzuje lipoproteinová lipáza s podporou koenzymů apo C-I a apo C-II. Jádro VLDL se postupně zmenšuje a v závěru se částice zbavuje i apoproteinů C, takže zůstává opět zbytek relativně bohatý na apo E a na estery cholesterolu. Označuje se jako IDL (nebo VLDL remnant) a díky obsahu apo E může být zachycen jak LDL receptorem, tak receptorem pro chylomikronové remnanty. V hepatocytu je IDL za normálních okolností z poloviny kompletně hydrolyzován a z druhé poloviny se tvoří částice LDL.
Lipoprotein LDL je hlavním nositelem cholesterolu v plazmě a fyziologickou úlohou LDL je tedy zásobování buněk cholesterolem. Obsahuje dále pouze jeden apoprotein, a to apo B-100, který je ligandem pro LDL receptory hepatocytu i buněk periferních tkání. Buněčné receptory pro LDL, jejichž struktura i funkce je dobře známa (J.Goldstein, M.Brown, Nobelova cena r.1985), rozeznávají apoprotein B-100 na částicích LDL a apo E na částicích HDL a IDL. Zdá se, že neváží VLDL ani IDL pomocí jejich apoproteinů B-100.
Endogenní a exogenní metabolickou cestu propojují přeměny lipoproteinu HDL. Ten se může tvořit jak ve střevě, tak v játrech. Nově vzniklé (nascentní) HDL mají tvar disku a obsahují hlavně fosfolipidy a apoproteiny A-I a A-II. Skladba HDL olivňuje jejich hustotu: nejvyšší je u nascentních, které tak vytvářejí podtřídu HDL3. Záhy se však doplňuje jejich jádro o estery cholesterolu a tvar se mění na kulovitý. Přenosem z jiných lipoproteinů se povrch HDL obohacuje o volný cholesterol, fosfolipidy a apoproteiny C-II, C-III a E, čímž vzniká podtřída HDL2. Teprve ta je schopna být donorem esterů cholesterolu a apoproteinů C a E pro chylomikrony a VLDL, jak je uvedeno výše. Přenos esterů cholesterolu je katalyzován speciální přenosovou bílkovinou, tzv. cholesterol ester transfer proteinem, CETP. Tato bílkovina má spolu s HDL základní funkci při reverzním transportu cholesterolu, tj. při přenosu cholesterolu uvolněného na periferii (např. rozpadem buněk) do jater, kde je metabolizován a/nebo vyloučen žlučí.
3. Dyslipoproteinémie
3.1.1 Poruchy postihující alfa-lipoproteiny
3.1.1.1. Deficit apo A-I byl popsán ve třech typech, z nichž všechny vedou k časné ischemické chorobě srdeční a k zákalu rohovky. Pouze u jednoho typu byla identifikována příčina spočívající v mutaci genů pro apo A-I a apo C-III.
3.1.1.2. Abnormální apoproteiny A-I. V populaci bylo identifikováno na 11 strukturálních variant apo A-I. Nejznámější je apo A-IMiláno, při níž je nízká hladina frakce HDL2, která ale není spojena s vyšší incidencí aterosklerózy.
3.1.1.3. Tangierská choroba je autosomálně recesívní onemocnění spojené s ukládáním esterů cholesterolu do makrofágů a projevující se splenomegalií, někdy i s hepatomegalií, trombocytopenií a retikulocytózou. Současně bývají přítomny neurologické poruchy. Laboratorně se stanoví extrémně nízké až nulové koncentrace HDL a apoproteinů A-I a A-II. Celkový cholesterol je nízký a triacylglyceroly jsou v normě nebo mírně zvýšené.
3.1.1.4. Vrozený deficit LCAT je rovněž autosomálně recesívní onemocnění. Nedostatek lecithin-cholesterolacyltransferázy působí nedostatek esterů cholesterolu a v lipoproteinech se kumuluje neesterifikovaný cholesterol. To mění jejich složení, tvar i způsob přeměny. Choroba se projevuje proteinurií, která se může prohlubovat až k renálnímu selhání, hemolytickou anémií a časnými příznaky aterosklerózy. V krvi se prokazuje hypertriacylglycerolémie.
3.1.1.5. Nemoc rybího oka získala své pojmenování podle zákalu pacientovy rohovky. Je provázena nízkou koncentrací HDL (až 10% normy), zvýšenou koncentrací VLDL a poruchou esterifikace cholesterolu v LDL, které mají vyšší obsah triacylglycerolů.
3.1.1.6. Porucha jaterní triacylglycerolové lipázy je spojena s abnormálně velkými částicemi HDL, které obsahují více triacylglycerolů. VLDL mají sníženou pohyblivost, takže se objevují v oblasti beta.
3.1.1.7. Defekt přenosové bílkoviny pro estery cholesterolu (cholesterol ester transfer protein, CETP) je vzácné onemocnění, které vede k akumulaci HDL bohatých na estery cholesterolu v plazmě. Není spojeno s projevy aterosklerózy.
3.1.2 Poruchy postihující beta-lipoproteiny
3.1.2.1. Abetalipoproteinémie je vzácné autosomálně recesívní onemocnění charakteristické úplnou absencí apoproteinu B a tím i lipoproteinů, které jej obsahují (chylomikrony, LDL a VLDL). V mnoha případech vázne sekrece jaterních VLDL spojená se steatózou hepatocytu. Podobně vázne odsun triacylglycerolů z enterocytu. Pacienti trpí malabsorpcí tuků a poruchami spojenými s nedostatkem liposolubilních vitaminů (avitaminóza E - ataxie). Poruchy ve složení lipidů erytrocytární membrány vedou k akantocytóze.
3.1.2.2. Familiární hypobetalipoproteinémie je u homozygotů klinicky nerozpoznatelná od předchozí. U heterozygotů se naleznou pouze asi na polovinu snížené hladiny LDL.
3.1.2.3. Familiární kombinovaná hyperlipidémie a hyperbetalipoproteinémie jsou překrývající se poruchy, jejichž názvy jsou odvozené od (obvykle současného) zvýšení plazmatických triacylglycerolů i cholesterolu. Přesněji se nalézají zvýšené LDL nebo VLDL anebo oba současně. U obou je přítomna nadprodukce apoproteinu B-100 z nejasných příčín. Jde o autosomálně dominantní onemocnění, které se manifestuje až v dospělosti a postihuje přibližně 1 % populace. Nemocní jsou obézní a rozvíjí se u nich ateroskleróza koronárních cév.
3.1.2.4. Familiární hypertriacylglycerolémie se obvykle manifestuje také až v dospělosti a dědí se autosomálně dominantně. Je charakterizována zvýšením VLDL a tedy i mírným nebo větším zvýšením koncentrace triacylglycerolů, které je někdy doprovázeno i přítomností chylomikronů nalačno. Částice VLDL jsou větší než obvykle, mají vyšší triacylglycerolovou nálož a relativně méně apoproteinu B, což poukazuje na nadprodukci triacylglycerolů v játrech. Uvažuje se o možné souvislosti tohoto syndromu s inzulínovou rezistencí.
3.1.2.5. Choroba z retence chylomikronů je typická sníženou produkcí chylomikronů ve střevě. Je to způsobeno defektem v zabudování apoproteinu B-48 do chylomikronu ( v enterocytu), patrně na podkladě atypické struktury (glykace?) tohoto apoproteinu. Postižení trpí malabsorpcí a symptomy nedostatku vitamínů rozpustných v tucích.
3..2.6. Abetalipoproteinémie s normotriacylglycerolémií se projevuje kompletní absencí LDL, ale po tukové dietě se normálně tvoří chylomikrony. Závada spočívá v tvorbě abnormálního apoproteinu B-100. Porucha byla dosud popsána pouze jednou.
3.1.2.7. Vrozené defekty apo B-100 jsou asi častější než se dosud předpokládalo. Má se zato, že velká část pacientů se šlachovými xanthomy a s vysokou hladinou LDL, kde se dříve předpokládala porucha LDL receptoru, má velmi pravděpodobně porušenou strukturu apoproteinu B-100.
3.1.2.8. Hypobetalipoproteinémie spojené s modifikovanými apo B se týká abnormálních apo B (B-25, B-28, B-37, B-39, B-40, B-46), u nichž je pozměněna struktura polypeptidového řetězce. To vede k nižší stabilitě lipoproteinů, do nichž jsou zabudovány a k nízké hladině plazmatických lipidů.
3.1.2.9. Chylomikronový syndrom projevující se eruptívními xanthomy, hepatosplenomegalií a sklonem k akutní pankreatitidě, je společný pro deficit lipoproteinové lipázy, LPL (a vrozený výskyt inhibitoru LPL) a pro deficit apoproteinu C-II. Deficit LPL je vzácné autosomálně recesívní onemocnění, které se manifestuje v dětství nebo v graviditě. Mohou se nalézt afunkční zbytky imunoreaktívní LPL a u heterozygotů třeba jen snížené aktivity LPL. Ojediněle byl popsán vrozený výskyt inhibitoru LPL. Projevy deficitu apoproteinu C-II přicházejí až v dospělosti a jsou mírnější než předchozí, což patrně souvisí s pouhou funkcí apo C-II jako koenzymu LPL.
3.1.2.10. Hyperlipoproteinémie z remnantů (choroba široké beta frakce, typ III dle WHO) vzniká při kumulaci zbytků po přeměně VLDL. Vede ke zvýšení cholesterolu v této frakci a na elektroforeogramu se místo oddělených pruhů pre-beta a beta lipoproteinů objeví jeden široký pás. Molekulárním podkladem je výskyt odlišných isoforem apoproteinu E (u homozygotů E2/E2 a u heterozygotů E2/E3), které neumožňují další přeměnu VLDL na LDL nebo zpracování v játrech. Choroba se manifestuje převážně až v dospělém věku, je spojena se zvýšeným rizikem aterosklerózy periferních i věnčitých tepen a postižení mají charakteristické ploché, tuberózní nebo eruptívní xanthomy.
3.1.2.11. Familiární hypercholesterolémie je nejčastější a nejobávanější z vrozených poruch metabolismu lipidů. Přesněji řečeno, frekvencí 1:500 se vyskytuje heterozygotní forma onemocnění, zatímco homozygotní forma je mnohem vzácnější. Hypercholesterolémie je dána zvýšením cirkulujících LDL, jejich zvýšenou produkcí i sníženým vychytáváním buňkami, na podkladě poruchy LDL receptorů. Tyto poruchy jsou způsobeny 4 možnými typy mutací genu pro LDL receptor. Choroba se u 3/4 postižených heterozygotů projevuje šlachovými xanthomy a u všech především rychlým vývojem aterosklerózy s časnými kardiovaskulárními projevy. U homozygotů se tyto změny vyskytují již v prvním deceniu.
3.1.2.12. Polygenní hypercholesterolémie je onemocnění, s nímž se velmi často setkáváme ve všech civilizovaných zemích. Název naznačuje kombinované genetické příčiny, které přesně neznáme, které však spolu s faktory vnějšího prostředí a životního stylu jedince vyvolají hypercholesterolémii s následky stejnými jako u primární hypercholesterolémie. Frekvence onemocnění se výrazně liší v různých populačních skupinách, u nichž byly prokázány mj. zřetelné nutriční závislosti (celkový obsah cholesterolu a TG v potravě, poměr nasycených a nenasycených MK, atd.). Faktory vnějšího prostředí jsou proto předmětem rozsáhlých epidemiologických studií.
3.2 Sekundární hyperlipoproteinémie
Mezi nejčastější sekundární hyperlipidémie patří diabetická hypertriacylglycerolémie. Je typická pro inzulin dependentní i pro non-inzulin dependentní diabetes mellitus (DM). Příčina spočívá ve známé skutečnosti, že inzulin na jedné straně aktivuje LPL a usnadňuje tak zpracování lipoproteinů bohatých na triacylglyceroly (TG), na druhé straně ale inhibuje hormon-senzitívní lipázu tukové tkáně a tím zabraňuje dalšímu uvolňování (mobilizaci) MK. Při nedostatku inzulinu tedy vázne zpracování lipoproteinů s vysokým obsahem TG, tj. zejména chylomikronů a VLDL, a současně se zvyšuje hladina cirkulujících MK a tím i jaterní syntéza TG.
Při hypotyreóze je poškozena činnost buněčných receptorů pro LDL a tím i clearance LDL a IDL. Bývá také snížena aktivita LPL. Výsledkem je hyperbetalipoproteinémie a hypercholesterolémie.
U nefrotického syndromu se zvyšuje jaterní syntéza všech bílkovin, mezi nimi také apoproteinu B-100. Zvyšuje se tedy koncentrace LDL a zdá se, že velikost tohoto zvýšení bývá úměrná velikosti ztrát albuminu. Kromě toho vzrůstají VLDL pro snížené odbourávání a někdy klesají HDL tím, že se ztrácejí močí.
Velmi důležitá je znalost sekundárních lékových hyperlipoproteinémií. Objevují se při léčbě tak častými léčivy, jako jsou antihypertenzíva ze skupiny beta-blokátorů a thiazidových antidiuretik, hormonální kontraceptiva, estrogeny, antiepileptika apod.
Do enterocytů tenkého střeva se z lipoidních látek uvolněných trávením resorbuje volný cholesterol, mono- a diacylglyceroly a volné mastné kyseliny. Tato cesta se někdy označuje za exogenní (střevo - cirkulace - játra). Následuje reesterifikace cholesterolu a reesterifikace mono- a diacylglycerolů mastnými kyselinami většími než C14. Tyto děje probíhají v enterocytu a jejich produkty vytvářejí jádro chylomikronové částice. Endogenní triacylglyceroly našeho organismu jsou za normálních okolností esterifikovány v poloze C1 glycerolu palmitovou kyselinou, na C2 stearovou nebo linolovou kyselinou a na C3 olejovou kyselinou. Estery cholesterolu v plazmě obsahují linolovou a linolenovou kyselinu, zatímco buněčné estery cholesterolu obsahují více olejové a palmitolejové kyselin. Enterocyt syntézuje současně apoproteiny apo A-I, A-II, A-IV a B-48, které spolu s fosfolipidy a s menším podílem volného cholesterolu pokrývají povrch chylomikronu. Funkčně nejdůležitějším a pro chylomikron typickým apoproteinem je apo B-48. Přesto, že na povrchu každého chylomikronu je ho jen jedna molekula, rozhoduje o sekreci chylomikronu z enterocytu do lymfatického řečiště a zůstává v chylomikronu vázán po
celou dobu jeho životnosti až do okamžiku, kdy je jako chylomikronový zbytek, "remnant", resorbován jaterním hepatocytem. Na této cestě získává chylomikron od HDL apoproteiny C-II, C-III a apo E (všechny syntézované hepatocytem), dále fosfolipidy a cholesterol. Zisk apo C-II umožňuje interakci mezi triacylglyceroly jádra chylomikronu a lipoproteinovou lipázou vázanou na povrchu cévního endothelu, zvláště v tukové a svalové tkáni. Tím se uvolňují mastné kyseliny pro potřeby tkáňového metabolismu a jádro chylomikronu se zvolna zmenšuje. Také jeho povrchové součásti, apo C-II, C-III, fosfolipidy a volný cholesterol, se předávají zpět částici HDL a z chylomikronu zbývá "remnant", který je bohatý na apo E a estery cholesterolu, a který je nakonec pohlcen hepatocytem. Mechanismus zachycení chylomikronového remnantu hepatocytem spočívá ve vazbě remnantu, resp. jeho apoproteinu E, na apo E receptory hepatocytu. Tím končí exogenní metabolická cesta a začíná cesta endogenní (játra - cirkulace - periferní tkáně).
3.1 Primární dyslipoproteinémie
Primární dyslipoproteinémie jsou vrozené poruchy metabolismu lipoproteinů spojené s vyššími, nižšími nebo i normálními koncentracemi lipidů a s výskytem lipoproteinů abnormálního složení nebo s neobvyklou distribucí normálních lipoproteinů.
Ačkoliv je patogeneze známa jen u některých z nich, je možné určité dílčí systematické třídění na:
- poruchy syntézy a sekrece beta-lipoproteinů
(abetalipoproteinémie, vrozená hypobetalipoproteinémie, familiární kombinovaná hyperlipidémie, familiární hypertriacylglycerolémie)
- výskyt abnormálního apoproteinu B
(abetaliproteinémie s normotriacylglycerolémií, hypobetalipoproteinémie s modifikovanými apoproteiny B, familiární defekt apo B-100, choroba z retence chylomikronů)
- poruchy v přeměně beta lipoproteinů
(chylomikronový syndrom, hyperlipoproteinémie z remnantů, familiární hypercholesterolémie)
- a na běžnou primární polygenní hypercholesterolémii.
Druhotné nebo "získané" dyslipoproteinémie jsou výsledkem a průvodním jevem jiného onemocnění, nebo také důsledkem určitého typu léčby. Hypolipidémie se nalézají při hypertyreóze, při malabsorpci, při jaterním selhání a u některých malignit. Podstatně častější a svými následky i klinicky závažnější jsou druhotné hyperlipidémie (tab. 7.3). Situace může být komplikována tím, že v pozadí sekundárních poruch existuje též primární (vrozená) dyslipoproteinémie.
| HYPERCHOLESTEROLÉMIE | HYPERTRIACYLGLYCEROLÉMIE |
| Hypotyreóza | Diabetes mellitus (inzulin depend. i non-inzulin depend.) |
| Nefrotický syndrom (mírná forma, S-albumin nad 20 g/l, proteinurie pod 10 g/24h) | Chronické renální selhání |
| Cholestáza (lipoprotein X !) | Hypotyreóza |
| Abnorm. imunoglobuliny | Obezita |
| Léčiva: cyklosporin, antiepileptika | Alkoholismus |
| Abnorm. imunoglobuliny | |
| Léčiva: estrogeny, kortikoidy, retinoidy, beta-blokátory | |
| SMÍŠENÁ HYPERLIPIDÉMIE | |
| Hypotyreóza | |
| Nefrotický syndrom (těžká forma, S-albumin pod 20 g/l, proteinurie nad 10 g/24h) | |
| Abnormální imunoglobuliny | |
| Léčiva: thiazidová diuretika | |
Sekundární hyperlipoproteinémie mohou mít samozřejmě stejné následky jako primární. Morbidita i mortalita záleží pouze na velikosti poruchy a době jejího trvání, event. na přítomnosti dalších rizikových faktorů. Tak např. dlouhodobým následkem vysoké chylomikronémie je sklon k akutní pankreatitidě a k rozvoji eruptívní xanthomatózy, podobně jako u chylomikronového syndromu. Sekundární kožní lipidová depozita se mohou objevit spolu s abnormálními lipoproteiny, jako je lipoprotein X při cholestáze, nebo při vazbě imunoglobulinů na lipoproteiny či jejich receptory, jako je tomu u mnohočetného myelomu. To platí také o aterosklerotických změnách cévních stěn při dlouhotrvající hypercholesterolémii a navíc v některých případech, např. při diabetu, postupují mnohem rychleji patrně díky vyšší glykaci apoproteinů.
3.3 Lipidy a ateroskleróza
Ateroskleróza bývá charakterizována jako "různorodá kombinace změn arteriální intimy, která ústí v místní akumulaci lipidů, dalších součástí krve a fibrózní tkáně, provázená změnami v médii cévní stěny".
Ve vztahu lipoidních látek k ateroskleróze se hovoří o tzv. lipidové triádě: vysoké LDL, nízké HDL a hypertriacylglycerolémie. Jak bylo výše zmíněno, vysoká koncentrace triacylglycerolů samotných je spíše rizikovým faktorem nekrotizující hemoragické pankreatitidy. Dlouho přetrvávající chylomikronémie vedou k hepatomegalii, ukládání lipidů ve tkáních a ke stavům spojeným se zvýšenou krevní koagulací. Byla popsána významná závislost výskytu ICHS na spotřebě lipidů obsahujících nasycené mastné kyseliny ("nasycených tuků").
Přímý vztah k rozvoji aterosklerózy a k jejím důsledkům a komplikacím má cholesterol. Od přelomu 40. a 50. let do dneška byly v různých státech provedeny možná stovky epidemiologických, dietních a farmakologických studií, které to potvrzují. Riziko onemocnění ICHS i mortalita na ICHS exponenciálně narůstají s rostoucí hladinou celkového cholesterolu v séru. Např. jedinec s koncentrací 6.5 mmol/L má dvojnásobné riziko rozvoje ICHS oproti osobě s koncentrací 5.2 mmol/L. Byla popsána přímá úměrnost mezi ICHS a koncentracemi LDL, které nesou vysoký podíl cholesterolu a také koncentracemi VLDL, z nichž vznikají remnanty vážící se rovněž na LDL receptory.
Etiopatogeneze aterosklerózy je multifaktoriální a dosud ne zcela objasněná. Vznik onemocnění se vysvětluje kombinací dvou hypotéz: hypotézou lipidovou a hypotézou poškození cévního endotelu. Při vysoké koncentraci proniká LDL zvýšenou měrou do endotelových buněk cévní stěny, do makrofágů a do buněk hladké svaloviny, kde se hromadí. LDL může být příčinou poškození endotelové buňky, podobně jako mechanické, toxické, virové, oxidační a další vlivy (např. homocystein). Na porušeném endotelu se hromadí trombocyty, z nichž se uvolňuje růstový faktor PDGF (platelets derived growth factor) podporující proliferaci buněk hladké svaloviny cévní stěny. Chemotaktické faktory pocházející z porušeného endotelu atrahují monocyty měnící se na makrofágy. Makrofágy a svalové buňky s vysokou lipoidní náloží (estery cholesterolu) se přeměňují v buňky pěnové.
Makroskopicky se změny v cévní stěně projevují nejprve nahromaděním těchto pěnových buněk v intimě velkých cév. Buňky jsou intaktní i rozpadlé, obklopené uvolněnými lipidy, což se označuje jako tukový proužek. Progrese spočívá v dalším hromadění těchto buněk, v postižení médie cévní stěny, přibývání volně uložených lipidů případně i s krystaly cholesterolu a dále v prorůstání kolagenních fibril. Ložisko, které může uvnitř nekrotizovat a postupně i kalcifikovat, se nazývá fibrózní plát. Prominuje do nitra cévy a menší z nich může až uzavřít. Velmi vážným nebezpečím je vznik komplikované léze. K tomu dochází ulcerací vnitřního povrchu plátu s vytvořením trombu (trombóza) a jeho možným odplavením do jiných míst cévního řečiště, které uzavře (embolizace). Jinou komplikací je takové oslabení stěny (velké cévy) fibrózním plátem, že dále už neodolá tlaku krve a praskne (ruptura).
Pod pojmem multifaktoriálnosti vzniku aterosklerózy a rozvoje jejích komplikací se rozumí souhra dalších rizikových faktorů. Dělí se na rizikové faktory neovlivnitelné a ovlivnitelné. K neovlivnitelným náleží příslušnost k mužskému pohlaví, věk u mužů nad 45 let, u žen nad 55 let a dále dědičné dyslipoproteinémie. Ovlivnitelné jsou kouření, obezita, životní styl a farmakoterapeuticky zvládnutelné choroby (diabetes mellitus, hypertenze).
Bylo prokázáno, že postup aterosklerózy může být výrazně zpomalen. Za určitých podmínek se dokonce daří zmenšovat již vytvořené menší nekalcifikované fibrózní pláty. Napomáhají k tomu režimová a dietní opatření spojená s vhodnou farmakoterapií hyperlipoproteinémií.
4. Lipidózy a poruchy metabolismu mastných kyselin
7.4.1.1. GM2- gangliosidóza (Tay-Sachsova nemoc, infantilní familiární amaurotická idiocie). Nemoc je způsobena absencí lysosomální hexosaminidázy A a někdy také B. V CNS a ve vnitřních orgánech se hromadí nejen GM2, ale také asialo-GM2, tetra-, tri- a dihexosylceramidy. Důsledkem v CNS je tuková degenerace a následná redukce počtu gangliových buněk. Onemocnění se dědí autosomálně recesívně a postihuje především židovské etnikum ze severovýchodní Evropy. Klinicky se projevuje od 4 až 6 měsíců života zastavením psychomotorického vývoje, křečemi, hypotonií a slepotou, existují však i formy protrahovanější.
7.4.1.2. GM1-gangliosidóza je mnohem vzácnější autosomálně recesívně přenášené onemocnění, které nemá vazbu na žádnou populační skupinu. Porucha spočívá v nedostatku gangliosid-ß-galaktosidázy a následném hromadění monosialogangliosidů a asialogangliosidů. Existuje forma novorozenecká (generalizovaná) a juvenilní. Novorozenecká forma se projevuje somatickými deformacemi, neurologickými poruchami, hluchotou a slepotou. Juvenilní forma začíná až okolo 1 roku a projevuje se hypotonií, křečemi a dekortikační rigiditou.
7.4.1.3. Cerebrosidóza (Gaucherova choroba, glukosylceramidová lipidóza). Toto vzácné onemocnění je způsobeno poruchou kyselé ceramid-ß-glukosidázy, která vede k hromadění glukosylceramidu v histiocytech (vznikají tzv. Gaucherovy buňky). Důsledkem je neuronální degenerace, hepatosplenomegalie, poruchy krvetvorné kostní dřeně a deformity kostí. Dostavují se psychomotorické poruchy, rigidita a v polovině případů se rozvíjí epilepsie.
7.4.1.4. Sfingomyelinóza (Niemannova-Pickova choroba, sfingomyelinová lipidóza). Jde o heterogenní skupinu, která se dnes nazývá "komplex Niemannova-Pickova onemocnění". První skupina má společnou deficienci kyselé sfingomyelinázy. Byla popsána ve dvou formách, z nichž ta malignější postihuje nervový systém a ta chronická je spojena s hromaděním sfingomyelinu ve vnitřních orgánech, ale bez postižení CNS. Nahromadění sfingomyelinu v retikuloendotelových buňkách (histiocytech) a ukládání gangliosidů GM3 a GM4 do CNS je provázeno ukládáním i zvýšením koncentrace cirkulujícího cholesterolu.
Druhá skupina je typická defektem nitrobuněčné esterifikace cholesterolu. V buňkách se hromadí cholesterol, glykolipidy, sfingomyelin i fosfolipidy. U různých forem jsou různě závažně postižena játra, slezina, kostní dřeň a nervová tkáň.
7.4.1.5. Glykosfingolipidóza (Fabryho choroba) je způsobena chyběním lysosomální a-galaktosylhydrolázy. Jde o nemoc s dědičností vázanou na pohlaví. V buňkách vnitřních orgánů a ve stěnách cév se hromadí trihexosylceramidy. Klinické projevy pocházejí především z cévních poruch.
7.4.1.6. Sulfatidóza (metachromatická leukodystrofie, sulfatidová lipidóza) je způsobena autosomálně recesívním chyběním arylsulfatázy A (ev. i dalších arylsulfatáz). V buňkách mozku i periferní nervové soustavy a ve vnitřních orgánech se hromadí sulfatidy (v gangliových buňkách se střádá "metachromatický" lipid). Onemocnění má několik forem. Nejmalignější z nich začíná až od 1. roku života a způsobuje nejdříve psychomotorické poruchy, později až kvadruplegii a slepotu se zachovanými pouze vegetativními funkcemi.
7.4.11.7. Galaktosylceramidová lipidóza (Krabbeho choroba, globoidní leukodystrofie) je zhoubné familiární, autosomálně recesívně přenášené onemocnění způsobené poruchou galaktosylceramid-ß-galaktosidázy. Porucha degradace galaktosylcerebrosidů vede k tvorbě "globoidních" buněk, které nahrazují oligodendroglii a k zastavení myelinizace. Klinicky se nemoc začne projevovat až po několikaměsíčním normálním vývoji ztrátou pohyblivosti, křečemi, později kvadruplegií, poruchami polykání a dýchání.
7.4.1.8. Lipidóza fytanové kyseliny (Refsumova choroba) je chronickým autosomálně recesívně dědičným onemocněním, které je způsobeno defektem a-hydroxylázy kyseliny tetramethylhexadekanové (fytanové). Tato kyselina vzniká v těle býložravců oxidací fytolu, 20-uhlíkového isoprenoidního alkoholu, který je součástí chlorofylu. Člověk přijímá fytanovou kyselinu jako takovou z tuku býložravců, z mléka, mléčných výrobků a snad i z rajčat a borůvek. Fytanová kyselina se nemůže hned začít odbourávat ß-oxidací, protože tomu brání větvení (methyl) na 3.uhlíku. Za normálních okolností se proto nejdříve zkrátí o jeden uhlík a-oxidací na kyselinu pristanovou a teprve potom pokračuje šestinásobná b-oxidace. Při chybějícím prvním kroku se stává fytanová kyselina sama součástí membrán a přispívá tak k jejich instabilitě. Nemoc se projevuje parézami a atrofií dolních končetin, šlachovou areflexií, kostními deformacemi, poruchami rovnováhy, nystagmem, poruchami sluchu a čichu a kožními změnami.
4.2 Poruchy v metabolismu mastných kyselin
Poruchy se mohou vyskytovat také v transportu mastných kyselin o dlouhém řetězci mitochondriální membránou. To může být způsobeno deficitem karnitin-acyltransferázy. Příznaky jsou velmi podobné MCAD (bez organické acidurie) a jsou spojeny se svalovou steatózou.
Mezi poruchy metabolismu mastných kyselin lze zařadit i propionovou hyperacidurii a methylmalonovou acidurii, autosomálně recesívně dědičná onemocnění, která jsou zmíněna u poruch metabolismu aminokyselin. Při hyperpropionátémii se jedná o deficit propionyl-CoA-karboxylázy, takže mastné kyseliny s lichým počtem uhlíků, rozvětvené mastné kyseliny a aminokyseliny isoleucin, methionin a threonin se odbourávají jen po propionyl-CoA, z něhož hydrolýzou vzniká propionát. Hromadění propionátu způsobuje metabolickou acidózu. U methylmalonáturie spočívá defekt v methylmalonyl-CoA-mutáze, takže methylmalonyl-CoA vznikající při odbourávání valinu (v podstatě reakcemi -oxidace), se nemůže dále přeměňovat na sukcinyl-CoA. Hromadící se methylmalonát rovněž působí metabolickou acidózu.
5. Laboratorní vyšetření základních lipidových parametrů
V zahraniční literatuře se často vyskytuje a úporně udržuje vyjadřování koncentrací cholesterolu a triacylglycerolů v mg% (tj. v miligramech příslušného analytu ve 100 ml analyzovaného vzorku). Přepočet na jednotky SI je tento:
4.1 Lipidózy
Jsou to vrozené poruchy metabolismu složených lipidů. Je pro ně charakteristické jejich hromadění, které jim dalo také souhrný název thesaurismózy (thesaurus = poklad, pokladnice, skladiště, zásobárna). K dalším typickým rysům patří to, že
zasažena je především nervová tkáň (odtud označení "neurolipidózy") a že postižení mívá vesměs těžký průběh s fatálním koncem.
V prvé řadě je třeba jmenovat dědičné poruchy postihující ß-oxidaci mastných kyselin. Rozlišuje se mitochondriální katabolismus mastných kyselin s krátkými (4-6 C), středními (7-11 C), nebo dlouhými (12-22 C) řetězci a poruchy jsou způsobeny deficiencí příslušných acyl-CoA-dehydrogenáz. V poslední době se hledají defekty i v dalších enzymech ß-oxidace. Choroby se podle toho označují jako short-, medium- nebo long-chain acyl-CoA dehydrogenase deficiency (SCAD, MCAD a LCAD). Nejčastější z nich je MCAD. Jsou to chronická onemocnění, začínající v dětském věku a projevující se dvoufázovou, velmi nespecifickou symptomatologií blízkou tzv. Reyovu syndromu: zakrátko po počátečních chřipkových příznacích se objeví horečky, zvracení, bolesti břicha s hepatomegalií, křeče, obtížné dýchání a různě silné poruchy vědomí jako projev postižení mozku. Bezprostřední ohrožení života představuje edém mozku. V moči se nacházejí acylglycin, acylkarnitin a volné dikarboxylové mastné kyseliny.
Hned v úvodu je třeba upozornit na nepřesné, ale všeobecně rozšířené používání některých termínů v medicínském argotu. Vzhledem k tomu, že po dlouhá léta bylo běžně dostupné pouze vyšetření celkového cholesterolu a triacylglycerolů, stalo se zvykem charakterizovat jak výsledky biochemického vyšetření, tak chorobné stavy podle těchto parametrů. Dnes víme, že etiopatogenezi choroby a klinický stav lépe charakterizují lipoproteiny. Vyšetření "HDL-cholesterolu", "VLDL-cholesterolu" a "LDL-cholesterolu" vypovídají přibližně o obsahu cholesterolu v těchto frakcích, ale je třeba upřesnit metodologii (chemické vs. imunochemické stanovení, výpočet vs. přímé stanovení, které se dosud provádí jen vzácně, apod.). Stanovením cholesterolu můžeme zjistit jen jeho sumární koncentraci (volný + esterifikovaný), nebo po precipitaci (případně jinými metodami, viz dále) můžeme stanovit cholesterol ve frakci HDL. Nepřímo, tj. výpočtem a s mnoha výhradami, lze určovat jeho koncentraci ve frakci LDL. Pouhé stanovení celkového cholesterolu a triacylglycerolů neříká vůbec nic o jejich zastoupení v jednotlivých lipoproteinech. Elektroforéza lipoproteinů nám zviditelní frakce odpovídající zhruba základním lipoproteinovým třídám, je však třeba mít na paměti omezení uvedená dále v části 5.3 této kapitoly. Imunochemická stanovení, jakkoliv jsou citlivá a specifická, detegují pouze apoproteinové části lipoproteinů a dosud přetrvávají nesnáze s jejich standardizací.
Racionální přístup k indikaci vyšetření lipidového metabolismu spočívá v postupu od jednodušších vyšetření ke složitějším. K základním vyšetřením, z jejichž výsledků se rozhodujeme o dalších indikacích, patří stanovení triacylglycerolů a cholesterolu (celkového a/nebo HDL). Následuje elektroforéza, která může odhalit některé patologické lipoproteiny, např. Lp(a), a napomoci k fenotypizaci. Pouze ve speciálních případech bývá potřebné stanovovat apoproteiny.
5.1 Triacylglycerolémie
Vyšetřuje se po celonočním, tj. nejméně 12-hodinovém lačnění. Venepunkci je třeba provádět ze žíly na nezaškrcené paži, nebo na paži zaškrcené co nekratší dobu (do 2 minut). Vyšetřuje se z krevního séra, které je pro toto stanovení možno skladovat 3 dny v chladničce při +4 až +8°C anebo uchovávat řadu týdnů zmražené při -20°C. V nedávné minulosti se triacylglyceroly stanovovaly složitými metodami, které obsahovaly extrakci do organického rozpouštědla, zmýdelnění louhem a získání glycerolu, oxidaci glycerolu jodistanem na formaldehyd a stanovení formaldehydu kondenzací s acetylacetonem v přítomnosti NH4+.
Dnes se v klinické biochemii používají výhradně enzymové metody stanovení triacylgycerolů. Jde o spřažené systémy enzymových reakcí, z nichž první reakcí je vždy hydrolýza triacylglycerolů lipázou na glycerol a mastné kyseliny. V další reakci s ATP se glycerol přeměňuje glycerolkinázou na glycerol-3-fosfát a ADP. Následující reakce se různí:
1. glycerol-3-fosfát je možno dehydrogenovat glycerol-3-fosfátdehydrogenázou s koenzymem NAD+ na dihydroxyacetonfosfát a stanovovat přírůstek redukovaného NADH+H+ (přírůstek absorbance při 340 nm),
2. nebo je možné glycerol-3-fosfát oxidovat glycerol-3-fosfátoxidázou na dihydroxyacetonfosfát a peroxid vodíku a potom stanovovat H2O2 oxidační kopulací (Trinderovou reakcí) s aminofenazonem a derivátem fenolu za vzniku barevného chinoniminu (měří se absorbance při 510 nm),
3. nebo reakce pokračuje využitím ADP a fosfoenolpyruvátu v pyruvátkinázové reakci poskytující pyruvát a ATP. Pyruvát je potom substrátem v laktátdehydrogenázové reakci s koenzymem NADH, jejímž produktem je laktát a NAD+. Stanovuje se úbytek absorbance při 340 nm.
Vzhledem k tomu, že tato schémata vždy zahrnují reakce glycerolu, mohly by se vyskytnout falešně vyšší výsledky u pacientů s vyšší koncentrací volného glycerolu v cirkulaci (diabetici, pacienti s renálním selháním na hemodialýze). Enzymová stanovení TG jsou do značné míry odolná vůči interferencím lipémií, hemolýzou nebo bilirubinémií a lze je automatizovat.
Referenční interval je obvykle do 1.9 mmol/l.
5.2 Cholesterolémie
Cholesterol v séru se běžně stanovuje jako "celkový", čímž je myšlena suma cholesterolu a jeho esterů. Je třeba mít na paměti, že za fyziologických okolností představují estery cholesterolu zhruba 2/3 celkového cholesterolu v krvi. Stanovuje se v séru nebo v plazmě odebrané za stejných podmínek, jako je uvedeno u triacylglycerolů a s podobnou možností skladování. Hladina cholesterolu v cirkulaci má značné intraindividuální variace a proto se doporučují opakovaná vyšetření v rozmezí několika dnů.
Starší metody stanovení využívaly tvorby barevných kondenzačních produktů při reakci cholesterolu např. s acetanhydridem v prostředí koncentrované kyseliny sírové (zelený produkt, Liebermannova-Burchardova reakce), nebo při reakci s ledovou octovou kyselinou v přítomnosti koncentrované kyseliny sírové a iontů Fe3+ (červené zbarvení, Zlatkisova metoda). Kromě toho, že si lze snadno představit nevýhody použití agresívních chemikálií, nebyly tyto metody automatizovatelné a jejich výsledky byly značně rušeny hemolýzou a bilirubinémií.
Všechny současné metody stanovení cholesterolu využívají spřažených enzymových reakcí. Typická sestava je taková, že v první fázi se cholesterolesterázou štěpí estery cholesterolu na cholesterol a mastné kyseliny, ve druhé se cholesterol oxiduje cholesteroloxidázou na cholestenon a peroxid vodíku, a konečně ve třetí, indikační reakci se využívá ke stanovení H2O2 oxidační kopulace aminofenazonu a derivátu fenolu katalyzované peroxidázou a měří se vzniklý chinonimin.
Jako vyšetření HDL-cholesterolu se označuje stanovení obsahu cholesterolu ve frakci lipoproteinů HDL. Tu je třeba nejprve izolovat tak, že se precipitací směsí fosfowolframové kyseliny se solí Mg2+ a následnou centrifugací odstraní ze vzorku frakce VLDL a LDL. V čirém supernatantu, který obsahuje jen HDL, se potom stanovuje cholesterol. Nejnověji se dnes objevují metody pro přímé stanovení HDL, tj. bez precipitace. Vycházejí ze zjištění, že enzymy cholesterolesteráza a cholesteroloxidáza přeměňují v prostředí polyethylenglykolu, dextransulfátu a Mg2+ rychleji cholesterol v HDL než v ostatních lipoproteinech. Poměr koncentrací HDL-cholesterolu a celkového cholesterolu se někdy používá jako tzv. aterogenní index. Další typ aterogenního indexu dává do vzájemného poměru koncentrace apo A1 a apo B (viz část 5.4 této kapitoly).
Výslednou hodnotu koncentrace HDL-cholesterolu a hodnotu koncentrace triacylglycerolů je možno použít k výpočtu koncentrace LDL-cholesterolu. Vychází se přitom z předpokladu, že většina triacylglycerolů je obsažena právě ve VLDL, a že molární poměr cholesterolu ve VLDL činí průměrně 45 % obsahu triacylglycerolů. Autorem vzorce pro výpočet je W.T.Friedewald :
Výpočet lze použít pouze tehdy, nepřekročí-li celková hladina triacylgycerolů 4,5 mmol/l, nejsou-li přítomny chylomikrony a nejde-li o chorobu širokého beta (podle WHO typ III) se změněným složením VLDL. Nejnověji se objevují metody i pro přímé stanovení LDL cholesterolu.
| CELKOVÝ CHOLESTEROL (mmol/l) | ||||
|---|---|---|---|---|
| Riziko/Věk r. | 2 až 19let | 20 až 29let | 30 až 39let | 40 a více let |
| Snížené riziko | < 4,8 | < 5,2 | < 5,7 | < 6,2 |
| Mírné riziko | 4,8 - 5,2 | 5,2 - 5,7 | 5,7 - 6,2 | 6,2 - 6,7 |
| Zvýšené riziko | > 5,2 | > 5,7 | > 6,2 | > 6,7 |
| Riziko | HDL-CHOLESTEROL | LDL-CHOLESTEROL |
|---|---|---|
| Snížené riziko | > 1,4 | < 3,9 |
| Standardní riziko | 1,4 - 0,9 | 3,9 - 4,9 |
| Zvýšené riziko | < 0,9 | > 4,9 |
Referenční intervaly celkového cholesterolu a cholesterolu v jednotlivých frakcích jsou předmětem stálé diskuse, v níž existují "přísnější" kritéria z USA a kompromisnější kritéria evropská. Je zřejmé, že referenční intervaly se liší nejen podle věku, ale též etnicky a regionálně. Z epidemiologických studií dále vyplývá, že různé koncentrační hladiny jsou spojeny s rozdílným rizikem rozvoje ICHS (tab. 4A a 4B).
5.3 Elektroforéza lipoproteinů (EL)
Požadovala se zejména pro typizaci hyperlipoproteinémií podle Fredricksona, resp. nomenklatury Světové zdravotnické organizace WHO
(tab. 7.5). Dnes se od této klasifikace ustupuje, protože je pouhým obrazem aktuálního stavu metabolismu bez ohledu na chorobnou jednotku, která je v pozadí.
EL má poměrně vysokou výpovědní hodnotu tam, kde ve skutečnosti selhávají její separační schopnosti, např. u choroby široké beta lipoproteinové frakce, u chylomikronémie, nebo tam kde podává negativní informaci, tj. při chybění nebo výrazném oslabení některých frakcí. Vysokou výpovědní hodnotu má také pro detekci aterogenního lipoproteinu Lp(a).
Může se s úspěchem provádět na celé řadě nosičů: papír, acetátcelulóza, agar, agaróza, polyakrylamid. Z nich dnes převažuje agaróza. Mohou se používat různé metodické modifikace, při interpretaci je však nutno respektovat rozdíly v migračních parametrech lipoproteinů. Rozdělení při EL může být ovlivněno řadou heterologních faktorů, např. přítomností paraproteinů a zbarvení frakcí může být ovlivněno tím, že lipofilní barviva (např. olejová červeň nebo Sudanová čerň) používaná k barvení elektroforeogramů, mají vyšší afinitu k triacylglycerolům. Je vhodné vědět, že i při denzitometrickém číselném hodnocení elektroforeogramu je třeba EL považovat za kvalitativní nebo nejvýše za semikvantitativní metodu. Navíc je přece jen hůře standardizovatelná než ostatní metody, takže bývá obtížné srovnávat výsledky z různých pracovišť.
| Typ WHO | Hlavní hyperlipidémie | Změny na elektroforeogramu | Hyperlipoproteinémie |
|---|---|---|---|
| I | Triacylglyceroly | Akumul. na startu | Chylomikrony |
| II a | Cholesterol | Zvýš. beta lip. | LDL |
| II b | Cholesterol atriacylglyceroly | Zvýš. beta a pre-beta lip. | LDL a VLDL |
| III | Cholesterol a triacylglyceroly | Široký pruh beta lip. | IDL |
| IV | Triacylglyceroly | Pre-beta lip. | VLDL |
| V | Triacylglyceroly | Pre-beta a akumul.na startu | VLDL a chylomikrony |
5.4 Stanovení apoproteinů
V rutinní praxi se stanovují nejčastěji apoprotein A-I a apoprotein B. Používají se k tomu imunochemické metody typu RIA nebo v současnosti spíše EIA, které lze i automatizovaně provádět na řadě biochemických analyzátorů. Získané hodnoty vypovídají o koncentraci příslušných lipoproteinů a považují se za lepší pro určení rizika ICHS než pouhé koncentrace TG a celkového CH a za přesnější než stanovení HDL cholesterolu precipitační metodou. Stanovení apo B je navíc jedinou metodou k diagnostice hyperapobetalipoproteinémie. Z poměru koncentrací apo A-I a apo B se někdy také kalkuluje další aterogenní index.
Apoprotein E je diagnosticky významný pro potvrzení hyperlipoproteinémie z VLDL-remnantů. Metodou izoelektrické fokusace izolované frakce VLDL se provádí fenotypizace apo E. Tato vyšetření, podobně jako stanovení ostatních apoproteinů, jsou už spíše předmětem zájmu výzkumu nebo vyžadují speciální technologii a tím zůstávají vyhražena vysoce specializovaným pracovištím.
6. Doporučená literatura:
Puriny jsou odvozené od purinového skeletu, který se skládá z šestičlenného pyrimidinového jádra kondenzovaného s pětičlenným jádrem imidazolovým. Z hlediska chemické struktury purinů rozlišujeme báze, nukleosidy a nukleotidy.
Báze jsou deriváty purinu, tedy heterocyklické, aromatické molekuly. Hlavní purinové báze nukleových kyselin jsou adenin a guanin. Spojením bází s cukernou složkou vznikají nukleosidy, které jsou lépe rozpustné ve vodě než volné báze. Fosforečné estery nukleosidů jsou nukleotidy. V ribonukleotidech je cukernou složkou zbytek D-ribózy. V deoxyribonukleotidech tvoří cukernou složku 2'-deoxy-D-ribóza. Nukleotidy jsou středně silné kyseliny.
2. Syntéza a odbourávání
3. Genetické defekty a jejich rozdělení
Následující tabulka
(tab. 8.1) ukazuje v přehledu výčet jednotlivých defektů této skupiny onemocnění. V současné době jsou jednotlivá onemocnění označována dle názvů chybějících enzymů. Starší označení dle hromadícího metabolitu jsou uvedena v závorce. Čísla v závorkách znamenají mezinárodní klasifikaci dědičných onemocnění dle McKusicka.
R.Češka: Cholesterol a ateroskleróza. Léčba hyperlipidémií. Alberta s.r.o. Praha 1994
W.Marshall: Clinical chemistry. 3rd Ed., Mosby, Times Mirror International Publishers Ltd. London 1995
N.Rifai, G.R.Warnick (Eds.): Laboratory measurements of lipids, lipoproteins and apolipoproteins. AACC Press Washington, 1994
Farmakoterapie poruch tukového metabolismu. Farmakoterapeutické informace č.1, 1996, příloha Časopisu České lékařské komory a Věstníku SÚKL. Státní ústav pro kontrolu léčiv, Praha 1996
Poruchy metabolismu purinů
Autor kapitoly: MUDr.Ivan Šebesta, Ústav klinické biochemie VFN a 1.LF UK Praha
Purinové metabolity představují významnou skupinu všudypřítomných látek, které se účastní téměř všech biochemických reakcí. Purinové a pyrimidinové nukleotidy tvoří základní stavební složky nukleových kyselin. Jsou také součástí řady koenzymů. Nukleosidtrifosfáty (zejména ATP) představují zdroj energie pro buňku. Důležitost těchto látek v metabolismu buňky potvrzuje zjištění, že lidský organismus syntetizuje všechny potřebné nukleotidy z nenukleotidových prekursorů (tzv. syntéza de novo) a nespoléhá na jejich exogenní přísun stravou. Téměř všechny buňky mají tuto metabolickou cestu a kromě toho přeměňují též volné báze zpětně na příslušné nukleotidy recyklační dráhou. Též různorodost klinických projevů spolu s postižením mnoha důležitých orgánů u genetických defektů purinového metabolismu ukazuje na význam této skupiny látek.
Výchozí sloučeninou biosyntézy purinů je D-ribosa-5-fosfát, který přijímá difosfát za tvorby 5-fosforibosyl-1-difosfátu (dříve fosforibosylpyrofosfát, PRPP). Postupně v této tzv. syntéze de novo je vybudován purinový cyklus. Nejdůležitějším regulačním místem je syntéza fosforibosylaminu. Enzym amidofosforibosyltransferáza je inhibován purinovými nukleotidy (přehledná schémata viz učebnice biochemie v seznamu doporučené literatury). Ve většině buněk probíhá aktivní obrat nukleových kyselin, při kterém se uvolňuje guanin, adenin a hypoxanthin. Tyto volné purinové báze jsou jen zčásti dále katabolizovány na kyselinu močovou. Zbývající část je přeměňována zpětně na příslušné nukleotidy recyklační dráhou (tzv."salvage pathway"). Toto zpětné využití bazí zajišťují enzymy hypoxanthin-guanin-fosforibosyltransferáza (HPRT) a adeninfosforibosyltransferáza (APRT). Klinický význam jejich deficitů je uveden v dalším textu. Odbourávání purinů končí u člověka u kyseliny močové, která se vylučuje ledvinami. Savci nenáležijící mezi primáty oxidují kyselinu močovou na vylučovaný produkt allantoin. Důležitým enzymem odbourávání je xanthinoxidáza, která oxiduje hypoxanthin a dále xanthin na kyselinu močovou. Kyselina močová vzniká kromě uvedené syntézy de novo ještě ze dvou zdrojů: z nukleotidů v potravě a z rozpadu tkáňových nukleoproteinů. Zhruba 1/3 kyseliny močové je vylučována zažívacím traktem a 2/3 jsou vyloučeny ledvinami. V ledvinách dochází k témeř 100% glomerulární filtraci. V proximálním tubulu se močová kyselina prakticky úplně resorbuje, současně se však aktivním procesem opět secernuje. Mechanismy obousměrného aktivního transportu v proximálním tubulu nejsou zcela známy. Celkem se vyloučí denně 2,4 - 4,8 mmol kyseliny močové.
Dědičné metabolické poruchy purinů představují skupinu nedávno popsaných onemocnění. První defekt byl objeven v roce 1954. Většina chorob byla objevena v posledních dvaceti letech. Stimulací výzkumu regulace a vzájemných vztahů purinového a pyrimidinového metabolismu se staly především objevy enzymových defektů sdružené s poškozenou funkcí imunitního systému u dětí. Společným jmenovatelem těchto onemocnění jsou geneticky podmíněné změny v aktivitách enzymů. Snížená nebo až nulová aktivita příslušného enzymu vede k metabolickému bloku, což má za následek abnormální hromadění fyziologických či atypických metabolitů v tkáních nebo tělesných tekutinách a dochází tak k poškození organismu. Genetické postižení může také vyvolat zvýšenou aktivitu příslušného enzymu, která vede též k nahromadění určitých metabolitů. Způsob jakým akumulující se metabolit poškozuje cílový orgán není však ještě v současné době znám. Vzhledem k této nejasné patogenezi nelze též u řady onemocnění efektivně terapeuticky zasáhnout. Kausální léčba není známa zejména u těch defektů, kde se jedná o postižení CNS. U většiny deficitů byl prokázán autosomálně recesivní způsob dědičnosti. Gonosomálně recesivní typ dědičnosti vykazují jen dvě onemocnění: deficit hypoxanthinfosforibosyltransferázy (HPRT) a zvýšená aktivita fosforibosyldisfátsyntetázy (PRPPs). K této skupině chorob se též řadí poruchy ve vylučování kyseliny močové, které způsobují poškození ledvin a přispívají k rozvoji dnavého syndromu. U familiární juvenilní hyperurikemické nefropatie (FJHN) byl zjištěn autosomálně dominantní typ dědičnosti.
| Deficit hypoxanthin-fosforibosyltransferázy (HPRT), částečný = Kelley-Seegmillerův syndrom, kompletní= Lesch-Nyhanův syndrom | McKusick 30800 | |
| Deficit adeninfosforibosyltransferázy (APRT), 2,8 - dihydroxyadeninová litiáza | McKusick 27830 | |
| Deficit xanthinoxidázy (XOD), dědičná xanthinurie | McKusick 27830 | |
| Deficit adenosindeaminázy (ADA) | McKusick 10270 | |
| Zvýšená aktivita adenosindeaminázy (ADA) | McKusick 10273 | |
| Deficit purinnukleosidfosforylázy (PNP) | McKusick 16405 | |
| Deficit myoadenyládeaminázy (M-AMPDA) | McKusick 25475 | |
| Deficit adenylosukcinátlyázy (ASase) | McKusick 27199 | |
| Deficit molybdenového kofaktoru - def.sulfitoxidázy SO, xanthinoxidázy XOD | McKusick 25215 | |
| Familiární juvenilní hyperurikemická nefropatie (FJHN) | McKusick 16200 | |
| Zvýšená aktivita fosforibosyldifosfátsynthetázy (PRPPs) | McKusick 31185 | |
| Primární dna | McKusick 13890 | |
| Dědičná renální hypourikémie | McKusick 22015 | |
| Deficit inosintrifosfát pyrofosfohydrolázy (ITP) |
3.1 Klinické projevy
Z klinického hlediska se jedná o heterogenní skupinu onemocnění. Klinické projevy jsou podobně jako u ostatních dědičných metabolických poruch pestré a nespecifické. Nemocní přicházejí k lékaři s postižením ledvin (intersticiální nefritida, urolitiáza, renální selhání), kloubů (dnavá arthritis), neurologickým postižením (psychomotorická retardace, křeče, choreoathetosa, automutilace). Pro některé defekty je typické postižení imunitního systému či určitý typ anémie. Často se s prvními projevy setká vedle praktického lékaře též nefrolog, neurolog, urolog, reumatolog, imunolog či hematolog. Nástup příznaků má značnou časovou šíři. Těžké formy postižení se projevují již v novorozeneckém věku. Řada onemocnění má ale nástup příznaků později. Klinické projevy začínají často až v adolescenci či až v dospělém věku. Poruchy metabolismum purinů jsou typickým příkladem skutečnosti, že dědičné poruchy metabolismu nejsou jen záležitostí dětských lékařů, ale stávájí se též oblastí zájmů lékařů dospělých. Podobně jako u jiných dědičných metabolických poruch může být průběh onemocnění akutní, intermitentní nebo chronický. Závažnost postižení je též různá - od benigního či asymptomatického průběhu až po akutní život ohrožující stavy.
3.2. Charakteristika a laboratorní nálezy u jednotlivých onemocnění
3.2.1 Deficit hypoxanthin-guanin-fosforibosyltransferázy (HPRT)
Deficit enzymu vede ke zvýšené syntéze purinů de novo. Výsledkem je nadprodukce kyseliny močové, projevující se hyperurikémií a hyperurikurií.
Kompletní deficit se označuje jako Leschův-Nyhanův syndrom.Toto onemocnění patří mezi nejčastější genetické defekty purinového metabolismu a zasluhuje si právem podrobnější popis.
V klinickém projevu tohoto onemocnění dominuje dvojí odlišná symptomatologie. Mezi první patří následky výrazné nadprodukce kyseliny močové. Postiženým orgánem jsou vedle kloubů také ledviny, kde dochází kromě vzniku urolitiázy též k akutní nefropatii kyseliny močové a v některých případech až k akutnímu selhání ledvin. Kromě těchto následků nadprodukce kyseliny močové má onemocnění také výraznou neurologickou symptomatologii.
Jedním z prvních alarmujících příznaků nadprodukce kyseliny močové je oranžově červené zabarvení plen od vysrážených krystalů kyseliny močové z moči. Již brzo po narození se mohou vyskytovat projevy akutní nefropatie kyseliny močové (viz část 3.3 této kapitoly). Kolem 4.měsíce dochází k opoždění v psychomotorickém vývoji. Koncem prvního roku jsou přítomny neurologické změny - atetoidní nebo choreatiformní pohyby, hyperreflexie, torzní dystonie, hypotonie, dysartrie. K rozvoji dnavé artritidy dochází spíše v pozdějším věku. Mezi nejcharkterističtější rysy patří sebepoškozování neboli automutilace. Tento neobvyklý příznak se objevuje zhruba kolem 2.roku života, vyjímečně až kolem puberty. Postižení si okusují rty, konečky prstů, jazyk. Někdy bývá též přítomna agresivita vůči zdravotnickému personálu. Automutilace bývá někdy tak výrazná, že je nutné nemocným přivazovat ruce a pro výrazné poškození orofaciální oblasti se též provádí extrakce zubů. Postižení nemají snížený práh bolesti a často se stydí za toto nutkavé chování, které nelze vůlí ovládnout. Primární příčina neurologických projevů není dosud známa. Současné výzkumné práce ukazují na deficit dopaminergních neurotransmiterů v mozku.
Laboratorní nálezy a diagnostika. Nadprodukce kyseliny močové se projevuje výraznou hyperurikurií (300 - 850 µmol/kg/24 hodin). Hyperurikémie může dosahovat hodnot 416 až více než 1000 µmol/l. V ojedinělých případech lze nalést i normourikémii. V moči je zvýšené vylučování hypoxanthinu (více než 30 mmol/mol kreatininu). Prvním příznakem bývá oranžově červené zbarvení moče či zjištění této barvy na plenách. Tento nález je zcela jasnou indikací k vyšetření hladin kyseliny močové v krvi a v moči. Po průkazu hyperurikurie, hyperurikémie a zvýšeného vylučování hypoxanthinu se diagnóza potvrdí enzymovým vyšetřením z lyzátu erytrocytů.
3.2.2 Částečný deficit HPRT
Na rozdíl od kompletního deficitu je častějším projevem dnavý syndrom. U nemocných nedochází k psychomotorické retardaci a není přítomna neurologická symptomatologie.
Klinické projevy jsou jen důsledkem naprodukce kyseliny močové. Prvním příznakem bývá postižení ledvin, které se může projevit až akutním selháním. K rozvoji dny může docházet až v pozdějším věku. U řady pacientů bývá tento defekt zaměněn za diagnózu primární dny.
Laboratorní nálezy a diagnostika jsou stejné jako u kompletního defektu, jen pro rozlišení částečného deficitu je třeba provést enzymové vyšetření z intaktních erytrocytů.
3.2.3 Zvýšená aktivita fosforibosyldifosfátsyntetázy (PRPPs)
Zvýšená aktivita PRPPs vede ke stimulaci syntézyde novo. U pacientů dochází k opožděnému vývoji a k ataxii. Jsou přítomny též dysmorfické rysy. Charakteristickým projevem je vrozená hluchota. Nadprodukce kyseliny močové vede k postižení kloubů a ledvin. Onemocnění je gonosomálně recesívně dědičné a heterozygoti mají klinické i biochemické projevy.
Laboratorní nálezy a diagnostika: hyperurikémie, hyperurikurie. Pro potvrzení diagnózy je nutné prokázat zvýšenou aktivitu enzymu v erytrocytech.
3.2.4 Familiární juvenilní hyperurikemická nefropatie (FJHN)
Ledviny jsou tradičně považovány za jeden ze dvou primárně postižených orgánů u dny. Dlohodobé studie však nepotvrdily dnu či chronickou hyperurikémii jako signifikantně nezávislý faktor vedoucí k chronické renální insuficienci. Výskyt renálního selhání u pacientů se dnou je spíše sdružený s jinými rizikovými faktory, jako je arteriální hypertenze, ateroskleróza či již předcházející onemocnění ledvin (např. glomerulonefritida, pyelonefritida či amyloidosa). Nicméně existují pacienti s nekomplikovanou dnou, u kterých dochází k rychle progredujícímu onemocnění ledvin. Tato choroba byla prvně popsána v roce 1960 a je v současné době označována jako familiární juvenilní hyperurikemická nefropatie. Největší počet pacientů byl diagnostikován ve Velké Británii.
Klinické projevy. Onemocnění je charakterizováno dnou a progresivním onemocněním ledvin. Začátek onemocnění je obvykle v dětství, adolescenci nebo na začátku dospělého věku a renální selhání se obvykle objevuje mezi 20.- 40. rokem. Hyperurikémie a následná dna se objevuje u mladých pacientů nezávisle na pohlaví z důvodu nízké exkreční frakce kyseliny močové. První podezření na toto onemocnění může vzbudit pozitivní rodinná anamnéza. Onemocnění má totiž autosomálně dominantní typ dědičnosti. Genetický defekt však nebyl ještě určen a patogeneze hyperurikémie a postižení ledvin zůstává nejasná. Další zvláštností oproti primární dně je postižení žen. Dna u mladých žen je vzácná a dokonce dlouhou dobu přetrvávalo tvrzení, že žena v premenopause nemůže onemocnět dnou. Jako důvod byl udáván protektivní efekt ženských pohlavních hormonů, který však nebyl prokázán. Retrospektivní studie velkého počtu pacientů se dnou prokázaly, že existuje premenopausální dna. Příčinou může být uvedené onemocnění či zvýšená aktivita PRPPs. Laboratorní nález nejasné hyperurikémie u dívky či mladé ženy je proto velmi suspektní pro metabolický defekt purinů a je zcela jasnou indikací k následnému detailnímu vyšetření purinového metabolismu. Dříve než se objeví dna u jednoho nebo více členů rodiny onemocnění může být přehlédnuto a diagnostikováno jako familiární nefritida.
Laboratorní nálezy a diagnostika. Typická je hyperurikémie a výrazně snížená exkreční frakce kyseliny močové. Vyšetření purinových metabolitů v tělesných tekutinách je zcela v normě. Též stanovení aktivit enzymů purinového metabolismu je v normě. Snížená exkreční frakce kyseliny močové je považována za biochemický marker tohoto onemocnění. Vyšetření biopsie ledvin prokazuje nespecifickou intersticiální nefritidu a je nutné upozornit, že u většiny pacientů nebyly prokázány krystaly urátů.
3.2.5 Dna
Dna je definována jako klinický syndrom. Z tohoto důvodu označení dnavý syndrom přesněji vystihuje skutečnost, že příčinou primární hyperurikémie, dnavé artritidy a v řadě případů postižení ledvin, může být jedno z těchto onemocnění:
primární dna, deficit HPRT, zvýšená aktivita PRPPs, FJHN, familiární dna. Za vznik hyperurikémie a dnavého syndromu je zodpovědná kombinace řady faktorů. Hlavními rizikovými faktory jsou zvýšený příjem purinů stravou sdružený s defektem v renálním vylučování kyseliny močové, kde odpovědí na zvýšenou zátěž puriny je zvýšení hladiny kyseliny močové.
Primární dna patří mezi nejčastější typ dny a postihuje zejména starší obézní muže. Podrobný popis tohoto onemocnění lze najít v učebnicích vnitřního lékařství nebo revmatologie (K.Pavelka jr.: Krystalické artropatie., viz doporučená literatura) Zde uvádíme jen stručnou charakteristiku.
Klinické projevy. Rozlišují se 4 stádia v průběhu onemocnění:
1.období asymptomatické hyperurikémie
2.období akutního dnavého záchvatu
3.interkritické období
4.období chronické tofosní dny.
Diagnostika. K jisté diagnostice dny stačí průkaz urátových krystalů v synoviální tekutině, nebo nález tofu obsahujícího uráty.
3.2.6 Deficit adeninfosforibosyltransferázy (APRT) (2,8-dihydroxyadeninová litiáza)
Defekt aktivity adeninfosforibosyltransferázy (APRT) vede k přeměně adeninu na 2,8-dihydroxyadenin (2,8-DHA). Tento velmi špatně rozpustný metabolit vytváří močové konkrementy.
Klinické projevy. Onemocnění může mít benigní, ale také život ohrožující průběh. U řady pacientů došlo k akutnímu selhání ledvin. 20% nemocných zůstává však asymptomatických. Je nutné zdůraznit, že se toto onemocnění nestává jen záležitostí dětského věku. Průměrný věk popsaných pacientů činí 25 let.
Laboratorní nálezy a diagnostika. Typické je vylučování adeninu, 8-hydroxyadeninu a 2,8-dihydroxyadeninu v poměru 1,0 : 0,03 : 1,5. Tvorba a vylučování ostatních purinů jsou nezměněny. Na možnost tohoto onemocnění může též upozornit nález v močovém sedimentu (nikoli jehličkovité, ale mikrosférické krystaly). Po průkazu 2,8-DHA v moči spočívá potvrzení diagnózy v enzymovém vyšetření z erytrocytů. Na možnost deficitu APRT je třeba myslet u dětí a dospělých se symptomy urolitiázy, zvláště při normálních hodnotách kyseliny močové v séru a moči. 2,8-DHA je analog kyseliny močové a rutinními chemickými testy nelze tento metabolit odlišit od kyseliny močové. Konkrementy jsou rtg-nekontrastní. Při pozornější analýze konkrementů z kyseliny močové lze předpokládat častější nález této litiázy než dosud.
3.2.7 Deficit xantinoxidázy (XO) (dědičná xanthinurie)
Xantinoxidáza je klíčový enzym katabolismu purinových metabolitů. Defekt enzymu způsobuje zvýšené vylučování xantinu a hypoxantinu močí. Onemocnění bylo popsáno v roce 1954 jako první enzymový defekt purinového metabolismu.
Klinické projevy. Jde o poměrně benigní afekci. Postižení probíhá často asymptomaticky a zjištění této poruchy je spíše náhodným nálezem, když v rámci biochemického vyšetření je prokázána hypourikémie. Nicméně u části nemocných se defekt manifestuje xantinovou urolitiázou, která nemusí být vždy jen v dospělosti a je možná i v novorozeneckém věku.
Laboratorní nálezy a diagnostika. Typické je zvýšené vylučování xantinu a hypoxantinu močí. V krvi a v moči jsou velmi nízké až téměř nulové hodnoty koncentrací kyseliny močové. Stanovení aktivity enzymu je možné jen ze střevní či jaterní
biopsie. Často je diagnóza stanovena jen na úrovni metabolitů. V rámci diferenciální diagnostiky urolitiázy přicházejí v úvahu tyto purinové metabolity: kyselina močová, xantin a 2,8-dihydroxyadenin. Podezření výrazně zvyšuje pozitivní rodinná anamnéza s výskytem urolitiázy v rodině, věk není příliš rozhodující. Nefrotoxicita těchto tří metabolitů souvisí s jejich špatnou rozpustností v moči. Následující tabulka
(tab. 8.2) ukazuje v přehledu rozpustnost purinových metabolitů v moči při různém pH. Zatímco rozpustnost kyseliny močové lze alkalizací zvýšit až 12 x, rozpustnost xantinu a 2,8-dihydroxyadeninu takto ovlivnitelná není. Je nutné zdůraznit, že při léčbě 2,8-dihydroxyadeninové litiázy je alkalizace kontraindikována.
| pH | 5.0 | 8.0 |
|---|---|---|
| c (mmol/l) | ||
| Kyselina močová | 0.9 | 12.0 |
| Xantin | 0.5 | 0.9 |
| Hypoxantin | 10.3 | 11.0 |
| 2,8-dihydroxyadenin | 0.02 | 0.03 |
3.2.8 Kombinovaný deficit xanthinoxidázy a sulfitoxidázy
Klinické projevy. Převažuje symptomalogie způsobená deficitem sulfitoxidázy.
První příznakem jsou často novorozenecké křeče. Typická je dislokace oční čočky. Postižení mají opožděný vývoj, ataxii a spastickou parézu.
Laboratorní nálezy. Vedle hypourikémie a xanthinurie je zvýšené vylučování S-sulfocysteinu, siřičitanu, thiosulfátu a disulfidů močí.
3.2.9 Deficit adenylosukcinázy (ASase)
Jedná se o poměrně nový defekt purinových nukleotidů objevený v roce 1984. Onemocnění je prvním popsaným genetickým defektem u člověka postihující syntézu purinů de novo. Patobiochemické mechanismy vedoucí k poškození CNS a neurologickým projevům jsou v současné době neznámé. Nálezy u pacientů diagnostikovaných v zahraničí vylučují depleci purinových nukleotidů jako příčinu klinických projevů.
Klinické projevy. V popředí klinického obrazu je neurologické postižení s psychomotorickou retardací. V prvních letech života se začíná projevovat psychomotorická retardace, která je často spojena s epilepsií. Dalšími symptomy mohou být hypotonie, autismus, dyskinese. Dosud bylo diagnostikováno ve světě jen 16 pacientů. Nález dalších pěti pacientů české národnosti pravděpodobně ukazuje na častý výskyt tohoto onemocnění v naší populaci.
Laboratorní nálezy a diagnostika. Biochemickými markery onemocnění jsou dva metabolity substrátů enzymu ASase v synthese purinů de novo a purinnukleotidovém cyklu, které se hromadí v moči, krvi a mozkomíšním moku. Jedná se o sukcinylaminoimidazol karboxamid ribosid - SAICAr [5-aminoimidazol-4-(N-sukcinylkarboxamido)-ribosid] a sukcinyladenosin (S-Ado). Zkušenosti autorů ukazují, že ke screeningovému vyšetření z ranního vzorku moče je velmi výhodné použít metodu tenkovrstevné chromatografie. Mezi indikace k tomuto selektivnímu screeningu patří: nejasná psychomotorická retardace nebo křeče nebo hypotonie. Po pozitivním nálezu při screeningovém vyšetření následuje kvantifikace obou sukcinylpurinů (SAICAr a S-Ado) v moči, krvi a mozkomíšním moku pomocí vysokoúčinné kapalinové chromatografie. Potvrzení defektu lze provést vyšetřením aktivity enzymu v lymfocytech. Defekt enzymu je též průkazný ve fibroblastech, ledvinách, jaterní tkáni a svalové tkáni. Na pracovišti 1.LF UK byly též zavedeny metody DNA analýzy pro toto onemocnění.
3.2.10 Deficit adenosindeaminasy (ADA)
Onemocnění patří mezi defekty postihující imunitní systém. Deficit enzymu vede k nahromadění toxického deoxyadenosinu, který postihuje imunokompetentní buňky.
Klinické projevy začínají u těžkých forem již od narození. Jde o těžké rekurentní infekce, zvláště plicní. Častá je i kandidóza, chronické vodnaté průjmy. Deficit ADA
je totiž jednou z příčin těžkého kombinovaného imunodeficitu (severe combined imunodeficiency disease -SCID). 85% pacientů s tímto deficitem má klasický SCID. Prognóza je velmi špatná a postižení bez léčby umírají do dvou let. Zbývajících 15% onemocní v pozdějším věku, kde má onemocnění delší průběh.
Laboratorní nálezy a diagnostika. Močí se zvýšeně vylučuje deoxyadenosin a adenosin. Imunologické vyšetření prokazuje postižení jak humorální tak buněčné imunity. Rtg vyšetření ukazuje na vymizení stínu thymu. U řady pacientů jsou na předním konci žeber změny stejné jako u rachitidy. Na možnost tohoto deficitu je třeba pomýšlet u dětí s rekurentními infekceni, chronickým průjmem a prokázaným postižením obou typů imunity. Průkaz či vysoké podezření na SCID (zejména z výsledků imunologického vyšetření) má ihned alarmovat lékaře k indikaci vyšetření na deficit ADA. Prvním krokem k diagnóze je průkaz deoxyadenosinu v moči. Dále následuje stanovení aktivity enzymu v erytrocytech. Vyšetření se provádí z nesrážlivé krve odebrané do EDTA. Stanovení enzymové aktivity je nutné provést v den náběru.
3.2.11 Deficit purinnukleosidfosforylázy (PNP)
Defekt enzymu je dalším onemocněním postihujícím imunitní systém. Ve srovnání s deficitem ADA je tento defekt vzácnější.Hromadící se substráty enzymu PNP jsou toxické a poškozují funkci T lymfocytů. Humorální imunita zůstává nepoškozena.
Klinické projevy. Nástup prvních příznaků je v širokém časovém rozmezí. První projevy lze pozorovat jak u kojenců, tak u starších dětí. Typická je zvýšená náchylnost k virovým a bakteriálním infekcím.
Laboratorní nálezy a diagnostika. Imunologické vyšetření prokazuje postižení buněčné imunity. V moči se vylučují v nadměrném množství tyto biochemické markery: inosin, deoxyinosin, guanosin a deoxyguanosin. V řadě případů je přítomna hypourikémie a hypourikurie. Na toto onemocnění je třeba myslet u všech dětí se symptomy imunodeficitu ukazujícího na dysfunkci buněk T. Hypourikémie, hypourikurie a potvrzení defektu buněčné imunity zvyšují pravděpodobnost této diagnózy. Následuje důkaz uvedených biochemických markerů v moči. Potvrzení deficitu spočívá ve stanovení aktivity PNP v erytrocytech.
3.2.12 Zvýšená aktivita adenosindeaminázy (ADA)
Onemocnění představuje vedle zvýšené aktivity PRPPs další defekt kde není enzymový deficit, ale naopak je aktivita enzymu zvýšená.
Typickým klinickým projevem je hemolytická anemie. Diagnostika se opírá o charakteristický laboratorní nález akumulace adeninových nukleotidů v erytrocytech. Diagnóza tedy spočívá v důkazu nukleotidů a zvýšené aktivity enzymu v erytrocytech.
3.2.13 Deficit myoadenylátdeaminázy (M-AMPDA)
Defekt této svalové adenylátdeaminázy představuje jeden z nejčastějších enzymových defektů ve svalech.
Klinické projevy. Typická je svalová únava až bolest po pohybu. Mezi méně časté příznaky patří svalová slabost bez předcházející svalové činnosti.
Laboratorní nálezy a diagnostika. Na rozdíl od většiny ostatních defektů purinového metabolismu nemá toto onemocnění charakteristickou akumulaci metabolitů v tělesných tekutinách. Vyšetření krve či moče zde není přínosné. K diagnostice přispívá provedení ischemického testu, kde po svalové aktivitě předloktí nedochází k produkci amoniaku. Nízké plazmazické hodnoty amoniaku svědčí pro pozitivitu testu.
3.2.14 Deficit inositrifosfát pyrofosfohydrolázy (ITP)
Tento deficit má pravděpodobně benigní průběh. Laboratorním nálezem je zvýšená koncetrace nukleotidu inosintrifosfátu (ITP) v erytrocytech. Některé literární údaje usuzují, že částečný defekt je častější v mentálně retardované populaci. Dle akumulace ITP v erytrocytech u tohoto defektu je předpokládán cyklus, ve kterém je ITP nepřetržitě syntetizován a metabolizován.
3.2.15 Renální hypourikémie
Mezi transportní poruchy kyseliny močové patří vedle familiární hyperurikemické nefropatie ještě renální hypourikémie. Termín renální hypourikémie zahrnuje patologické stavy s nízkou hladinou kyseliny močové v krvi z důvodu zvýšené clearance kyseliny močové. Zvýšená clearance může odrážet dědičný či získaný defekt tubulárního transportu v ledvinách, který je buď izolovaný jen pro kyselinu močovou či kombinovaný s jinými transportními defekty.
3.2.15.1 Dědičná renální hypourikémie
Jedná se o specifický, izolovaný dědičný defekt membránového transportu kyseliny močové v ledvinném proximálním tubulu. U homozygotů se onemocnění plně manifestuje hypourikémií a zvýšenou clearance kyseliny močové. Heterozygoty lze detegovat mírně sníženou sérovou hladinou a mírnou, ale signifikantně sníženou renální clearance urátu. Dědičnost je autosomálně recesívní. Existují ještě jiná onemocnění s renální hypourikémií, která se od uvedeného defektu liší tím, že postižení transportu urátu je jen jednou součástí generalizovaného postižení membránového transportu v ledvinách. Mezi nejčastější patří Fanconiho syndrom, zahrnující galaktosémii, cystinosu, Wilsonovu chorobu a dědičnou intoleranci fruktosy. Patří sem též Hartnapův syndrom.
3.2.15.2 Získaná renální hypourikémie
Tento typ hypourikémie lze nalézt u stavů se zvýšeným objemem extracelulární tekutiny, jako např. u nedostatečné sekrece antidiuretického hormonu. Vyskytuje se též u různých typů malignit, např. u mnohočetného myelomu, lymfomů, plicních nádorů, Hodgkinovy nemoci. Renální hypourikémii lze zjistit také u onemocnění jater, otrav těžkými kovy a po podání tetracyklinů.
3.3 Kyselina močová a postižení ledvin
Kyselina močová neboli 2,6,8-trioxypurin představuje u člověka konečný produkt metabolismu purinů. U lidí a primátů chybí enzym urikáza, který umožňuje další přeměnu kyseliny močové na lépe rozpustný allantoin. Hlavním klinickým problémem je to, že kyselina močová je extrémně nerozpustná a cirkuluje v krvi v hladinách blízkých hodnotě, při které již není rozpustná. Chová se jako velmi slabá kyselina, a proto při pH 7,4 je v plazmě téměř veškerá kyselina močová jako monosodná sůl rozpustná do koncentrace 0,42 mmol/l. Při zvýšení koncentrace dochází k vypadávání z roztoku a tvorbě tofů. V moči je rozpustnost této látky závislá na hodnotě pH
(tab. 8.2). Při pH 5,75 je zhruba 50% kyseliny močové disociováno, poklesne-li však pH moče na 4,75, je již 91% tohoto metabolitu přítomno ve formě nedisociované a málo rozpustné kyseliny močové. Tato skutečnost ukazuje na nutnost věnovat zvláštní pozornost tomuto metabolitu nejen z pohledu reumatologa (dnavá arthritis, tvorba tofů), ale též z nefrologického hlediska.
Z celkového množství kyseliny močové vyloučeného za 24 hodin připadá 70-80 % na ledviny. Asi 25% této látky se vylučuje z organismu střevní sekrecí. Kyselina močová je významným rizikovým faktorem nejen pro obstrukci vývodných močových cest, ale také pro parenchym ledvin. Stanovení vylučování kyseliny močové je proto velmi účelné. Rozpoznání zvýšeného vylučování kyseliny močové je důležité z těchto důvodů:
a) ledvinné tubuly a vývodné cesty močové těchto pacientů jsou vystaveny zvýšenému riziku tvorby konkrementů a poškození vlastní tkáně;
b) u řady pacientů jsou příčinou dědičné metabolické poruchy, kde odhalení tohoto onemocnění má význam nejen pro pacienta, ale i pro další členy rodiny;
c) nález zvýšeného vylučování je užitečnou informací pro diagnostiku proliferativních chorob.
Zvýšené hladiny kyseliny močové a její soli v krvi a moči vyvolávají dva typy poškození ledvin. Nefropatii kyseliny močové je nutné odlišit od urátové nefropatie. U prvního typu dochází k precipitaci kyseliny močové ve sběrných kanálcích, ledvinné pánvičce či ureteru s následným postižením toku moče. U urátové nefropatie dochází k precipitaci monosodného urátu v intersticiu ledvin. Nefropatie kyseliny močové souvisí s hyperurikurií, zatímco urátová nefropatie je sdružena s hyperurikémií. Riziko pro vznik litiázy z kyseliny močové může představovat také hyperurikurie a oligourie po hladovění. Při delším hladovění stoupá ketóza, laktacidémie, urikémie a klesá vylučování kyseliny močové. Po skončení hladovky urikémie klesá a vzniká masivní urikurie s přesycením moče kyselinou močovou. V tomto kritickém období je nutné dbát o zvýšení diuresy a o alkalizaci moče.
3.4 Interpretace vyšetření kyseliny močové v krvi a moči
3.4.1 Vliv věku na hladiny kyseliny močové v séru
Sérová hladina kyseliny močové je rozdílná v závislosti na věku a pohlaví. V dětském věku až do puberty jsou u chlapců a děvčat hodnoty urikémie stejné (180-240 µmol/l). V pubertě dochází u chlapců k vzestupu hladiny, která je již téměř stálá během života, zatímco u žen je tento posun zcela minimální. U žen jsou hodnoty urikémie mezi 20.- 45.rokem konstantní a o 30 - 60 µmol/l nižší než u mužů. V menopause se zvyšují a dosahují hodnoty jako u mužů. Nižší sérová hladina u žen ve srovnání s muži souvisí s vyšší exkreční frakcí urátu danou nižší postsekreční reabsorbcí v ledvinných tubulech.
3.4.2 Hyperurikémie
Různé metody ke stanovení kyseliny močové mohou poskytovat poněkud odlišné výsledky. Metoda s použitím enzymu urikázy je spolehlivější než ostatní (např.oxidačně-redukční metody), které mohou nadhodnotit hladinu kyseliny močové o 25 - 60 µmol/l. Ve většině studií jsou považovány za horní limit tyto hodnoty:
Příčiny hyperurikémie
Pool kyseliny močové a koncentrace v plazmě je výsledkem rovnováhy mezi příjmem purinů potravou, vlastní produkcí a vylučováním. Následující přehled ukazuje na základní patobiochemické příčiny hyperurikémie, ze kterých vyplývá interpretace zvýšených hladin kyseliny močové.
1.Zvýšený příjem exogenních purinů potravou
Vliv diety na hladiny kyseliny močové je zřejmý při zavedení bezpurinové diety na 5-7 dnů a následném stanovení vylučování. V této situaci je vylučování ekvivalentní endogenní produkci. Při bezpurinové dietě vyloučí zdravý člověk do moči maximálně 3,6 mmol kyseliny močové za 24 hodin. Při běžné stravě jsou hodnoty do 4,8 mmol/24 hod považovány za normální. Jestliže se na hyperurikémii podílí vysoký až excesivní přívod purinů stravou, dochází pak u pacientů po bezpurinové dietě k poklesu hladin urátu v plazmě a moči. I když se tento rozdíl může individuálně lišit, ze studií u zdravých kontrolních osob vyplývá, že pokles plazmatické hladiny urátu o více než 60 µmol/l a snížené vylučování o více než 1,2 mmol/24 hodin ukazují na významný podíl purinů ve stravě. Při zjištění výrazně zvýšeného vylučování kyseliny močové po bezpurinové dietě s hyperurikémií je tento nález indikátorem metabolických defektů a má vést k dalšímu vyšetření purinového metabolismu (viz zvýšená biosyntéza purinů).
2.Snížené vylučování kyseliny močové ledvinami
Hypourikurii nacházíme u pacientů s primární dnou (přibližně u 10% pacientů byla však zjištěna nadprodukce kyseliny močové). Významně snížená exkreční frakce kyseliny močové je typická pro FJHN. Ke sníženému vylučování kyseliny močové dochází též při chronickém renálním selhání, dále při ketoacidóze a laktátové acidóze, kde organické anionty inhibují sekreci urátu.
3.Zvýšený rozpad buněk
Zvýšený rozpad nádorových buněk, zejména po protinádorové léčbě vede ke značnému uvolnění purinů a tím i ke zvýšené tvorbě kyseliny močové. Jde nejčastěji o lymfoproliferativní a myeloproliferativní procesy. Zvláště kritické z hlediska litiázy kyseliny močové jsou stavy bezprostředně po nasazení chemoterapie cytostatiky, ozáření rentgenem. Zvýšený rozpad nukleoproteinů vedoucí k hyperurikémii je též u polycytémie, hemolytické anemie, hemoglobinopatie a u třetiny pacientů s psoriázou.
4.Zvýšený katabolismus purinů
K hyperurikémii vedou všechny stavy zvýšeného katabolismu či snížené syntézy ATP. Zvýšená degradace ATP probíhá u těchto stavů: podání fruktosy, svalová námaha, příjem etanolu, glykogenosy, hereditární intolerance fruktosy. Snížená syntéza ATP je charakteristická pro tkáňovou hypoxii a metabolické myopatie. Hyperurikémie se tak stává markerem energetické krize buňky.
5. Zvýšená biosyntéza purinů
Ke zvýšené biosyntéze kyseliny močové de novo dochází u dvou deficitů HPRT a při zvýšené aktivitě PRPPs
(viz část 3.2 této kapitoly).
6.Jiné příčiny
Hyperurikémie je přítomna u řady endokrinologických chorob (hypoparathyreóza, hyperparathyreóza). Hyperurikémie může být vyvolána léky např. nízkými dávkami kyseliny acetylsalicylové, pyrazinamidu, diuretik, dostavuje se též při otravě olovem. Poruchy metabolismu lipidů (nejčastěji hypertriacylglycerolémie), obesita a diabetes mellitus bývají spojeny s hyperurikémií.
3.4.3 Hypourikémie
Jako hypourikémie se označuje koncetrace kyseliny močové v séru nižší než 120 µmol/l. Z metabolických poruch vede k hypourikémii xanthinurie, dědičná renální hypourikémie a deficit purinnukleosidfosforylázy. Hypourikémii způsobují dále stavy se zvýšenou clearance kyseliny močové a s renálním tubulárním defektem. Nízké hodnoty kyseliny močové se nacházejí u syndromu nedostatečné sekrece antidiuretického hormonu (SIADH). Také terapie některými léky (např.vysoké dávky aspirinu, kyseliny askorbové, kortikosteroidy, probenecid) vede k hypourikémii.
4. Příprava pacienta k vyšetření purinového metabolismu
5. Laboratorní vyšetřovací postupy
Vzhledem k řadě faktorů ovlivňujících koncentrace kyseliny močové v krvi a v moči je nutné provádět odběr za pokud možno standardních podmínek. Hladina kyseliny močové může kolísat během dne až o 10%. K přesnému průkazu hyperurikémie se proto doporučuje vyšetření 2 x v průběhu týdne opakovat. Před vyšetřením je nevhodná strava s velkou purinovou zátěží. Léky ovlivňující oxidačně-redukční metody ke stanovení kyseliny močové (zejména kyselina askorbová při vyšetření v moči) by měly být vysazeny. V případech detailního vyšetření purinového metabolismu je nutné 3 dny před vyšetřením krve a moče držet nízkopurinovou dietu, tj. vynechat vnitřnosti a omezit maso na jednu porci děnně (cca 150 g). Vzhledem k analytickým interferencím metylovaných xanthinů je nutné vyloučit kávu, coca-colu, čaj. Na žádance k vyšetření purinového metabolismu je nutné uvést:
1) adekvátní klinickou informaci (epikrisu či diferenciálně diagnostický problém),
2) minulou a současnou léčbu (nezapomenout na transfúze krve),
3) úplnou rodinnou anamnézu a
4) při transportu biologického materiálu z větší vzdálenosti zaslat též vzorek krve od zdravé kontroly.
Vzhledem ke genetické heterogenitě vedoucí k širokému spektru klinických projevů je diagnostika obtížná. Stanovení diagnózy je možné jen na základě biochemického vyšetření. Po provedení samotného klinického vyšetření nelze v řadě případů diagnózu stanovit a ošetřující lékař je odkázán na výsledek specielního biochemického vyšetření. Život ohrožující akutní formy těchto defektů zdůrazňují nutnost včasné diagnostiky.
Uvedený vyšetřovací postup dokumentuje čtyři stupně vyšetřovaní.
1) Prvním krokem k diagnóze je stanovení hladin kyseliny močové v krvi a moči.
Z těchto vyšetření lze vyslovit často vysoké podezření na defekty s abnormálními hladinami kyseliny močové. Ke screeningovému vyšetření se dále používá metoda tenkovrstevné chromatografie z ranního vzorku nativní moče pro deficit adenylosukcinázy.
2) Dále následuje kvantitativní stanovení purinových metabolitů v krvi, v moči případně i v likvoru pomocí vysokoúčinné kapalinové chromatografie (HPLC). Metody HPLC jsou velmi výhodné, neboť umožňují detekci asymptomatických jedinců, stanovení enzymové aktivity a monitorování terapie allopurinolem.
3) Pro konfirmaci genetického defektu se provádí stanovení aktivity enzymů: APRT, HPRT, PNP, ADA v erytrocytech a ASase v lymfocytech.
4) DNA analýza nalézá uplatnění spíše ve výzkumné oblasti.
Pro diagnostiku lze s výhodou použít řady biochemickým markerů v moči, které jsou uvedeny v následujícím přehledu (Tab. 8.3).
| Onemocnění | Biochemický marker |
|---|---|
| deficit HPRT | hyperurikurie, hypoxantin |
| deficit APRT | adenin, 2,8-dihydroxyadenin |
| deficit XO | xantin, hypourikurie |
| deficit XO a SO | xantin, hypourikurie, thiosulfát, S-sulfocystein |
| deficit ADA | deoxyadenosin |
| deficit PNP | (deoxy)-inosin, (deoxy)-guanosin |
| deficit ASase | sukcinyladenosin (S-Ado), sukcinylaminoimidazolkarboxamidribosid (SAICar) |
| zvýšená aktivita PRPPs | hyperurikurie, hypoxantin |
| FJHN | výrazně snížená exkreční frakce kys.močové |
| renální hypourikurie | hyperurikurie |
6. Poznámky k léčbě a profylaxi
6.1 Možnosti léčby
6.2 Depistáž a zdravotně-sociální význam
Druhým faktorem je vybrání suspektních pacientů na základě specifických klinických projevů a cílená indikace k vyšetření. Podobně jako u jiných DMP je tato skupina onemocnění poměrně nová. Ve srovnání s jinými chorobami jsou DMP purinů vzácnější. Zkušenosti lékařů první linie i specialistů s klinickými projevy těchto defektů jsou zcela minimální. Navíc jsou neustále objevovány nové enzymové či transportní defekty kde popsaná symptomatologie je jen u malého počtu pacientů. Znalosti na úrovni biochemické a genetické tak často předbíhají úroveň klinickou. K podrobnějšímu seznámení lékařů s touto skupinou onemocnění dochází až později v postgraduálním období. Soubor těchto skutečností vede k tomu, že tato onemocnění nejsou často vzata do diferenciální diagnostické rozvahy a příslušná vyšetření nejsou indikována. Z těchto důvodů je velmi účelné rozšiřovat informace o nových diagnostických možnostech u těchto poruch a vytvářet těsnou spolupráci s klinickými pracovišti.
Deficit ADA představuje první onemocnění u kterého byla použita genová terapie. I když některé defekty podobně jako jiné dědičné metabolické poruchy nelze terapeuticky ovlivnit a kausální terapie není známa, přesné stanovení diagnózy umožní předejít dalšímu zbytečnému a finančně náročnému vyšetřování a identifikovaná rodina může využít výhod prenatální diagnostiky.
Klinické následky nadprodukce kyseliny močové lze úspěšně léčit podáváním allopurinolu. Příkladem je deficit APRT, kde vedle podávání allopurinolu, který
inhibuje xantinoxidázu, je také doporučována nízkopurinová dieta a udržování vyšší diuresy. Je třeba omezit obilné produkty, luštěniny (zejména čočku), které obsahují vyšší obsah adeninu. Podávání allopurinolu je třeba monitorovat neboť při vyšších dávkách hrozí riziko xantinové nefropatie. U řady chorob není možná kausální terapie pro nejasnou patogenezi onemocnění.
V efektivním využití diagnostických metod a včasné diagnostice nových pacientů hrají roli dva faktory. Prvním je dostupnost vyšetřovacích metod. Zkušenosti zahraničních pracovišť ukazují vzhledem k vzácnějšímu výskytu těchto onemocnění na účelnost sdružení metod ve specializovaných centrech. Při suspektním nálezu při screeningu je možné provést okamžitě další následná vyšetření, zejména u akutních stavů. Na druhé straně u dědičných metabolických poruch (DMP) purinů lze s výhodou použít vyšetření kyseliny močové, dostupné v téměř každé biochemické laboratoři, k prvnímu základnímu a též screeningovému vyšetření.
| dna (zejména) v mladém věku, u ženy v premenopause |
| onemocnění ledvin spojené s hyper- či hypourikémií |
| automutilace |
| imunodeficience (zvláště syndrom kombinovaného těžkého imunodeficitu, postižení buněčné imunity) |
| nejasná psychomotorická retardace či hypotonie či křeče |
| svalová bolest po pohybu |
| hluchota spojená s hyperurikémií |
| hyperurikémie (zejména nejasné etiologie, s vyloučením sekundárních příčin) |
| hypourikémie |
7. Doporučená literatura:
Již od poloviny 80.let můžeme zaznamenat snahy o algoritmizaci tyroidálních laboratorních vyšetření s úmyslem vhodně vybrat z jejich široké palety. Vznikaly i stručné přehledy a jednoduché tabelární pomůcky, jejichž zjevným nedostatkem bývá skutečnost, že s ohledem na rozdílnou prevalenci postihují vesměs jen nejčastější tyreopatie a dále to, že se zabývají převážně jen stanovením hormonů.
Starší návrhy i z tohoto pohledu už překonal současný prudký rozvoj neizotopových imunochemických metod. Tato kapitola respektuje dnešní vyšší úroveň poznání a spolu s ní rozšiřující se nabídku dostupných laboratorních vyšetření.
1. Biochemie tyreoidálních hormonů a dalších látek
Výchozím bodem tvorby hormonů štítné žlázy je proteosyntéza tyreoglobulinu (TG), glykoproteinu, jehož tyrosylové skupiny se za katalýzy jódtransferázou jódují molekulárním jódem J2 v poloze 3 resp. 3 a 5. Monojódfenylová nebo dijódfenylová část (donor) se váže éterovou vazbou na další jódovanou tyrosylovou skupinu (akceptor) za vzniku příslušné jódtyroninové struktury stále ještě vázané jako součást peptidového řetězce tyreoglobulinu. Ten přestupuje v této podobě z buňky do lumina folikulu, do tzv. koloidu, kde se skladuje. Jodidové anionty jsou buňkami štítné žlázy z cirkulace aktivně vychytávány, patrně kotransportem s Na+, a koncentrovány v cytoplazmě asi 25násobně. Klíčovým enzymem katalyzujícím oxidaci jodidových aniontů přinášených cirkulací na molekulární jód, je peroxidáza (jodidperoxidáza, tyreoperoxidáza, TPO). Působením hypofyzárního hormonu tyreotropinu (TSH) se zvyšuje akumulace jódu v buňce štítné žlázy a na podnět TSH se také tyreoglobulin vrací z lumina folikulu zpět do tyreocytu, kde se štěpí lysosomálními proteázami a uvolněný jódovaný tyronin přestupuje do cirkulace. Tyreoidální hormony se tedy tvoří kontinuálně, skladují se ve formě prohormonu, tj. jódovaného tyreoglobulinu, a na podnět centrálních regulačních mechanismů se pouze rychleji nebo pomaleji uvolňují. Za fyziologických okolností štítná žláza produkuje převážně T4 (až 100x více než T3). T3 je však podstatně účinnější než T4, takže tyroxin se někdy také označuje za prohormon. V periferních tkáních se T4 přibližně z jedné třetiny dejóduje 5'-dejodázou na směs neaktivního 3,3',5'-T3 (tzv. reverzní T3, rT3) a aktivního 3,3',5-T3.
V krevním oběhu se T3 i T4 transportují ve vazbě na transportní bílkoviny: na tyroxin vázající globulin (thyroxin binding globulin, TBG, ze 60 až 70 %), na prealbumin (transthyretin, thyroxin binding prealbumin, ze 30 %) a na albumin (nepatrný zbytek). Číselné údaje o relativních podílech vazby T3 a T4 na jednotlivé transportní bílkoviny se v literatuře velmi liší. Vazba T3 na transportní bílkoviny je o něco slabší než T4. Proto kromě vázané formy T3 cirkulují ještě asi 0,3 % volného T3 (free T3, FT3) a kromě vázané formy T4 cirkulují jen asi 0,03 % volného T4 (free T4, FT4). Pouze volné formy mohou vstupovat do cílových buněk a být hormonálně aktivní. Mezi vázanými a volnými formami obou hormonů však existuje dynamická rovnováha. Rozdílnost biologických poločasů obou hormonů v plazmě se vysvětluje také existencí jejich volných forem, protože jen ty mohou být odbourávány v játrech, ledvinách a svalech: pro T4 je to 7 dní, zatímco pro T3 zhruba jeden den. Pod názvem celkový T3 (total T3, TT3) a celkový T4 (total T4, TT4) se rozumí součet koncentrací vázané a volné formy příslušného hormonu.
2. Regulace sekrece hormonů štítné žlázy
Nabídka hormonů štítné žlázy cílovým tkáním je tedy závislá na stavech a regulačních mechanismech několika úrovní:
3. Patobiochemie některých poruch
Kongenitální hypotyreóza patří mezi vývojové poruchy s relativně vysokou incidencí. U novorozence se neprojevuje žádnými výraznými symptomy a přitom její včasná diagnostika a léčba je životně důležitá. Pro detekci poruchy byly proto vyvinuty screeningové programy zahrnující stanovení TSH a někdy též T4 v krvi odebrané z patičky pátého až sedmého dne po narození. Novorozenecký screening kongenitální hypotyreózy využívá tzv. supersenzitívní stanovení TSH (viz dále) v eluátu z vysušené kapky krve na filtračním papíře.
Zvýšená sekreční aktivita štítné žlázy a/nebo nadměrná nabídka volných forem tyreoidálních hormonů vede k hypertyreóze. Nejčastěji se jedná o primární postižení štítné žlázy, které může mít celou řadu forem, jako je např. Gravesova-Basedowova nemoc (difúzní, toxická struma), toxický adenom, T3 tyreotoxikóza. Sekundární hypertyreózy mohou vznikat např. při Hashimotově autoimunní tyreoiditidě, při subakutní tyreoiditidě, u folikulárních karcinomů štítné žlázy nebo i ektopických karcinomů, u adenomů hypofýzy, apod.
Zánětlivá onemocnění štítné žlázy se dělí na autoimunní Hashimotovu (chronickou lymfocytární) tyreoiditidu a na neautoimunní, virovou (subakutní) thyreoiditidu.
Podrobnosti o etiopatogenezi, klinickém obrazu a léčbě dysfunkcí, nádorů a zánětů štítné žlázy je možno najít téměř v každé učebnici vnitřního lékařství nebo endokrinologie (viz též seznam doporučené literatury v závěru této kapitoly). Poměrně velký počet těchto patologických stavů lze dnes s vysokou spolehlivostí diagnostikovat. Je také možné identifikovat, charakterizovat a průběžně sledovat změny, k nimž dochází při konzervativní nebo po radikální léčbě. Slouží k tomu, mimo jiné, funkční vyšetření a laboratorní stanovení jednotlivých analytů v krevním séru, nejlépe opakovaná v časové ose. K jejich racionálnímu výběru může přispět i následující přehled.
4. Laboratorní diagnostické metody
4.1. Ukazatelé tyreoidální dysfunkce
V indikaci vyšetření platí, že jde o metodu první volby při podezření na primární hypotyreózu nebo na hypertyreózu. Tímto vyšetřením lze sledovat substituční terapii pomocí T4 nebo supresivní terapii. Je doplňkovým vyšetřením ke stanovení TT4 nebo FT4 u sekundární hypotyreózy a ke stanovení FT4 (TT4) a FT3 (TT3) při podezření na rezistenci na tyreoidální hormony. Vyšetřuje se také u hypercholesterolémie a u hyperprolaktinémie. Vysoce citlivé metody stanovení TSH ( tzv. metody "třetí generace", tj. s mezí detekce pod 0,01 mU/L) se používají pro screening kongenitální hypotyreózy ze suché kapky krve novorozence.
4.1.2. FUNKČNÍ TEST S TRH
4.1.3. TYROXIN celkový (TT4) a volný (FT4) v séru
Voet D., Voetová J.G: Biochemie. Victoria Publishing, Praha 1995
Simmonds H.A.: Purine and pyrimidine disorders. In: Holton J.B. (eds): The inherited metabolic diseases. 2nd ed. Churchill Livingstone, Edinburg, 1993: 297-349
Simmonds H.A.: 2,8-Dihydroxyadenine lithiasis. Clin Chim Acta, 1986, 160:1O3-108
Simmonds H.A., Sahota A.S., Van Acker K.J.: Adenine phosphoribosyltransferase deficiency and 2,8-dihydroxyadenine lithiasis. In: Scriver C.R., Beaudet A.L., Sly S., Valle D. (eds): The metabolic basis of inherited disease. 6th edn. McGraw-Hill, New-York, 1029-1044
Šebesta I.,Krijt J., Pavelka K., Maly J., Simmonds H.A., McBride M.B.: Familial juvenile hyperuricaemic nephropathy in adolescents. Adv Exp Med Biol 370, 73-76, 1995
Šebesta I., Shobowale M., Krijt J., Simmonds H.A.: Screening tests for adenylosuccinate lyase deficiency.
Screening 4, 117-124, 1995
Šebesta I., Krijt J., Schneiderka P.: The importance of uric acid examination. Sborník lékařský, 95, 1995, 4, 383-389
Šebesta I.: Dědičné poruchy metabolismu purinů a pyrimidinů. V knize: Hyánek J. a kol. "Dědičné metabolické poruchy" str. 149-161., Avicenum,Praha, 1991
Stone T.W., Simmonds H.A.: Purines: basic and clinical aspects. Kluwer, London 1991
Pavelka K jr.: Krystalické artropatie. V knize: Trnavský K. a kol. "Vybrané kapitoly z revmatologie".
IPVZ Praha 1988
Pallela T., Fox I.H.: Hyperuricemia and gout. In: Scriver C.R., Beaudet A.L., Sly S., Valle D., (eds): The metabolic basis of inherited disease, 6th edn. McGraw-Hill, New York, 1989, 965-1007
Stout J.T., Caskey C.T.: Hypoxanthine-guanine phosphoribosyltransferase deficiency: The Lesch-Nyhan syndrome and gouty arthritis. In: Scriver C.R., Beaudet A. L., Sly W.S., Valle D. (eds): The metabolic basis of inherited disease. 6th ed. McGraw-Hill, New York, 1989, 1007-28
Duncan H., Dixon A. Stj.: Gout, familial hyperuricaemia, and renal disease. Q.J.Med. 29, 1960, 127-136
Calabrese G., Simmonds H.A., Cameron J.S., Davies P.M.: Precocious familial gout with reduced fractional excretion of urate and normal purine enzymes. Q. J. Med. 75, 1990, 441-450
Puig J. G., Miranda M.E., Mateos F.A., Picazo M.L., Lopez M., Ortiz J.: Familial nephropathy and gout: which comes first? Adv. Exp. Med. Biol. 309A, 1991, 195-198
McBride M. B., Raman V., Ogg, C.S., Chantler C., Cameron J.S., Duley J.A., Simmonds H.A.: A new kindred with familial juvenile gouty nephropathy. Adv. Exp. Med. Biol. 309A, 1991, 191-194
Biochemická vyšetření u chorob štítné žlázy
Autor kapitoly: doc.MUDr.Petr Schneiderka CSc., Ústav klinické biochemie VFN a 1.LF UK Praha
V buňkách folikulů štítné žlázy se tvoří tyroxin (3,3',5,5'-tetrajódtyronin, T4) a trijódtyronin (3,3',5-trijódtyronin, T3). Strukturálně jde o jódované deriváty aromatické aminokyseliny tyroninu, složené ze dvou zbytků tyrosinu. Mnohostranné biochemické účinky těchto hormonů lze charakterizovat jako zvýšení metabolické aktivity spojené s vyšší spotřebou kyslíku a s produkcí tepelné energie. Jejich základní význam pro růst a vývoj organizmu souvisí patrně s všeobecnou stimulací syntézy RNA a proteosyntézy. Parafolikulární neboli C-buňky štítné žlázy kromě toho syntézují hormon kalcitonin (tyreokalcitonin, TC), zapojený do soustavy hospodaření organizmu s vápníkem.
 Centrální řízení sekreční aktivity štítné žlázy začíná u hypotalamu
(obr. 9.1.).
Zde se uvolňuje spouštěcí faktor ze skupiny neurosekrečních hormonů, tyreoliberin (thyreotropin releasing hormon, TRH). Ten podněcuje sekreci tyreotropního hormonu (thyroid stimulating hormon, TSH) v adenohypofýze. Somatostatin naopak sekreci TSH inhibuje. TSH dopravený krevní cestou ke štítné žláze urychluje po vazbě na své specifické receptory na membráně tyreocytu vstup jódovaného tyreoglobulinu z koloidu folikulu do buňky, jeho proteolytické štěpení, a tím i uvolnění tyroidálních hormonů do cirkulace. Mezi koncentrací tyroidálních hormonů v krvi a sekrecí TSH existuje negativní zpětná vazba. T3 a T4 pronikají do cílové buňky bez specifického receptoru (podobně jako steroidní hormony) a mechanismus jejich účinku je zprostředkován cyklickým AMP.
Centrální řízení sekreční aktivity štítné žlázy začíná u hypotalamu
(obr. 9.1.).
Zde se uvolňuje spouštěcí faktor ze skupiny neurosekrečních hormonů, tyreoliberin (thyreotropin releasing hormon, TRH). Ten podněcuje sekreci tyreotropního hormonu (thyroid stimulating hormon, TSH) v adenohypofýze. Somatostatin naopak sekreci TSH inhibuje. TSH dopravený krevní cestou ke štítné žláze urychluje po vazbě na své specifické receptory na membráně tyreocytu vstup jódovaného tyreoglobulinu z koloidu folikulu do buňky, jeho proteolytické štěpení, a tím i uvolnění tyroidálních hormonů do cirkulace. Mezi koncentrací tyroidálních hormonů v krvi a sekrecí TSH existuje negativní zpětná vazba. T3 a T4 pronikají do cílové buňky bez specifického receptoru (podobně jako steroidní hormony) a mechanismus jejich účinku je zprostředkován cyklickým AMP.
- nitrobuněčná proteosyntéza tyreoglobulinu + nabídka jódu a jódace,
- centrální hypotalamo-hypofyzární řízení sekreční aktivity (uvolňování hormonů z depo v koloidu),
- koncentrace a funkční stav transportních bílkovin pro transport krví a pro rovnováhu volné a vázané formy,
- a konečně degradace hormonů v játrech, ledvinách a ve svalech.
Vliv všech těchto faktorů je třeba brát v úvahu zejména při etiopatogenetických rozvahách u chorob štítné žlázy.
Syndrom vyvolaný nízkými hladinami volných hormonů štítné žlázy se nazývá hypotyreóza. Primární hypotyreózy lze rozdělit podle etiologie na kongenitální, endemické (z nedostatku jódu), autoimunní, z fyzikálních a chemických vlivů (chirurgický zásah, ionizující záření, strumigeny, tj. zčásti i iatrogenní) a jako součást nebo následek jiných zánětlivých nebo infiltračních onemocnění. Sekundární hypotyreózy (někdy též "centrální") vznikají při postižení hypotalamu nebo adenohypofýzy, a to vrozenou poruchou tvorby nebo sekrece příslušných hormonů, nebo v důsledku úrazu, chirurgického zásahu, ozáření, nádoru nebo poruchy krevního zásobení.
4.1.1. TYREOTROPIN, TSH v séru
Jeho koncentrace v séru je nepřímo úměrná koncentraci T4. Klinický význam vyšetření spočívá v tom, že za předpokladu normální funkce hypotalamo-hypofyzární osy odráží hladina TSH dostupnost T4 pro tkáně. Výrazně zvýšené hodnoty TSH jsou signifikantní pro primární hypotyreózu. U hypotalamických příčin hypotyreózy mohou být koncentrace TSH nízké, normální i mírně zvýšené. Hypotalamicky podmíněná hypotyreóza s nedostatkem tyreoliberinu může být spjata se sekrecí imunochemicky aktivního, ale biologicky neúčinného TSH. Běžnými imunochemickými metodami tedy stanovíme dokonce vysoké koncentrace tohoto modifikovaného TSH, protože se v cirkulaci pomaleji odbourává, výsledek však neodpovídá stimulaci sekrece tyroidálních hormonů.
Jde o tzv. TRH loading test, jehož klinický význam spočívá v tom, že odráží sekreci TSH z hypofýzy po p.o., i.v. nebo intranasální stimulaci hormonem tyreoliberinem (TRH). Vyšetření se indikuje u "centrální" hypotyreózy, dále při podezření na sekundární hypertyreózu při selektivní hypofyzární rezistenci na tyreoidální hormony, u nádorů produkujících TSH, nebo u generalizované rezistence na tyreoidální hormony. Tímto testem lze též vyjasnit podezření na interference při samotném stanovení TSH, které vzniká např. při nálezu normálních hodnot TSH u hypertyreózy.
Jeho koncentrace jsou ukazatelem aktuální sekrece hormonu štítnou žlázou. Vysoké koncentrace T4 u Gravesovy-Basedowovy choroby naznačují nebezpečí re-lapsu po ukončení konzervativní léčby. Hladiny FT4 (TT4) slouží k monitorování léčby tyroxinem, protože vypovídají o dostupnosti hormonu tkáním. Je třeba mít na paměti, že koncentrace tyroidálních hormonů může být ovlivněna řadou faktorů (viz výše v odstavci Biochemie), především rovnováhou mezi jejich sekrecí a odbouráváním a rovnováhou mezi volnými a vázanými formami v cirkulaci, resp. stavem příslušných transportních proteinů. Výhodou FT4 je z tohoto hlediska menší zá-vislost na patologicky a farmakologicky indukovaných změnách TBG. Někdy se do-poručuje z hodnoty T4 a z T3-Uptake (v procentech, viz dále) kalkulovat index volného tyroxinu, free thyroxin index, FTI, a to podle vzorce:
| FTI = | koncentrace T4 x % T3 Uptake |
| --------------------------------------------- | |
| 100 |
Indikací je opět několik. Při podezření na primární hypotyreózu nebo na hypertyreózu jde o doplňující vyšetření vedle TSH. Jde o prioritní vyšetření při léčbě hypertyreózy, neboť sekrece TSH může být ještě dlouhodobě potlačena. Je to také výhodný nástroj k monitorování léčby tyroxinem, k její jemné modifikaci a ke sledování compliance. Volný T4 lze použít i pro screening kongenitální hypotyreózy.
4.1.4. 3,3',5-TRIJÓDTYRONIN celkový (TT3) a volný (FT3) v séru
Při hypertyreóze odráží hladina TT3 nebo FT3 v séru sekreční aktivitu štítné žlázy. Podle některých autorů je informační hodnota stanovení TT3 a FT3 totožná. Také zde vysoká koncentrace hormonu u Gravesovy-Basedowovy choroby naznačuje možnost relapsu po ukončení léčby. Vysoké hladiny T3 při léčbě tyroxinem poukazují na autonomní hyperaktivitu štítné žlázy. Koncentrace T3 v cirkulaci odpovídá dejódaci T4 zejména v periferních tkáních.
Indikační oblastí jsou vyšetření hypertyreózy, vyšetření závažnosti primární hypotyreózy, diferenciální diagnostika nízkých koncentrací TSH a podezření na autonomní sekreci během léčby tyroxinem.
4.1.5. REVERZNÍ T3 (3,3',5'-T3, rT3) v séru
Klinický význam spočívá v tom, že jde o nepřímý ukazatel přeměny T4 na T3 a o ukazatel další dejódace, tj. vzniku dijódtyroninu. Z toho vyplývá i indikace, tj. vyšetření neznámých příčin nízké koncentrace TT3 a/nebo TT4 (FT4).
4.1.6. TYREOGLOBULIN, TG v séru
Stanovení tyreoglobulinu v séru je ukazatelem uvolňování TG z aktivní, zánětlivé, nebo nádorově pozměněné tkáně štítné žlázy. U nádorů produkujících TG hraje patrně rozhodující roli poškozená mezibuněčná integrita. Hlavními indikacemi jsou tedy monitorování pacientů po totální tyreoidektomii pro diferencovaný karcinom, detekce adenokarcinomů neznámého původu, diagnostika hypertyreózy neznámé etiologie.
4.1.7. ALFA PODJEDNOTKA HCG (alfa-HCG) v séru
Vyšetření ilustruje obecně sekreci alfa podjednotek hypofyzárních glykoproteinových hormonů, tedy i TSH. Indikováno je k ověření jakosti sekrece TSH při diferenciální diagnostice rezistence na tyreoidální hormony a při podezření na nádor produkující TSH.
4.1.8. KALCITONIN, tyreokalcitonin v séru
Kalcitonin v séru je ukazatelem sekreční aktivity parafolikulárních C-buněk štítné žlázy. Vyšetření je indikováno při diagnostice a sledování medulárních nádorů štítné žlázy, mnohočetné endokrinní neoplasie a neuroendokrinních nádorů. Vyšetřuje se bazální koncentrace a koncentrace po podání pentagastrinu nebo vápenatých solí.
4.2 Poruchy transportu tyreoidálních hormonů
4.2.1. TYROXIN VÁZAJÍCÍ GLOBULIN, TBG v séru
Klinický význam vychází ze skutečnosti, že se jedná o kvantitativně nejvýznamnější přenašeč tyreoidálních hormonů v krvi. Vysoké koncentrace TBG v séru mohou být podmíněny geneticky, ale nalézají se i u žen v průběhu těhotenství a při hormonální antikoncepci s použitím estrogenových kontraceptiv, a dále jsou běžné u novorozenců. Nízká koncentrace TBG může být také vrozeným jevem, existuje však celá řada dalších příčin jeho nedostatku: malnutrice, malabsorpce, stavy se ztrátami nebo vysokým katabolismem bílkovin, poruchy jaterní syntézy, působení androgenů a vysokých dávek kortikoidů. Malá přenosová funkce TBG pro tyreoidální hormony se může projevit nejen při jeho nízké koncentraci, ale (snad i častěji) při obsazení jeho transportní kapacity léčivy.
Koncentrace TBG v séru se vyšetřuje při nálezu neočekávaných hodnot T3 a T4 ve srovnání s klinickým stavem a s koncentrací TSH, nebo při diskrepancích mezi koncentrací volného a vázaného T4. Podobně i při podezření na nízkou afinitu TBG (geneticky podmíněné varianty, vazba léčiv a pod.).
4.2.2. PREALBUMIN, transthyretin v séru
Jedná se o druhý nejvýznamnější přenašeč tyreoidálních hormonů v krvi. Klinický význam vyšetření je analogický významu vyšetření TBG.
Koncentrace prealbuminu se stanovuje při zkoumání příčin nevysvětlitelně vysoké hladiny T4 a odhalování původu rozporu mezi koncentracemi volného a vázaného podílu T4. Mimo oblast tyreoidální diagnostiky je třeba připomenout, že se jedná o citlivý ukazatel jaterní proteosyntézy (viz kapitola 5, část 5.2).
4.2.3. VAZEBNÁ KAPACITA TRANSPORTNÍCH BÍLKOVIN, T-UPTAKE
Klinický význam a indikace tohoto vyšetření jsou stejné jako u TBG a TBPA, informace se však týká sumy všech vazebných bílkovin. V současnosti se provádí nejčastěji tak, že vzorek séra se nasytí známým množství T3 a v dalším kroku se stanoví nenavázaný podíl T3 (heterogenní kompetitivní imunoanalýza s dvojí protilátkou, např. systém TU ACS:180 Ciba-Corning Diagnostics, využívající chemiluminiscenční imunoanalýzy). Výsledek se vyjadřuje obvykle zlomkem nebo v %.
4.3 Ukazatelé autoimunních chorob štítné žlázy
4.3.1. PROTILÁTKY PROTI PEROXIDÁZE, TPOAb v séru
Tyto protilátky byly dříve označovány jako antimikrosomální protilátky, TMAb. Odhalují přítomnost autoimunního onemocnění a tím i možné riziko pro vznik dysfunkce štítné žlázy. Pro tento účel mají TPOAb vyšší informační hodnotu, než TGAb (viz dále).
Vyšetření je indikováno u strumy neznámé etiologie, k diferenciální diagnostice hypertyreózy neznámé etiologie, dále při vzestupu TSH bez zjevných příčin, u polyglandulárních autoimunních chorob a jiných nemocí často spojených s tyreoidální dysfunkcí a preventívně u příslušníků rodin s prokázaným výskytem autoimunních zánětů štítné žlázy. Vyšetření je vhodné také pro screening rizika zánětů štítné žlázy u těhotných a matek po porodu a doporučuje se i po terapii léky, které mohou nepříznivě ovlivnit štítnou žlázu nebo celý imunitní systém. Naše vlastní dlouholeté zkušenosti s vyšetřováním TPOAb (TMAb) a TGAb tyto indikace potvrzují zvláště u mladistvých s chronickou lymfocytární tyreoiditidou.
4.3.2. PROTILÁTKY PROTI TYREOGLOBULINU, TGAb v séru
Také tyto protilátky odhalují přítomnost autoimunního onemocnění. Současně mohou vysvětlit nesprávné výsledky (interference) při stanovení samotného TG. Rostoucí hodnoty TGAb po totální tyreoidektomii pro diferencovaný karcinom ukazují na možné metastázy.
Indikuje se jako doplňkové vyšetření ke stanovení tyreoglobulinu, ke sledování diferencovaných karcinomů štítné žlázy a stavu po totální tyreoidektomii.
4.3.3. PROTILÁTKY PROTI TSH-RECEPTORŮM, TRAb v séru
Cirkulující TRAb jsou známkou přítomnosti imunoglobulinů, které se váží na TSH receptory tyreocytů, a které mohou jak stimulovat, tak inhibovat (blokovat) aktivitu štítné žlázy. Poukazují na riziko vzniku tyreoidální dysfunkce, riziko opakovaného rozvoje Gravesovy-Basedowovy choroby a na vysoké riziko endokrinní oftalmopatie.
Jejich stanovení se indikuje při diferenciální diagnostice hypertyreózy (autoimunního a neautoimunního původu a vzniklé na podkladě rezistence vůči tyreoidálním hormonům) a sledování jejich léčby. Je to také vhodné vyšetření při podezření na endokrinní oftalmopatii, při diferenciální diagnostice hypotyreózy a při všech abnormálních klinických nálezech s podezřením na přítomnost blokujících nebo stimulujících protilátek.
4.4 Metodické poznámky
Převážná většina popsaných stanovení patří do široké skupiny imunochemických kvantitativních metod (viz též kapitola 11, části
1.7, 1.8 a 7.2). Stanovení celkových koncentrací T3 a T4 předpokládá uvolnění jejich vázaných, kvantitativně významnějších forem z vazby na bílkoviny (např. roztokem NaOH). Výsledek tedy ovlivňují m.j. i koncentrace vazebných bílkovin a účinnost uvolňovacího kroku.
Stanovení volných forem, tedy FT3 a FT4, je komplikováno tím, že se měří koncentrace přibližně o tři řády nižší, než u celkových. To vše v biologickém materiálu, kde, jak bylo výše uvedeno, existuje dynamická rovnováha mezi volnou a vázanou formou hormonů. Existují metody oddělující volnou frakci a metody pracující s plným sérem. Převažují ty druhé, protože způsoby separace (dialýza, ultrafiltrace, gelová chromatografie) jsou technicky, materiálově i časově náročné.
Spolu s interindividuální variabilitou to má za následek relativně široké rozmezí fyziologických hodnot (referenčních intervalů) tyreoidálních hormonů. Přesto, že pro stanovení těchto hormonů existují referenční metody (plynová chromatografie s hmotností spektrometrií), jimiž jsou testována kontrolní séra, různé imunochemické reakční systémy mohou poskytovat poněkud odlišné výsledky.
5. Závěr
6. Doporučená literatura:
1. Hlavní vrozené poruchy sexuální diferenciace a hormonální sekrece
Testikulární organogeneze je rychlejší než ovariální. Produkce testosteronu (T) začíná již v 9. týdnu spolu s AMH ( glykoprotein primitivních Sertolliho buněk, antimüllerian hormone), kdežto histologická diferenciace ovarií je patrná až mezi 17. - 20. týdnem. Přitomnost T a AMH určuje v dalším vývoji histologickou diferenciaci interního genitálu. Embryogeneze externího genitálu a terminální části zažívací trubice je v časném stádiu tj. před sexuální diferenciací společná. Po 8. týdnu dozrává u normálního mužského plodu enzymový systém ( 5a-reduktáza) konvertující T na mnohem účinnější dihydrotestosteron ( DHT). Ten po vazbě na jaderný androgenní receptor kompletizuje vývoj externího mužského genitálu. Poruchy mohou nastávat při nedostatku syntézy či redukce T nebo při zvýšené produkci antiandrogenů (např. progesteronu).
U genotypicky ženského fétu, tj. za nepřítomnosti sekrece testosteronu, nedochází k morfogenezi mužského typu externích genitálií. Rozhodující pro případné defekty je 14. týden, kdy je při absenci androgenů ukončen základní vývoj ženských genitálií. Při virilizaci po 14. týdnu dochází jen k relativně menším změnám (clitoris), kdežto při dřívější androgenizaci může být zevní genitál u ženských plodů malformován zásadním způsobem.
Výčet možných poruch změn karyotypu nebo různě podmíněných malformací interního a externího genitálu přesahuje téma kapitoly. Stručně je třeba uvést, že v diagnostickém algoritmu je prvotní morfologická přítomnost externích gonád (testes nebo jejich rudimentů), které signalizují základní mužský fenotyp. Pomineme-li karyotypicky založené odchylky (pravý hermafroditismus, mozaikové gonadální dysgeneze), pak jsou nejdůležitější a z hlediska biochemických syndromů nejčastější tyto vrozené poruchy:
1.1 U ženského fenotypu (absence externích gonád a přítomnost abnormálních struktur Müllerova vývodu)
1.1.1.1 Vzácný mitochondriální defekt 20,22 desmolázy ( P450scc)
1.1.1.2 Defekt 3ß-hydroxysteroid-dehydrogenázy a 5-4 isomerázy.
1.1.1.3 Defekt 17a-hydroxylázy (5 v obr. 10.1).
1.1.1.4 Defekt 21-hydroxylázy (3 v obr. 10.1)
1.1.1.5 Defekt 11ß-hydroxylázy (4 v obr. 10.1)
1.1.2 Virilizační syndromy
1.2 Pravý hermafroditismus a mozaikové karyotypy
1.3 U mužského fenotypu
1.3.1 Kongenitální absence hormonu proti strukturám ductus Mülleri (AMH). Biochemická diagnostika není možná, steroidogeneze je v normě.
1.3.2 Bilaterální kryptorchismus. Bývá normální neonatální koncentrace sexagenů a gonadotropinů. Při anorchii jsou naopak velmi vysoké plazmatické FSH a LH, nízký T a negativní HCG stimulační test.
1.3.3 Ageneze nebo hypoplazie Leydigových buněk. Obraz je podobný jako u předchozího stavu, ale FSH je v normě, rozhodne testikulární biopsie.
1.3.4 Receptorové poruchy v účinku androgenů (typ I s normálním DHT a vysokým LH a typ II s nízkým DHT a normálním LH).
1.3.5 Poruchy biosyntézy testosteronu - enzymové defekty
(viz část 3.3 této kapitoly).
1.3.6 V rámci kongenitálního panhypopituitarismu, kdy je nízký STH, hypoglykémie a úplná absence LH a FSH.
2. Syntéza a metabolismus nadledvinkových steroidů a sexagenů
Úvodní přeměna cholesterolu na pregnenolon je společná nadledvinkám i gonádám (Obr. 10.1). Většina enzymů je spojena s komplexem cytochomu P450, působí zde celkem 9 oxidačních kroků a na schématu jsou uvedeny jejich obvykle používané názvy. Čistě nadledvinkového původu jsou tyto steroidy: 11-deoxykortikosteron (DOC), kortikosteron, aldosteron, 11-deoxykortizol a kortizol. Ostatní steroidy se mohou tvořit i mimo nadledvinky. Steroidní hormony se při nadprodukci nemohou hromadit v sekrečních tkáních, takže je intenzita jejich syntézy většinou úměrná plazmatickým koncentracím. Hlavním představitelem glukokortikoidní (glk) sekrece je u člověka kortizol, u jiných živočišných druhů (hlodavci) kortikosteron. Mineralokortikoidní aktivitu má především aldosteron, slabší pak vykazují 11- a 18-hydroxy-DOC, kortikosteron a kortizol. Nadledvinkové androgeny jsou D5-steroidy. Především jde o dehydroepiandrostendion (DHEA), který se v cirkulaci vyskytuje většinou jako sulfátový konjugát (DHEAS), zatímco volná frakce DHEA tvoří jen asi 0,2-0,3%. Tyto androgeny jsou velmi slabé, ale mohou se po konverzi v řadě tkání - včetně kůry nadledvin - přes androstendion nebo androstendiol měnit na testosteron (T). U mužů tvoří produkce T z nadledvinek jen kolem 1-2% produkce z testes, u žen představuje nadledvinkový T 50% celkové produkce. Estrogeny obecně vznikají transformací androgenů aromatázami přítomnými především v gonádách, v nadledvinkách, ale i např. tukové tkáni. Testosteron se mění na estradiol, androstendion a estron. U ženy je v produktivním věku periferní a nadledvinková produkce estrogenů zanedbatelná a na významu nabývá až po menopauze nebo ovarektomii.
Asi 80 - 90% kortizolu (ale také dalších příbuzných steroidů) je v plazmě vázáno na glykoprotein nazvaný corticosteroid binding globulin, transkortin (CBG), jehož plazmatická koncentrace je kolem 30 mg/l. Asi 10% kortizolu se váže na albumin, malá část na a1-kyselý glykoprotein (orosomukoid). Aldosteron je vázán slaběji (asi z 50%) na albumin a asi z pětiny na CBG. DHEA a androstendion z nadledvin mají slabou afinitu k albuminu, naopak vazba DHEAS je velmi vysoká a proto jsou jeho plazmatické koncentrace řádově téměř 103 x vyšší než u volné frakce DHEA. Specifickým nosičem sexagenů je sex hormone binding globulin (SHBG) a jeho afinita ke steroidům klesá v pořadí dihydrotestosteron (DHT), T, androstendiol, estradiol (E2) a estron. Jaterní syntézu vazebných bílkovin a jejich afinitu významně ovlivňuje řada faktorů jak hormonálních, tak i metabolických, nutričních a dalších.
Katabolismus steroidů se odehrává hlavně v játrech a to buď zvýšením jejich polárnosti (konjugace na sulfáty a glukuronidy) a vyloučením ledvinami, nebo snížením biologické účinnosti dalšími redukcemi a hydroxylacemi steroidního skeletu. Kortizol je proti ostatním steroidům díky své pevné vazbě na CBG nejvíce chráněn před degradací a má tedy nejdelší biologický poločas. Sumu intermediárních molekul syntézy glk, jejich redukovaných metabolitů a příslušných glukuronidů či sulfátů lze vyšetřit jako tzv. 17-hydroxysteroidy (Porter-Silberovy chromogeny, 17-OH-CS). Toto vyšetření je dnes většinou nahraženo vyšetřením volného kortizolu v moči. 17-ketogenní steroidy (17-KS) zahrnují hlavně metabolity 17-OH-progesteronu a týkají se tedy širšího spektra steroidů než 17-OH-CS. Až 40% T se metabolizuje touto cestou - proto je močová exkrece 17-KS vyšší u mužů. U žen jejich produkce odráží především syntézu adrenálních androgenů.
Aldosteron má velmi krátký biologický poločas (15 minut) a metabolizuje se redukcí a konjugací podobně jako kortizol. Jeho glukuronidy se někdy stanovují také v moči jako ukazatel denní produkce. Nadledvinkové i gonadální androgeny dávají při degradaci vznik různým redukovaným meziproduktům se snižující se androgenní aktivitou, které se vylučují většinou jako glukuronidy. Ty se činností 5a-reduktázy v cílových buňkách mění na účinnější DHT a oba se metabolizují cestou derivátů androstandionu. DHEAS se přímo vylučuje močí.
Řízení sekrece nadledvinkových androgenů je dáno kortikotropní osou, z malé části se ale regulace účastní i prolaktin (PRL) a u některých species pravděpodobně také pro androgeny specifický tropní hormon hypofýzy.
3. Testes a poruchy androgenní steroidogeneze
3.1 Syntéza testikulárních hormonů a spermatogeneze
Receptory pro LH na Leydigových buňkách mají společnou sekvenci pro FSH a TSH, vazba LH má nejvyšší afinitu a signál pro syntézu T je zprostředkován cAMP. Při nadbytku resp. nedostatku LH dochází k "down-" nebo "up-" regulaci počtu LH receptorů, což je obecný fenomén a znamená snížení nebo zvýšení citlivosti cílové buňky na hormon, v případě Leydigových buněk na LH, ale také např. HCG. Proto je u mužů s nadbytkem HCG (například u testikulárního karcinomu) snížena syntéza T.
Testosteron je produkován Leydigovými buňkami způsobem, který sleduje sekreci LH v adenohypofýze. U člověka je pulsní charakter sekrece T oslaben opožděnou reakcí na LH, značným cirkulujícím poolem T a jeho tvorbou v kůře nadledvin a v periferních tkáních ( asi po 5% celkové produkce). U mladých mužů je naznačen cirkadiánní rytmus s maximem sekrece T v ranních hodinách.
V cirkulaci je vázán především na SHBG (60%), albumin (38%), volná frakce je asi 2%. Hladina SHBG významně klesá v období puberty, což znamená vzrůst fyziologicky účinné volné frakce. Afinita albuminu vzhledem k T je ve srovnání s SHBG asi 5x nižší. Pokles syntézy SHBG nastává při obezitě, akromegalii, hypotyreóze, v pubertě a při nadbytku androgenů, naopak hypertyreóza, cirhóza jater a estrogeny ( gravidita, kontraceptiva) jeho syntézu zvyšují. Vazbu sexagenů k SHBG ovlivňují také nejrůznější farmaka, zvláště se steroidní strukturou.
Hlavní periferní aktivační cestou T je jeho lokální přeměna na 2-3x účinnější androgen DHT enzymem 5a-reduktázou, který má vysokou aktivitu v cílových tkáních.
Testosteron se degraduje v játrech ( asi 70%) a v periferních tkáních (30%), a to cestou konverze na androsteron a etiocholanon ( 20-30% močových 17-ketosteroidů) a nebo konjugací DHT či androstendionu na sulfáty a glukuronidy a jejich exkrecí močí.
Pulzní sekrece GnRH je pro aktivaci LH / FSH osy důležitá, protože bylo zjištěno, že při kontinuální infúzi GnRH produkce gonadotropinů klesá. Pulzní charakter hypofyzární produkce FSH je méně nápadný než u LH. Na charakter sekrece gonadotropinů mají výrazný vliv především zpětné vazby z periferie (sexageny, inhibin, folistatin). Testosteron působí inhibičně především na úrovni hypotalamu, estrogeny na obou úrovních tj. v hypotalamu i v hypofýze.
Sérové hladiny FSH jsou u dospělého muže zhruba stejné jako u ženy ve folikulární fázi cyklu (2 - 10 U/l), pro LH jsou asi poloviční (muži 0,5-10, ženy 2-20 U/l). Denní produkce LH (= minimální substituce při deficitu LH ) je u mužů asi 1000-2000 U.
Regulace spermatogeneze je pod dominantním vlivem FSH, který je stimulován stejným GnRH jako LH. Periferní androgeny mohou modifikovat konečnou posttranskripční koncentraci FSH v hypofýze, dále poměr FSH/LH stoupá v pubertě, při relativním snížení GnRH (hypotalamická amenorea, mentální anorexie) a při hyperprolaktinemii. Sekrece FSH je negativně ovlivňována inhibiny typu A či B ze Sertoliho buněk, jejichž tvorba je naopak FSH stimulována. Jejich syntéza je dále ovlivňována prostaglandiny, inzulínem a růstovými faktory. Inhibiny působí naopak lokálně v testes stimulačně na biosyntézu testosteronu. Snížení sekrece FSH působí také peptidy izolované společně s inhibiny ze Sertoliho buněk (folistatiny). V testes byly ale prokázány také látky se stimulační aktivitou na FSH ( skupina aktivinů).
Z dalších regulačních mechanismů spermatogeneze je třeba zmínit vliv vysokých lokálních koncentrací testosteronu, který proniká hematotestikulární bariérou do Sertoliho buněk. Nově se k dalším lokálním faktorům regulujícím spermatogenezi řadí mnoho parakrinních působků typu cytokinů, růstových faktorů (EGF, TGFß), prostaglandinů a opioidů. Při hyperprolaktinemii dochází především k inhibici sekrece GnRH na úrovni hypotalamu a následně k poklesu sekrece gonadotropinů. PRL má ale prokázané receptory také přímo v testes a inhibuje 5a-reduktázu (snížená produkce DHT).
3.3 Základní biochemické vyšetřovací metody při testikulárních poruchách
Základní biochemické informace přinesou hormonální vyšetření uvedená v bodech 3.3.1 až 3.3.6. Jejich referenční hodnoty jsou uvedeny v Tab.10.1.. Vždy je nutné tyto hodnoty posuzovat vzhledem k věku a klinickému obrazu sexuální maturace.
3.3.1 Plazmatickou koncentraci testosteronu (T) hodnotíme vždy ve vztahu k hodnotám LH pro rozlišení nekompenzovaných a kompenzovaných periferních výpadových syndromů a centrálního hypogonadismu. Ideální je vyšetření volné tj. nevázané frakce T, které je ale technicky náročné. Proto vyšetření celkového T doplňujeme stanovením SHBG resp. albuminu a tak lze provést aproximativní výpočet volné frakce T.
3.3.2 Při normálním nebo i zvýšeném celkovém T a malformacích zevního genitálu vyšetřujeme plazmatickou koncentraci DHT (enzymopatie s defektem 5a-reduktázy).
3.3.3 Další možné enzymopatie v rámci CAH lze nejsnáze zjistit vyšetřením 17-OH-progesteronu a dalších steroidů (viz část 1. této kapitoly) při zkráceném ACTH testu.
3.3.4 Mírně zvýšené hodnoty plazmatického estradiolu (E2) u mužů bývají při gynekomastii v pubertě a při chronických hepatopatiích. V reprodukčním věku je u plazmatický E2 u zdravých mužů na úrovni žen ve folikulární fázi cyklu. Jednoznačně vysoké hodnoty E2 se naleznou při testikulárních a adrenokortikálních nádorech s produkcí E2. U testikulárních nádorů se často nalezne vysoká hodnota ß-podjednotky HCG (trofoblastová dediferenciace).
3.3.5 Vyšetření FSH v plazmě signalizuje při vysokých hodnotách, při jinak intaktním hypotalamo-hypofyzárním systému, periferní, tj. primární dysfunkci Sertoliho buněk resp. semenotvorných kanálků, včetně deficitu inhibinů.3.3.6 Vyšetření PRL provádíme vždy - i u mužů může hyperprolaktinemie například při prolaktinomu vést k hypogonadismu.
3.4. Funkční testy
3.4.2 Klomifenový test.
3.4.3 GnRH (LHRH) test.
4. Ovaria a regulace reprodukčního cyklu u ženy
4.1 Základní morfologické aspekty
(a) granulózové buňky, na nichž se postupně exprimují receptory pro FSH (rozhodující pro růst a diferenciaci), receptory pro LH (ovulace), receptory pro PRL (blokáda účinku FSH spolu s glk a progesteronem) a receptory pro další steroidní hormony; (b) intersticiální a tékální buňky s receptory především pro LH a HCG produkují androgeny, které většinou následně konvertují na E2.
Ovulující folikul se mění rychlým zvýšením počtu LH receptorů a preovulačním zvýšením plazmatických koncentrací LH a PRL na corpus luteum, které preferenčně produkuje progesteron. Po uvolnění vajíčka z folikulu dochází k luteolýze, která je ale v případě oplodnění blokována HCG z blastocysty. Luteolýza (apoptóza a fibrotizace corpus luteum) je regulována jak sekrecí gonadotropinů a sexagenů, tak i lokálními růstovými faktory a cytokiny.
4.2 Biosyntéza a transport ovariálních hormonů
Přeměna na 17a-OH-progesteron (17-0H-PRG, folikulární fáze) je dána činností 17a-hydroxylázy, konverze na progesteron (luteální fáze, zvláště po ovulaci), tj. změna z D5 na D4-steroidy je zprostředkována komplexem dvou enzymů (ad 2 v obr. 10.1). Z hlediska estrogenní sekrece je překvapující, že žádný typ ovariálních buněk nemá kompletní výbavu pro syntézu estrogenů de novo. Biosyntéza 17ß-estradiolu (E2, nejvýznamnější estrogen) a estronu se děje z androgenních prekursorů androstendionu a testosteronu. Ty jsou produkovány pouze intersticiálními a tékálními buňkami za stimulace LH (granulózové buňky nemají enzymy 3 a 4). Androstendion se dostává difuzí do granulózových buněk, které obsahují enzymy 6 a 7 a jsou tedy sekundárně ("oklikou" přes androgeny) schopné estrogeny tvořit. Aktivita posledně jmenovaných enzymů je kontrolována především FSH, jehož receptory jsou jen v buňkách granulózy, a proto sekrece estrogenů stoupá ve folikulární fázi, při ovulaci produkce poklesne a ke konci cyklu opět poněkud stoupá. Mikrosomální aromatázový komplex granulózových buněk 7 je inhibován DHT (5a-reduktáza).
Progesteron (PRG) je primárním produktem granulózových buněk, a to především v luteální fázi ( tj. v ovariu s ovulujícím folikulem). Ve folikulární fázi je sekrece P z obou ovarií symetrická a polovina z celkového P se tvoří v kůře nadledvin. Transport estrogenů se uskutečňuje především vazbou na SHBG a albumin (pro E2 37% resp. 60%, volná frakce 1,8%), progesteronu vazbou na CBG a albumin (18% resp., 70%, volná frakce 2,4%). Vazba na specifické globuliny je přes nižší celkové procento významnější pro svou vysokou afinitu. Jak již bylo řečeno dříve, jaterní syntézu SHBG a CBG zvyšují mimo jiné především estrogeny ( u žen jsou až dvojnásobně vyšší hodnoty SHBG ) a T4, naopak ji snižují androgeny a gestageny. Spolupůsobí ale také řada dalších metabolických a farmakologických vlivů.
4.3 Odbourávání sexagenů
Progesteron má krátký biologický poločas (kolem 5 minut) a je po hydrogenaci vylučován močí jako pregnandiol-glukuronid, jehož exkrece odráží celkovou produkci progesteronu. Konečnými metabolity androgenů jsou androsteron, epiandrosteron, androstendiol (z DHT) a etiocholanolon.
Hlavním negativním zpětnovazebným mechanismem regulace sekrece gonadotropinů je tedy sekrece estrogenů a progesteronu. Během normální menstruace tato regulace udržuje plazmatické hladiny gonadotropinů pod 25 U/l. Při poklesu periferní produkce sexagenů existuje především na úrovni hypofýzy (možná i hypotalamu) také pomaleji se vyvíjející pozitivní zpětná vazba, tj. stimulace sekrece gonadotropinů (vysoké plazmatické koncentrace LH a FSH jsou v menopauze a po ovarektomii). Vedle LH a FSH, jejichž ovariální receptory patří do superrodiny receptorů využívajících k signalizaci G-proteiny (TSH, PTH, AVP, katecholaminy, ale i některé interleukiny), působí v ovariu velké množství lokálních regulačních peptidů. Ovulaci jiného než dominantního folikulu potlačuje skupina tzv. follicule regulatory proteins (FRP), existuje lokální luteinizační stimulátor i inhibitor, GnRH podobné peptidy apod. Do cirkulace se secernují podobně jako v testes aktiviny, inhibiny a folistatin. Jejich úloha v menstruačním cyklu není zcela vyjasněna. Žluté tělísko produkuje během gravidity pod kontrolou HCG relaxin. Ve fetálním období a premenarché jsou sice ovaria schopná tvorby androstendionu (význam syntézy není zcela jasný), ale při absenci gonadotropinů dojde k jejich atresii bez cyklické změny hormonální produkce. Kolem 6. roku věku se některé folikuly zvětšují a stoupá produkce estrogenů. V důsledku zvýšených hladin FSH a LH kolem 10.roku produkce estrogenů akceleruje, zvětšuje se růst folikulů až do nástupu menarché, kdy dojde k prvnímu výběru dominantního folikulu a začátku menstruačních cyklů. Menarché resp. menstruační cyklus zahrnuje málo objasněný mechanismus výběru dominantního folikulu, který probíhá již během předchozí menstruace, jeho přeměnu na Graafovský folikul, ovulaci, vývoj žlutého tělíska a luteolýzu. Postovulační tj. luteální fáze je poměrně konstatní (14 dní), změny v délce celého menstruačního cyklu jsou dány především kolísáním délky preovulační, folikulární fáze. Hormonální změny jsou schematicky znázorněny na Obr. 10.4. Preovulační produkce estrogenů stimuluje sekreci LH, jehož peak ( LH surge) zahajuje ovulaci. Zvyšuje se - i když méně - také produkce FSH a PRL. V období ovulace klesá syntéza estrogenů, nastupuje zvýšení progesteronu a vrcholí také produkce androstendionu a testosteronu. V dalším vývoji corpus luteum se opět zvyšuje sekrece estrogenů, jejichž pokles na konci cyklu vede k menstruaci, zvýšení FSH a zahájení dalšího cyklu. Nástup menopauzy je dán vyčerpáním zásoby vhodných premordiálních folikulů, jejichž množství je určeno stavem na počátku puberty. Přestane probíhat proces výběru folikulů a klesá především produkce estrogenů.
4.5 Biochemické vyšetřovací metody při ovariálních poruchách.
4.5.1 Klomifenový test.
4.5.2 Gonadoliberinový test.
4.5.3 Progesteronový test
4.5.4 Mimo biochemické metody je nutné zmínit měření bazální teploty, kde termogenní účinek progesteronu signalizuje ovulaci, endometriální nebo vaginální cytologii (typické histomorfologické změny při různém poměru sexagenů) a v poslední době i sonografickou folikulografii, která zachytí folikuly větší než 12 mm a jejich vývoj do ovulace. Všechna tato vyšetření se integrálně hodnotí s hormonálními analýzami.
4.5.5 Při poruchách sexuální maturace je na prvním místě vyšetření karyotypu s kombinací vyšetření jako u sekundární amenorhey.
Diagnostické algoritmy pro vyšetření primární a sekundární amenorhey, virilizace (hirzutismu) a poruchy fertility jsou ve speciálních kapitolách endokrinologických učebnic. Například schéma vyšetření sekundární amenorhey se z hlediska biochemických metodik primárně opírá při vyloučení gravidity o vyšetření plazmatických koncentrací PRL a TSH ( prolaktinomy, hypotyreóza) a dále při jejich normálních hodnotách o vyšetření FSH, LH a výsledek progesteronového testu.
Tento přehled naznačuje dosti širokou paletu laboratorních vyšetřovacích metod a ve srovnání s nedávnou minulostí současně svědčí o dynamickém vývoji na tomto poli a v endokrinologii vůbec. Jejich aktuální nabídka a dostupnost bude jistě regionálně různá v závislosti na materiálním, technickém a personálním vybavení laboratoří. Za mnohem důležitější však považujeme zajištění jejich jakosti a mezilaboratorní srovnatelnosti, stanovení referenčních (a dále i rozhodovacích) mezí a z interpretačního hlediska potom znalost analytických a biologických interferencí
(kapitola 1). Jsme přesvědčeni o tom, že ke splnění zvláště posledně jmenovaných požadavků lze dospět jedině průběžným a intenzívním dialogem mezi lékařem v laboratoři a ošetřujícím lékařem.
Límanová Z., Němec J., Zamrazil V.: Nemoci štítné žlázy. Galén Praha, 1995
Butler J., Pope R.: Thyroid dysfunction. V knize: Clinical Biochemistry. W.J.Marshall, S.K.Bangert (editoři), Churchill Livingstone Ltd. New York, Edinburgh, London 1995, str.331 - 354
Surks M.I., Chopra I.J., Mariash C.N. et al.: American Thyroid Association guidelines for use of laboratory tests in thyroid disorders. JAMA, 263, 1990, 1529 - 1532
Rational in vitro thyroid diagnosis. A publication of the Diagnostics Division, Scientific Department, Boehringer Mannheim GmbH, BRD 1989
Weetman A.P.: The laboratory diagnosis of thyroid disease. Thyroid Information Service, Amerlite Diagnostics Ltd. 1991
Thyroid quick reference guide. Abbott Diagnostics Educational Services. Abbott Laboratories 1993
Lindstedt G., Berg G., Jansson S. et al.: Clinical use of laboratory thyroid tests and investigations. Journal IFCC Vol.6 (4), 1994, 136 - 141
Beckett G.J.: The investigation of thyroid function. Journal IFCC, Vol.6 (5), 1994, 186 - 190
Biochemická vyšetření v reprodukční endokrinologii
Autor kapitoly: doc.MUDr.Zdeněk Mašek CSc., Endokrinologický ústav, Praha
Základní sexuální fenotyp je určen karyotypem XX resp. XY, které ale nedeterminují další sexuální vývoj ve všech případech. Defekty se primárně mohou vyskytnout na chromozomální (abnormální a mozaikové kombinace X a Y) nebo
genové úrovni . Vlastní gonadální diferenciace začíná asi v 6. týdnu a nemusí přísně korespondovat s chromozomální výbavou. Při absenci Y chromosomu postačuje jen přítomnost maskulinního genu SRY (sex-determinating region Y) a naopak se testikulární formace mohou vyvinout mutacemi i při XX karyotypu. Další problémy mohou vznikat vcestováním karyotypicky nepříslušných zárodečných buněk do již založených testes nebo ovarií, kde může sekundárně dojít k afunkci nebo i sexuální konverzi.
1.1.1 Kongenitální adrenální hyperplasie (CAH)
 CAH představuje soubor nejméně 5 enzymových defektů steroidogeneze v kůře nadledvin s různým biochemickým a klinickým obrazem. Tyto defekty vedou především k nedostatečné syntéze kortizolu a tím stimulaci sekrece ACTH. Jeho nadbytek vede k hypertrofii kůry nadledvin a hromadění produktů steroidogeneze před enzymovým blokem. Důsledky jsou dány účinky kumulovaných intermediárních produktů nebo jejich metabolitů
(Obr. 10.1).
CAH představuje soubor nejméně 5 enzymových defektů steroidogeneze v kůře nadledvin s různým biochemickým a klinickým obrazem. Tyto defekty vedou především k nedostatečné syntéze kortizolu a tím stimulaci sekrece ACTH. Jeho nadbytek vede k hypertrofii kůry nadledvin a hromadění produktů steroidogeneze před enzymovým blokem. Důsledky jsou dány účinky kumulovaných intermediárních produktů nebo jejich metabolitů
(Obr. 10.1).
vede ke generalizovanému výpadku všech nadledvinkových a gonadálních steroidů (kongenitální lipoidní adrenální hyperplasie) a i při terapii přežívá jen asi třetina novorozenců. Všechny steroidní hormony jsou sníženy, odpověď na ACTH (u chlapců i na HCG) je minimální nebo chybí, je vysoká koncentrace P-ACTH, plasmatické reninové aktivity (PRA) , deplece NaCl (tzv. salt-wasting crisis), u chlapců je pseudohermafroditismus.
Výsledkem jsou vysoké koncentrace ACTH, PRA při chybění kortizolu, aldosteronu a sexuálních steroidů ležících ve schématu biosyntézy distálně od DHEA. Postižené děti opět trpí těžkou deplecí NaCl (salt-wasting crisis), klinicky jde o mužský i ženský pseudo-hermafroditismus. U abortivních forem může být předčasná adrenarche, poruchy v pubertálním vývoji a menstruaci, hirzutismus apod. Laboratorně se diagnóza opírá o výrazné zvýšení bazálních a ACTH stimulovaných plazmatických a močových hodnot D5-steroidů, tj. všech před blokem 2 (Obr. 10.1) a s nízkými 4-steroidy (za místem působení 2). Většinou se používá kritéria zvýšení 17-hydroxypregnenolonu nebo jeho poměru k 17-hydroxyprogesteronu minimálně o + 2s proti normě. V normě nepřesáhnou za 60 min po aplikaci ACTH sérové koncentrace 17-hydroxypregnenolonu 48 nmol/l a DHEA 58 nmol/l , poměr 17-hydroxypregnenolon: 17-hydroxyprogesteron je menší než 11 a poměr DHEA : androstendion je menší než 8. Při plně vyjádřené patologii jsou tyto hodnoty mnohonásobně překračovány a po podání supresivní terapie glukokortikoidy se výrazně snižují. Enzymový defekt má vliv i na hormonální produkci v testes, kde po několikadenním podání 1500 až 5000 jednotek HCG může sice dojít k obvyklému zvýšení testosteronu, ale rozhodující je opět výrazně vyšší poměr D 5 :D 4 steroidů v séru i moči, především výrazné zvýšení androstendiolu.
je zpravidla kombinován s defektem 17,20- lyázy (6 v obr. 10.1). Výsledkem je opět defekt syntézy 17-OH-steroidů, a to nízké bazální i stimulované (ACTH, HCG) koncentrace kortizolu, aldosteronu a sexagenů. Stimulací kůry zvýšeným ACTH se hromadí se především 11-DOC, kortikosteron a jejich 18-OH deriváty. Výsledkem nadbytku těchto steroidů s mineralokortikoidním účinkem je hypertenze a hypokalemie, sekundárně je suprimována PRA a zbytková sekrece aldosteronu. V případech s defektem 16,20-lyázy jsou zvýšeny hladiny 17-OH-pregnenolonu a 17-0H-progesteronu. Důležité je opět zlepšení patologických hodnot při terapii glukokortikoidy.
tvoří asi 90% CAH. Výsledkem je nedostatek kortizolu, DOC, kortikosteronu a aldosteronu, zvýšení sekrece ACTH a nadbytek nadledvinkových androgenů (močové 17-KS). V klinickém obrazu dominuje virilizace a zvýšené vylučování NaCl s hypotenzí. Bazální hodnoty 17-OH-progesteronu jsou 300-3000 nmol/l a dále se po ACTH aplikaci zvyšují, hodnoty androstendionu jsou mezi 6,9 - 28 nmol/l . Poměr PRA : aldosteron je zvýšen.
tvoří 5-8% CAH a vede k poklesu syntézy kortizolu, kortikosteronu a aldosteronu, naopak se hromadí 11-DOC s následnou retencí tekutin a hypertenzí. Jsou zvýšené adrenální androgeny, které působí virilizaci.
Představují další velkou skupinu poruch. Jsou způsobeny zvýšenou přítomností androgenů u matky (virilizující tumory během gravidity, hormonální terapie progestogeny v časné graviditě) nebo u plodu (nerozpoznaná residua testes) .
Při rovnováze genotypu XX/XY a při podobných chomozomálních mozaikových karyotypech dochází k vývoji typicky ambivalentních zevních genitálií s dalšími variabilními projevy kombinace mužského a ženského fenotypu.
Pro diagnózu je nutná úplná absence struktur ductus Mülleri, naopak externí gonády jsou alespoň rudimentárně přítomny, k inkompletní androgenizaci dochází z různých příčin uvedených v bodech 1.3.1 až 1.3.5.
Základním společným prekursorem nadledvinkových steroidů a sexagenů je cholesterol pocházející (a) z cirkulujících LDL, které se váží na membránové receptory sekrečních buněk a uvolňují volný chlesterol, (b) z esterů cholesterolu deponovaných v cytoplazmatických vakuloách a (c) z resyntézy cholesterolu z acetyl-CoA.
Podstatnými morfologickými strukturami testes jsou
(a) intersticiální Leydigovy buňky (5% objemu ) syntetizující testosteron,
(b) Sertoliho buňky semenotvorných kanálků, které tvoří hematotestikulární bariéru a mají především podpůrné a trofní funkce vzhledem k spermatogoniím a
(c) buňky zárodečného epitelu v semenotvorných kanálcích se spermatogoniemi. Zde probíhá první a druhé meiotické dělení a tvorba spermií. Biosyntéza sexagenů má společný začátek se steroidogenezou v nadledvinách, tj. začíná konverzí cholesterolu na pregnenolon (Obr. 10.2). Další metabolismus probíhá
Biosyntéza sexagenů má společný začátek se steroidogenezou v nadledvinách, tj. začíná konverzí cholesterolu na pregnenolon (Obr. 10.2). Další metabolismus probíhá
(a) cestou 17a-hydroxypregnenolonu a DHEA(S) a jeho konverzemi na testosteron v gonádách či periferních tkáních (D4 - cesta).
(b) cestou tvorby progesteronu, 17-OH- progesteronu a androstendionu (D5 -cesta). Jak androstendion, tak testosteron se mohou účinkem aromatázy v některých periferních tkáních měnit na estrogeny ( u muže asi 0,4% z celkově secernovaných 7 mg T) . Malá část syntézovaných androgenů může být ve formě sulfátů deponována v Leydigových buňkách. 3.2 Hypotalamo-hypofyzární-testikulární osa (Obr. 10.3)
3.2 Hypotalamo-hypofyzární-testikulární osa (Obr. 10.3)
Gonadotrofní buňky hypofýzy mají receptory pro hypotalamický gonadoliberin GnRH, který stimuluje sekreci jak LH, tak i FSH zvýšením intracelulárního Ca2+ v těchto buňkách. Starší označení LHRH pro tento spouštěcí hormon se vzhledem k prokázanému vlivu i na FSH přestává používat. Oba gonadotropiny jsou glykoproteiny se společnou a -podjednotkou, kterou sdílí i s TSH a HCG, ale každý ze jmenovaných hormonů má odlišnou ß-podjednotku, syntézovanou expresí specifických a nezávislých genů. Podjednotky se spojují po ukončení translace a molekula se následně glykosyluje. Stupeň a charakter glykosylace není konstantní a vzniká více glykosylačních produktů s variabilní biologickou aktivitou.
Klinický obraz deficitu testosteronu závisí na době jeho vzniku. U novorozenců je nutné vyšetření karyotypu, využití zobrazovacích metod při malformacích genitálu (přítomnost rudimentárních externích gonád) a v dospělosti vyšetření spermiogramu.
3.4.1 HCG ( Praedynový) test má řadu modifikací.
Principem je podání 250 - 3000 U HCG (dávka záleží na věku), který má biologickou aktivitu LH, po dobu 3 dní s následným stanovením plazmatické koncentrace HCG a testosteronu. Při funkčních Leydigových buňkách dojde po ukončení testu ke vzestupu T z normálních hodnot na 2-8 násobek. Test diferencuje centrální a periferní hypogonadismus, anorchii proti bilaterálnímu kryptorchismu a enzymové defekty biosyntézy testosteronu.
Klomifen kompetitivně obsazuje E2 receptory v hypotalamu a hypofýze a způsobuje zvýšení GnRH, LH a FSH. Po 10 dnech podávání dojde v normě ke zvýšení LH alespoň o 50%, FSH a T alespoň o 30%. K diagnóze centrální poruchy je podstatná odpověď LH.
Po i.v. podání 0,1mg syntetického GnRH je sledována odpověď plazmatické koncentrace LH a FSH. Při intaktní hypofýze dojde ke zvýšení u LH 2-9x, u FSH 1,5-2x. Základním biochemickým vyšetřovacím algoritmem je tedy zhodnocení bazálních plazmatických hodnot testosteronu, LH, FSH a z ostatních metod diagnostika karyotypu a spermiogramu. Při předpokladu enzymových defektů provedeme vyšetření steroidů tak, jak jsou uvedena u CAH. Příslušné nozologické jednotky z oblastí centrálních a periferních forem mužských hypogonadismů, testikulárních nádorů, poruch mužské puberty a dalších patologických stavů (Klinefelterův syndrom, kryptorchismus, gynekomastie, infertilita) jsou uvedeny v učebnicích endokrinologie.
Ovaria mají podobně jako testes 2 hlavní funkce, které jsou úzce propojeny a v reprodukčním věku ženy cyklicky uspořádány: produkce zralého vajíčka a změny v sekreci sexagenů během 28-30 dnů.
Na konci puberty obsahují ovaria asi 400 tisíc primordiálních folikulů. Z původního počtu několika milionů jich většina zanikne atresií před formací antra, protože až do stadia terciárního (antrálního) folikulu jsou jeho diferenciace a růst kontrolovány lokálními faktory. Plné zralosti během reprodukčního věku ženy dosáhne jen asi 400 folikulů. Předpoklady dominance (výběru) a zahájení vývoje konkrétního folikulu nejsou známé. Nejčastěji je uvažována tzv. duální teorie koordinované činnosti obou gonadotropinů: LH navodí primárně v tékálních buňkách syntézu androstendionu a ten po konverzi na estradiol v granulózových buňkách - kontrolované FSH - způsobí začátek vývoje folikulu. Vývoj do Graafova folikulu ( vzrůst na 30 mm) je plně podřízen gonadotropinové sekreci. Graafův folikul obsahuje kromě zralého oocytu s haploidním genotypem několik typů buněk:
Ovaria jsou v reprodukčním věku ženy hlavním zdrojem estrogenů a v luteální fázi cyklu i gestagenů. Produkují také androgeny a jejich konverze mimo ovarium tj. v periferních tkáních na estrogeny je důležitá v menopause a při ovariálních dysfunkcích.
Principiálně se biosyntéza sexagenů neliší od adrenální a testikulární sekvence ( obr. 10.1 a obr. 10.2.). Kvantitativně limitujícím článkem syntézy je iniciální konverze cholesterolu a jeho esterů na pregnenolon, která je v lokalisována v tékálních buňkách a dominantně kontrolována LH.
17ß-estradiol se rychle a reverzibilně dehydrogenuje na estron. Ten je konvertován na dihydroxy-, methoxy-, katechol- deriváty a estriol. Alternativně je ledvinami po konjugaci vylučován estronsulfát nebo estriolglukuronid.  4.4 Regulace menstruačního cyklu a ovulace (Obr. 10.4)
4.4 Regulace menstruačního cyklu a ovulace (Obr. 10.4)
GnRH ( dříve LHRH) je hypotalamický dekapeptid, který je esenciálním faktorem pro syntézu a uvolnění obou gonadotrofinů. Jeho koncentrace v periferní krvi je velmi nízká a pravděpodobně mírně stoupá v preovulatorní fázi. Sekrece je pulsní v intervalech 1-3 h a pulsní rytmus je nutný k normální menstruaci. Spouštění, pulsní intervaly GnRH a tím i charakter menstruačního cyklu jsou spíše řízeny ovariální produkcí sexagenů než suprahypotalamickými strukturami CNS. Výrazněji než u mužů dochází při jeho trvale zvýšených koncentracích - např. arteficiálně při infúzním podání - ke ztrátě citlivosti (down-regulaci) hypofyzárních receptorů GnRH a snížené odpovědi obou gonadotropinů.
Základními laboratorními parametry při endokrinních ovariálních poruchách jsou plazmatické koncentrace LH, FSH, PRL, estradiolu a progesteronu (referenční hodnoty jsou uvedeny v Tab.10.1.). Z dynamických testů se používají dále uvedené.
Klomifen se váže na estrogenové jaderné receptory a kompeticí navozuje hypoestrogenní stav. Podává se 5 dní po 100 mg, a to 5.den cyklu při anovulačních menstruacích nebo kdykoliv u sekundární amenorhey. Tím se navodí zvýšení GnRH a současně - nebo spíše v důsledku této stimulace - i zvýšení LH a FSH. Oba gonadotropiny působí při intaktních ovariích ovulaci, která je detegována, bez ohledu na následnou přítomnost či absenci menstruace, zvýšením plazmatického progesteronu nad 16 nmol/l. Vyšetření provádíme 12. den od ukončení aplikace klomifenu. Negativní, tj. patologický test indikuje spíše hypotalamickou poruchu, ale nevylučuje ani hypofyzární poruchu.
GnRH (LHRH) test se provádí syntetickými analogy s odběrem vzorků na vyšetření plazmatické koncentrace LH a FSH před a po bolusové aplikaci 0,1 mg preparátu. Vzorky odebíráme po 30 minutách od - 60 do + 120 min. Ve folikulární fázi cyklu stoupne bazální hladina LH nejméně 2x, u FSH 1,5x. Odpovídající hodnoty vzestupu jsou pro luteální fázi 4-8x (LH) a 2x (FSH). Snížená odpověď svědčí pro hypofyzární poruchu, ale interpretace není úplně jednoznačná pro možnost snížené citlivosti hypofýzy na GnRH při déletrvající hypotalamické poruše.
je nepřímé funkční vyšetření, které prokazuje dostatečnou estrogenizaci dělohy a tedy proliferaci endometria. Podáváme 5 dnů 15 mg progesteronu a v případě dostatku estrogenů se dostaví menstruace do 2-7 dní po ukončení aplikace preparátu.
| A | aktivin |
| ACTH | adrenokortikotropní hormon, kortikotropin |
| AMH | inhibiční hormon vývoje ductus Mülleri, antimüllerian hormone |
| AVP | arginin vasopresin, antidiuretický hormon (ADH) |
| CAH | kongenitální adrenální hyperplasie |
| CBG | kortikosteroidy vázající globulin |
| DHEA | dehydroepiandrosteron |
| DHEAS | dehydroepiandrosteron sulfát |
| DHT | dihydrotestosteron |
| EHF | epithelial growth factor, epiteliální růstový faktor |
| E2 | 17 ß-estradiol |
| FS | folistatin |
| HCG | lidský choriový gonadotropin |
| FSH | folikuly stimulující hormon, folitropin |
| FRP | folicule regulatrory proteins |
| GABA | kyselina g-aminomáselná, neuotransmiter |
| GnRH | gonadotropiny uvolňující hormon, gonadoliberin ( dříve LHRH) |
| glk | glukokortikoidy |
| I | inhibin |
| LDL | low density lipoproteins, lipoproteiny o nízké hustotě |
| LH | luteinizační hormon, lutropin |
| PRG | progesteron |
| PRA | plazmatická reninová aktivita |
| PRL | prolaktin |
| PTH | parathormon |
| STH | růstový hormon, somatotropin |
| T | testosteron |
| TGFß | transforming growth factor ß |
| T4 | tyroxin ( tetrajódtyronin) |
| 17-OH-PRG | 17-a- hydroxyprogesteron |
| 11-DOC | 11 - deoxykortikosteron |
| 17-OHCS | 17 - hydroxykortikosteroidy |
| 17-KS | 17 - ketosteroidy |
Pozn.: Pojem sexageny se dnes užívá pro souborné označení estrogenů, androgenů a gestagenů. Referenční rozmezí hodnot hormonálních vyšetření jsou na konci kapitoly v Tab.10.1.
| Tab.10.1. Normální hodnoty hormonálních vyšetření - ranní odběr | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ženy-reprodukční věk | ženy | muži | M = muži, F = ženy | ||||||||||||||
| hormon | rozměr | folik.fáze | střed cyklu | luteální fáze | PM | dospělí | do 1. dne | 1-30 den | 1-4 měs. | 4-10 měs. | 10 měs.-10r. | 10-13 r. | 13-16 r. | 16-40 r. | 40-60r. | nad 60 r. | |
| S-17-hydroxyprogesteron | nmol/l | M | 1.0-22.0 | 0.1-14.0 | 0.5-12.2 | 0.5-6.0 | 0.3-2.9 | 0.8-6.4 | 0.8-6.4 | 1.3-3.4 | 1.9-5.4 | 1.9-5.4 | |||||
| F | 1.0-22.0 | 0.1-14.0 | 0.5-10.0 | 0.6-6.0 | 0.3-2.9 | 0.3-7.7 | 0.3-7.7 | 1.1-8.4 | 0.2-4.5 | 0.2-4.5 | |||||||
| S-17-hydroxyprogenenolon | nmol/l | 0.6-13.0 | 1.3-8.0 | M,F | pod 3.2 | ||||||||||||
| S-11-deoxykortikosteron | 0.0-0.30 | 0.0-0.3 | |||||||||||||||
| P-11-deoxykortisol | nmol/l | 0.1-3.2 | 0.1-3.2 | ||||||||||||||
| P-21-deoxykortisol | nmol/l | 0.0-0.35 | 0.0-0.35 | M | 0.9-1.5 | 0.3-11.7 | 1.8-8.6 | ||||||||||
| S-androstendion | nmol/l | F | 0.9-5.8 | 0.1-9.1 | 1.5-5.4 | ||||||||||||
| S-11ß-OH-androstendion | nmol/l | M | 1.2-21.0 | 2.5-20.0 | |||||||||||||
| F | 1.2-21.0 | 1.8-17.0 | |||||||||||||||
| S-DHEA volný | nmol/l | M | 0.0-5.7 | 2.2-19.5 | 10.8-32.6 | 5.3-20.5 | 2.2-13.6 | ||||||||||
| F | 1.7-9.7 | 2.2-29.9 | 6.3-78.5 | 1.1-37.6 | 1.7-11.1 | ||||||||||||
| S-DHEA - sulfát | µmol/l | M | 0.1-1.1 | 0.06-1.0 | 0.06-2.9 | 2.5-7.5 | 6.4-16.1 | 1.5-9.0 | 0.3-5.2 | ||||||||
| F | 0.1-1.1 | 0.06-1.0 | 5.2-1.5 | 1.0-9.2 | 1.8-14.5 | 0.7-7.2 | 0.1-3.7 | ||||||||||
| S-testosteron celkový | nmol/l | M | 0.4-16.2 | 0.4-16.2 | 0.1-0.7 | 0.2-9.1 | 1.9-22.6 | 8.0-34.0 | |||||||||
| F | 0.3-1.7 | 0.0-0.6 | 0.0-0.6 | 0.3-1.9 | 0.4-2.6 | 0.4-3.0 | |||||||||||
| S-testosteron volný | pmol/l | 10.0-45.0 | 69.3-970.9 | ||||||||||||||
| S-dihydrotestosteron | nmol/l | M | 0.1-0.4 | 0.3-0.85 | 0.5-2.0 | 1.0-10.4 | 0.9-3.6 | ||||||||||
| F | 0.05-0.4 | 0.05-0.75 | 0.1-0.9 | 0.2-1.1 | 0.1-0.9 | ||||||||||||
| S-progesteron | nmol/l | 0.3-5.2 | 0.3-6.9 | 6.9-28.0 | 0.3-3.2 | 0.3-3.1 | M,F | 0.0-3.0 | |||||||||
| S-estradiol | nmol/l | 0.09-0.48 | 0.5-1.2 | 0.4-0.8 | 0.02-0.13 | 0.0-0.23 | M,F | 0.0-1.3 | 0.01-0.12 | ||||||||
| S-estron | nmol/l | 0.02 | 0.6-1.1 | 0.41 | |||||||||||||
| S-aldosteron vleže | pmol/l | 83-250 | 83-250 | ||||||||||||||
| S-aldosteron vstoje | nmol/l | 111.832 | 111.832 | ||||||||||||||
| S-PRA vleže | nmol/l/hod | 0.50-1.40 | 0.50-1.40 | ||||||||||||||
| S-PRA vstoje | nmol/l/hod | 0.70-1.80 | 0.70-1.80 | ||||||||||||||
| S-kortizol | nmol/l | 138-607 | 138-607 | ||||||||||||||
| S-sex hormone BP | nmol/l | M | 22.2-65.2 | 42.7-108 | 76.0-137 | 44.1-113 | 30.0-70.0 | 23.0-55.1 | 34.0-66.0 | ||||||||
| F | 28.3-69.5 | 28.3-69.5 | 68.4-149 | 55.4-124 | 43.2-120 | 43.2-95.0 | 43.2-95.0 | ||||||||||
| S-prolaktin | nmol/l | pod 0.9 | pod 0.7 | M | 6.4-8.6 | 0.27-0.64 | 0.18-0.38 | ||||||||||
| F | 6.4-8.6 | 0.27-0.64 | 0.18-0.38 | ||||||||||||||
| S-LH | U/l | 2.0-20.0 | 21.0-90.0 | 2.05-20.0 | 30.0-100.0 | 0.5-10.0 | M,F | 0.0-10.0 | |||||||||
| S-FSH | U/l | 2.0-10.0 | 10.0-30.0 | 2.0-10.0 | 15.0-140.0 | 2.0-10.0 | 0.0-10.0 | ||||||||||
| U-17-OHCS | µmol/24h | 5.5-33.0 | 8.3-41.4 | ||||||||||||||
| U-17-KS | µmol/24h | 17-52 | 31-76 | M,F | 0.0-3.5 | 3.5-35.0 | 3.5-35.0 | ||||||||||
| U-kortizol volný | µmol/24h | 30-290 | 30-290 | ||||||||||||||
| U-pregnanediol | µmol/24h | 0.3-5.3 | 3.7-29.3 | 0.6-3.7 | |||||||||||||
6. Doporučená literatura:
Kreze A., Langer P., Klimeš I., Lichardus B. (Ed.): Praktická endokrinológia. Nakladatelství Slovak Academic Press, Bratislava 1993
1. Optické metody
1.1 Absorpční fotometrie
(kromě monografií a skript vnitřního lékařství)
Pošová-Dutoit I.: Endokrinologie v praxi. Nakl. Grada - Avicenum, 1995
Greenspan F.S. (Ed.): Basic and Clinical Endocrinology, 3rd Edition. Nakl. LANGE Medical Publications, 1993
Lavin N. (Ed.): Manual of Endocrinology and Metabolism. 2nd Edition. Nakl.Little, Brown and Co., Boston /NY/London, 1994
Goodman H.M. (Ed.): Basic Medical Endocrinology. 2nd Edition. Nakl. Raven Press Ltd., 1994
Základy instrumentální analýzy v klinické biochemii
Autor kapitoly: doc.MUDr.Petr Štern CSc., Institut postgraduálního vzdělávání ve zdravotnictví, Praha
Je to optická metoda, která se zabývá kvantitativním hodnocením změny intenzity záření (obvykle určité vlnové délky) po průchodu analytickým prostředím. Při průchodu elektromagnetického záření z oblasti ultrafialové (190 - 400 nm) nebo viditelné části spektra (400 - 800 nm) měřeným roztokem dochází k absorpci záření. Pro tok světla procházejícího optickou soustavou a měřeným prostředím platí vztah:
Fo = světlo vstupující do měřeného prostředí
Základním vztahem pro absorpční fotometrii je zákon Lambertův-Beerův-Bougnerův:
Fr = odražený podíl světla
Fa = pohlcený podíl světla
F = světlo z měřeného prostředí vystupující
| log | Fo | |
| -------- | = A = a . c . l | |
| F |
"Absorbance je přímo úměrná látkové koncentraci a tloušťce absorbující vrstvy".
Přístroje, které se používají k měření intenzity záření v ultrafialové (UV) nebo viditelné (VIS) oblasti spektra se nazývají fotometry nebo spektrofotometry. Fotometry jsou jednodušší a používají k vymezení úzkého pásma vlnových délek filtry. Lze tedy měřit jen při těch vlnových délkách, které nám filtry umožňují separovat. Spektrofotometry používají mřížkový monochromátor, který dovoluje kontinuálně měnit vlnovou délku měření v širokém intervalu. Mimoto má spektrofotometr zpravidla citlivější detektor než fotometr a obvyklé jsou také dva zdroje světla (zvlášť pro UV a zvlášť pro VIS oblast).
Všechny fotometry a spektrofotometry sestávají ze tří základních částí:
a) zdroje zářivé energie,
b) filtru nebo mřížky pro izolaci úzkého pásma zářivé energie,
c) detektoru měřicího zářivou energii propuštěnou vzorkem. Mezi filtr, resp. mřížku a detektor se vkládá kyveta s roztokem měřeného vzorku.
Zdroje záření mění svou výstupní intenzitu toku s vlnovou délkou. Ve viditelné oblasti je nejčastěji používaným zdrojem světla žárovka s wolframovým vláknem. Její spektrální charakteristiku lze významně zlepšit halogenovou atmosférou. Kromě toho jsou rozšířené různé typy zdrojů elektrického výboje. V UV oblasti to jsou deutériové výbojky (190 až 375 nm), pro UV + VIS spektra xenonové a rtuťové výbojky. Ve všech případech je excitace vyvolána průchodem elektronů plynem.
Halogenová žárovka a deutériová výbojka se používají jako světelné zdroje ve spektrofotometrech. Rtuťová výbojka poskytuje světlo pouze určitých vlnových délek (tzv. čárové spektrum) a xenonová výbojka nemá stabilní intenzitu světla; proto se obě tyto výbojky používají jako světelné zdroje pouze u fotometrů.
Pro selektivitu, správnost a citlivost všech měření je nutné vybrat úzké pásmo vlnových délek, vyzařovaných ze širokospektrálního zdroje. K tomu účelu se obvykle používají interferenční filtry, které pracují na principu mnohonásobné interference mezi plochami s výbornými odrazovými vlastnostmi, nebo reflexní mřížky (nemají ztrátu světla absorpcí). Mřížka je sice nejdůležitější částí optického zařízení k získání monochromatického světla - monochromátoru - kde pracuje jako rozptylový prvek (lineární rozptyl na základě ohybu světla na vrypech v hliníkové nebo zlaté fólii, kterých je kolem 1000/1 mm), ale nutnou součástí je také vstupní štěrbina vymezující svazek heterochromatického záření a výstupní štěrbina, propouštějící pásmo světla blízké nominální vlnové délce.
Detektory používané ve VIS a UV oblasti převádějí zářivou energii na elektrickou energii. Používají se fotonky, fotonásobiče a diodová pole. Ve fotonkách se elektrony uvolněné z fotokatody po dopadu fotonů pohybují k anodě účinkem sacího napětí. Je-li fotonka plněná plynem, elektrony cestou ionizují jeho molekuly, takže na anodu dopadne větší počet elektronů, než byl uvolněn z katody. Fotonásobiče jsou uspořádány tak, že elektrony dopadnou po ozáření fotokatody na první zesilovací elektrodu, dynodu, kde je počet fotoelektronů násobem sekundární emisí. Takových dynod je ve fotonásobiči 10 i více a výsledný efekt zesílení může být i několik milionů. V detektoru diodového pole je světlo rozptylováno mřížkou na pole mnoha (např. 200) světlocitlivých diod a vzniká napětí, které je převedeno na digitální signál. Tyto detektory umožňují měřit současně celé spektrum, např. v rozsahu 200 až 700 nm.
Současné absorpční fotometry jsou vždy jednopaprskové, zatímco spektrofotometry mohou být jednopaprskové nebo dvoupaprskové. U dvoupaprskových spektrofotometrů paprsky procházejí jak roztokem vzorku, tak roztokem slepé zkoušky (blanku).
1.1.1. Vertikální fotometrie
Vertikální fotometrie je specifické přístrojové uspořádání využívající principu absorpční fotometrie. Vertikální fotometry mají jeden zdroj světla (žárovku), sadu filtrů a fotonku jako detektor. Zatímco u klasické absorpční fotometrie prochází paprsek kyvetou kolmo ke svislé ose (horizontálně), při vertikální fotometrii prochází kyvetou vertikálně. Přístroje tohoto typu jsou určeny k měření roztoků v mikrotitračních destičkách, popřípadě stripech (tj. proužcích s osmi mikrotitračními jamkami). Také denzitometry pro kvantitativní hodnocení elektroforegramů na průhledných nosičích pracují na principu vertikální fotometrie
(viz dále část 3.1 této kapitoly). Jednoduché vertikální fotometry nemají jiné vybavení než žárovku, filtr a fotonku a na mikrotitrační destičce měří postupně všechny jamky jednu po druhé. Sofistikovanější přístroje jsou vybaveny skleněnými vlákny, světlovody, které přivádějí světlo ze zdroje do osmi nebo více jamek najednou, a dalšími světlovody, které prošlé světlo odvádějí k detektoru. Elektronicky se přepíná signál z jednotlivých světlovodů na registrační fotonku. Ve zlomku sekundy se tak změří celá řada jamek, mikrotitrační destička se posune a může se měřit řada následující. Tento způsob měření je velmi rychlý a umožňuje změřit celou mikrotitrační destičku (tj. 96 jamek) za 5 s. Při vertikální fotometrii závisí dosažené výsledky měření pouze na přesnosti pipetování kalibrátorů, kontrolních materiálů a vzorků. Mikrotitrační destička nebo strip, určené k měření, mají vždy konstantní plochu kruhové základny a pro stejnou koncentraci je konstantní součin absorbance a délky optické dráhy roztokem.
| A1 . I1 = A2 . I2 = | c |
| --- | |
| a |
1.2 Reflexní fotometrie
Při této technice se sleduje odražené záření od homogenně zbarvené podložky. Reflexní fotometry se používají pro kvantitativní vyhodnocení reakcí probíhajících na pevné fázi se suchými činidly po jejich aktivaci vodou obsaženou v měřeném vzorku. Na principu reflexní fotometrie jsou také založeny denzitometry pro kvantitativní hodnocení chromatogramů na tenké vrstvě (viz dále) nebo obarvených elektroforeogramů na neprůhledných nosičích. Matrice pro suchá činidla v systémech tzv. "suché chemie" může být dvojího druhu: buď se jedná o impregnovaná vlákna anebo o vícevrstvý film. Obě skupiny matric vyhodnocujeme reflexní fotometrií, ale přístrojové uspořádání se zásadně liší.
Proužky z impregnovaných vláken dokonce umožňují vyšetřovat celou řadu analytů z plné krve. Zdrojem světla je světlo emitující dioda nebo několik diod, když je zapotřebí několika vlnových délek, nebo xenonová výbojka (v tom případě je nutno použít vždy vhodný interferenční filtr). Vzhledem k tomu, že světelný výtěžek odraženého světla je poměrně malý, používá se bílý kulový reflektor - Ulbrichtova koule - který fokusuje veškeré odražené světlo z reagenčního políčka impregnovaného vlákna na fotonku.
Vícevrstvý film představuje na rozdíl od impregnovaných vláken homogenní matrici a reflexní fotometrie prováděná tímto způsobem může při vysoké automatizaci poskytnout výsledky srovnatelné s absorpční fotometrií v roztocích. Zdrojem světla je žárovka s halogenovou atmosférou. Světlo selektované interferenčním filtrem dopadá na film, prochází absorpční vrstvou, odráží se od reflexní podložky, opět prochází absorpční vrstvou a dopadá na fotonásobič. V tomto případě se nepoužívá reflektor (Ulbrichtova koule), ale mnohem citlivější detektor - fotonásobič.
1.3 Plamenová emisní fotometrie
Při této technice se měří intenzita zbarvení plamene. K emisi záření charakteristické vlnové délky dochází při návratu elektronů z excitovaného stavu (vyvolaného plamenem) na původní dráhy. Plamenové fotometry používané v klinické biochemii jsou konstruované zpravidla pro paralelní stanovení koncentrace sodných a draselných iontů v séru nebo moči. Mohou být využity i pro analýzy lithia (monitorování lithných psychofarmak). U běžných plamenových fotometrů je palivem propan, který ve směsi se vzduchem poskytuje teplotu 1930 °C. Některé plamenové fotometry používající palivo acetylen-vzduch mají výhřevnější plamen (2300 °C) a umožňují tak i stanovení vápenatých iontů.
Roztok analyzovaného vzorku se přivádí do bezbarvého plamene ve formě jemné mlhy, která se vytváří v pneumatickém zmlžovači - atomizéru. K izolaci spektrálních čar se používá interferenčních filtrů a jako detektor intenzity emitovaného světelného toku slouží fotonka. Pro zajištění konstantních podmínek měření se ve všech plamenových fotometrech používá vnitřní standard, kterým je roztok LiCl nebo CsCl a pro stanovení lithia KCl, a který se ve značném množství přidává ke kalibračnímu i zkoumanému roztoku. Vždy se měří současně spektrální linie stanovovaného kovu a kovu vnitřního standardu. Tímto způsobem se kompenzuje vliv změn tlaku plynné směsi a viskozity roztoku.
V případě vysokých koncentrací bílkovin a lipidů v séru jsou výsledky měření koncentrace iontů plamenovou fotometrií nižší než naměřená aktivita ionselektivními elektrodami, hovoří se např. o pseudohyponatrémii. Je to způsobeno tím, že část objemu rozhodného pro výpočet koncentrace je obsazena bílkovinami a lipidy, takže i když se aktivita ve zbylém vodném objemu nezměnila, bude koncentrace v celkovém objemu nižší.
Dnes se zdá, že vývoj plamenových fotometrů je už uzavřený a to přesto, že některé přístroje jsou značně automatizované a sofistikované. Plamenový fotometr se obtížně zařazuje do vybavení automatického analyzátoru a vyžaduje dodržování specifických bezpečnostních předpisů. Navíc u pacientů v těžkých stavech (např. při dehydrataci) mohou výsledky, jak bylo výše uvedeno, zkreslovat skutečný stav aktivity iontů v organismu.
1.4 Atomová absorpční spektrofotometrie (AAS)
Je to optická metoda založená na měření absorpce elektromagnetického záření v ultrafialové a viditelné části spektra. Atomizace vyžaduje teplotu 2000 až 3000 °K. Volné atomy stanovovaného prvku, v klinické biochemii nejčastěji Ca, Mg a dále Cu, Zn, popřípadě Fe a jiné, absorbují výhradně záření takových vlnových délek, které mohou samy vyzařovat. Paprsek světla vhodné vlnové délky prochází plamenem, do něhož je rozprašován vzorek, nebo je veden přes elektrickou pec (tzv. bezplamenová verze), do které se zavádí vzorek.
Základní části atomového absorpčního spektrofotometru jsou zdroj záření, absorpční komora, monochromátor a detektor. Zdrojem záření je při stanovení netěkavých kovů dutá katodová výbojka (katoda je z kovu, pro který je lampa určena).
V plamenové verzi je vzorek rozprašován tryskou do mlžné komory a proudí společně s palivem (acetylén-vzduch) přes hořák do laminárního plamene. Bezplamenové elektrotermické atomizátory pracují ve třech teplotně odlišných krocích: napřed se vzorek z odporově vyhřívané podložky (nejčastěji grafitové) v elektrické peci odpaří, poté se odstraní těkavé látky pyrolýzou a nakonec se provede atomizace.
K izolaci analyzované spektrální čáry od ostatních čar zdroje záření se používá monochromátor (mřížka) a k detekci fotonásobič. Současné špičkové přístroje umožňují automatickou volbu analyzovaného prvku (včetně všech potřebných analytických parametrů) a vzorky jsou odebírány automaticky z podavače vzorků. V klinické biochemii jsou tato zařízení málo rozšířena, protože jsou nákladná a pokrývají poměrně úzký sortiment vyšetření. Jistý počet těchto přístrojů v oboru je ovšem nezbytný, protože stanovení většiny stopových prvků (zejména Cu a Zn) nelze spolehlivě provést jiným dostupnějším způsobem.
1.5 Fluorimetrie
Při fluorimetrických stanoveních se využívá jevu, kdy v některých látkách po ozáření dostatečně energetickým zdrojem světla (excitační záření) vzniká fotoluminiscence. Látky přitom vyzařují (emitují) světlo, jehož intenzita je přímo úměrná koncentraci fluoreskující sloučeniny. Při excitaci se molekuly dostanou na vyšší energetickou hladinu a při návratu do základního stavu se část energie vyzáří také ve formě tepla. Proto má emitované záření fluoreskujících sloučenin vždy vyšší vlnovou délku (tj. méně energie) než excitační záření, vyvolávající fotoluminiscenci. Fluoreskující sloučeniny jsou často citlivé na malé zněny pH, polarity, na přítomnost oxidačních činidel nebo zhášedel fluorescence.
Základní konstrukce fluorimetrů sestává ze zdroje zářivé energie, dvou optických separačních prvků a detektoru. Zdrojem záření jsou nejčastěji halogenové žárovky a xenonové výbojky. Světlo ze zdroje prochází buď interferenčním filtrem nebo mřížkovým monochromátorem. Dále prochází kyvetou s roztokem měřeného vzorku a emitovaná fluorescence se měří pod úhlem 90°(při měření v mikrotitračních destičkách je jiné uspořádání), kdy po průchodu filtrem nebo po difrakci reflexní mřížkou dopadá emitované světlo vybrané vlnové délky na fotonásobič.
1.5.1 Fluorescenční polarizace
Jde o speciální provedení fluorimetrického měření, při němž se k excitaci používá polarizované světlo. Metoda je užitečná zejména při stanovení malých antigenů (např. léků), kdy se využívá rozdílné rychlosti rotace malé molekuly antigenu a velké molekuly imunokomplexu, vzniklé po navázání protilátky. V imunokomplexu je zabrzděna původně volná rotace antigenu. Jestliže je imunokomplex značený fluoreskující látkou, je emitované světlo ve stejné rovině po mnohem delší dobu, než u volného antigenu, neboť u těžkého imunokomplexu se rotace výrazně zpomalila. Toho se využívá v technice fluorescenční polarizace.
Optické uspořádání je přitom kombinací fluorimetrie a polarimetrie. Halogenová žárovka vyzařuje světelné spektrum s náhodnou prostorovou orientací světla. Filtr propouští modré světlo, které prochází přes polarizační zařízení z tekutého krystalu. Tím se získává rovinně polarizované světlo, které dopadá na kyvetu s měřeným roztokem. Světlo excituje fluorescenční činidlo, vázané na imunokomplex a to pak emituje zelené světlo, které prochází filtrem a dopadá na fotonásobič.
1.6 Chemiluminiscence
Chemiluminiscence se liší od ostatních luminiscenčních jevů tím, že excitace fotonů je vyvolána chemickou reakcí, která proběhne buď po nástřiku syntetizovaného činidla, nebo se použije biologická substance (enzym luciferáza ze světlušek - chemiluminiscenční varianta se označuje jako bioluminiscence), nebo se k aktivaci činidel využívá oxidace na anodě a technika se nazývá elektrochemiluminiscence.
Pro chemiluminiscenční reakci musí být splněny tři základní požadavky:
1. Při reakci musí vznikat dostatek energie, aby došlo k excitaci elektronů. Proto musí být reakce exotermní a obvykle je to oxidace.
2. Musí existovat způsob jak tuto energii usměrnit do excitace elektronů. Jestliže se chemická energie ztrácí ve formě tepla jako obvykle, pak se chemiluminiscence neobjevuje.
3. Excitovaný produkt musí být schopný ztrácet svoji energii buď ve formě fotonu, nebo ji převádět na fluoreskující sloučeniny. Přímá emise fotonu z excitovaného produktu obvykle poskytuje krátké záblesky světla, zatímco transfér energie na fluoreskující sloučeniny se většinou projevuje jako dlouhodobá (v minutách) světelná emise.
Kvantový výtěžek (poměr celkového počtu emitovaných fotonů a celkového počtu zreagovaných molekul) se pohybuje u chemiluminiscence v rozmezí 0.1 až 10%. Citlivost chemiluminiscenčních metod je přesto obvykle významně vyšší než u izotopových metod.
Přístrojové vybavení pro tuto techniku je pestré: od jednoduchých luminometrů až po vysoce automatizované chemiluminiscenční analyzátory, ve kterých se provádí imunochemické reakce s chemiluminiscenční detekcí. Standardní luminometry se do určité míry podobají fluorimetrům. Před měřicí kyvetou ovšem nemají žádný zdroj světla ani filtr. Uspořádání za kyvetou odpovídá fluorimetrům (filtr, fotonásobič). Téměř všechny luminometry mají také nastřikovací zařízení, protože u zábleskové chemiluminiscence je nutné provést měření ihned po nástřiku reagencií. Některé luminometry měří luminiscenci v mikrotitračních destičkách.
1.7 Turbidimetrie
Optická metoda založená na měření procházejícího světla zeslabeného rozptylem na částicích se nazývá turbidimetrie. V klinické biochemii je celá řada metod založených na měření stupně zákalu - turbidity - a nejvýznamnější z nich je soubor imunochemických metod, které využívají precipitační reakce mezi antigenem a protilátkou. Při turbidimetrických měřeních je nejobtížnější získat reprodukovatelně suspenzi měřené reakční směsi, která je dostatečně stálá. K tomu účelu se používají ochranné koloidy (nejčastěji polyetylenglykol).
Absorpce záření po průchodu nehomogenním prostředím, tj. koloidním roztokem nebo roztokem zakaleným jemnou sraženinou se měří absorpčními fotometry a spektrofotometry. Fotometrická citlivost je nepřímo úměrná vlnové délce. Proto se např. specifické proteiny stanovují při nejkratší vlnové délce dosažitelné standardním fotometrem, tj. při 340 nm v blízké UV oblasti. Do střední UV oblasti nelze dál postupovat, i kdyby to spektrofometr technicky umožňoval, neboť se začne projevovat absorpce nezreagovaných bílkovin, která může hrubě zkreslit měření zákalu imunokomplexu.
1.8 Nefelometrie
Měřením intenzity difuzně rozptýleného světla na dispergovaných částicích se zabývá nefelometrie. Rozptýlené světlo vychází z roztoku všemi směry (tzv. světlo Tyndallovo) a měří se pod úhlem, který je odlišný od směru dopadajícího záření.
Pro tyto účely slouží buď nefelometrický nástavec k fotometru, u nichž se Tyndallovo světlo sleduje pod úhlem 90°, nebo jsou vyvinuty speciální přístroje - nefelometry - které mohou být plně automatizovány.
Laserový nefelometr používá jako světelného zdroje helium-neonového laseru. Tento zdroj monochromatického světla je mimořádně intenzivní a má vysoký stupeň směrovosti. Laserový paprsek prochází přes kyvetu s měřeným roztokem a rozptýlené světlo se sleduje detektorem nastaveným pod úhlem 5 až 35° (fotonkou nebo fotonásobičem).
Konvenční nefelometry používají jako světelných zdrojů žárovku s halogenovou atmosférou nebo xenonovou výbojku. Optika těchto přístrojů obsahuje navíc interferenční filtr, protože světelný zdroj poskytuje polychromatické světlo. Detektor je nastaven pod úhlem 70 až 90°, protože stupeň směrovosti světla z konvenčního zdroje je nízký. Nefelometry mohou měřit také rychlost změny rozptylu světla - kinetiku, která je přímo úměrná rychlosti vzniku imunokomplexu antigen-protilátka.
2. Elektrochemické metody
2.1 Potenciometrie
2.1.1 Iontově selektivní elektrody
V klinické biochemii se používají tři základní konstrukce ISE: ponorné, průtočné a suché elektrodové systémy (slidy). Citlivou membránu tvoří anorganická sůl (např. chloridová elektroda), sklovina (pH elektroda), polymerní matrice nebo iontoměničový roztok, nasáklý do vhodné pórovité struktury (tzv. kapalná membrána). Komerčně dostupné přístroje používají ISE pro stanovení sodných, draselných, lithných, vápenatých, hořečnatých a amonných kationtů a pro oxid uhličitý.
K měření oxidu uhličitého se používá složená elektroda; jedná se o skleněnou elektrodu, která je od měřeného prostředí oddělena membránou propouštějící CO2. Difuzí oxidu uhličitého do tohoto prostředí vzniká ve vodném prostředí disociovaná kyselina uhličitá a množství vzniklých protonů je stanoveno pH elektrodou. Jako referenční elektroda je téměř ve všech případech používána Ag/AgCl elektroda. Všechny ISE jsou elektrody s velkým odporem a přesnost jejich měření závisí na citlivosti voltmetru.
Při stanovení v moči se musí vzorky vždy ředit diluentem s velkou iontovou silou, aby se kompenzoval vliv kolísání iontové síly v samotném vzorku moče. Současné ISE analyzátory jsou vybaveny podavačem vzorků, dokonalým proplachovacím zařízením a možností automatické rekalibrace.
2.1.2 Enzymové elektrody
2.2. Polarografie
Elektrochemická metoda, při které se měří rozdíl potenciálů (napětí) mezi dvěma elektrodami, se nazývá potenciometrie. Jedna z elektrod pracuje jako referenční (srovnávací) a má konstantní potenciál, který nezávisí na složení měřeného roztoku. Druhá elektroda je označována jako indikační (měrná) a její potenciál závisí na aktivitě měřeného analytu ve zkoumaném roztoku. Napětí mezi oběma elektrodami se měří digitálním voltmetrem. Elektrochemické reakce probíhají téměř výhradně na povrchu elektrod. Jde tedy o reakce heterogenní, kde velmi záleží na povrchu elektrod, který musí být dostatečně stálý a reprodukovatelný. Biologické tekutiny jsou složité systémy a obsahují celou řadu povrchově aktivních látek, takže je to technicky dost obtížné.
Při použití iontově selektivních elektrod (ISE) rozeznáváme dva typy metod. Nepřímé metody, kde je vzorek vkládán do měřicí komůrky s dosti velkým obsahem diluentu o vysoké iontové síle. Jestliže se měření provádí bez ředění, hovoříme o přímé metodě. V tomto případě lze pracovat i s plnou krví z kapiláry, podobně jako při stanovení parametrů acidobázické regulace.
Podstatou konstrukce enzymových elektrod je předřazení membrány s imobilizovaným enzymem (např. ureázou pro stanovení močoviny nebo glukózaoxidázou pro stanovení glukózy) před vlastní elektrochemické čidlo. Stanovovaný substrát difunduje do enzymové membrány, kde reaguje s imobilizovaným enzymem na produkt, který se pak deteguje potenciometricky nebo ampérometricky.
Při této elektrochemické metodě měříme intenzitu proudu ampérometricky při konstantním vnějším napětí (potenciálu). Na tomto principu je založena Clarkova elektroda, která slouží ke stanovení množství kyslíku. Kyslík rozpuštěný ve vzorku nebo v pufru difunduje přes hydrofobní membránu propustnou pro plyny ke katodě, která je obvykle z platiny. Zde se při konstantním vnějším potenciálu - přepětí - redukuje na vodu podle rovnice:
Jako anoda slouží Ag/AgCl elektroda. V klinické biochemii se s Clarkovou elektrodou setkáváme nejčastěji u acidobázických analyzátorů, kde se používá k měření parciálního tlaku kyslíku a v některých analyzátorech glukózy, kde se touto elektrodou sleduje úbytek kyslíku v glukózaoxidázové reakci.
2.3 Coulometrie
Je to analytická metoda, v níž se ke stanovení koncentrace látky v roztoku používá měření prošlého náboje při elektrochemické reakci. V naší praxi se používá coulometrie za konstantního proudu - ampérostatická coulometrie, běžně nazývaná coulometrická titrace. Tento postup se používá pouze ke stanovení chloridů. Stanovovaná látka reaguje s činidlem vzniklým na jedné z elektrod ve vhodném elektrolytu. Reakce musí probíhat se 100 % proudovým výtěžkem a činidlo musí reagovat rychle. Např. stříbrná anoda vyvíjí Ag+ ionty, které s chloridovými ionty vytvářejí sraženinu AgCl. Referenční elektroda je merkuro-sulfátová. Konec titrace (tj. vysrážení všech chloridových iontů) se indikuje potenciometricky dalšími dvěma elektrodami.
Podle délky titrace (t) se při konstantním proudu (I) určí náboj (Q) dle vztahu Q = I . t a tomu odpovídající množství titrované látky.
2.4 Konduktometrie
Elektrochemická metoda založená na měření vodivosti analyzovaného roztoku se nazývá konduktometrie. Elektrická vodivost roztoku závisí na koncentraci iontů, jejich pohyblivosti, disociaci a teplotě roztoku. K měření se používají dvě platinové elektrody, mezi kterými se měří vodivost.
Přístroje pro měření vodivosti, konduktometry, se používají zejména ke sledování čistoty destilované a deionizované vody. Na tomto principu jsou založeny také impendanční elektrody pro stanovení hematokritu a konduktometrický princip se často používá v hematologii u počítačů krvinek.
3. Elektroforetické metody
Elektroforéza je analytická metoda založená na rozdílné pohyblivosti částic látky v elektrickém poli, která závisí na velikosti náboje, velikosti molekul, jakož i na vlastnostech prostředí.
3.1 Zónová elektroforéza
Při dělení na acetylcelulózových fóliích dochází k distribuci převážně podle velikosti náboje. K dělení se v elektroforetické vaně používá napětí 10 - 30 V/cm, intenzita proudu do 0,3 až 0,5 mA/cm a elektroforéza trvá 15 - 30 minut. Po ukončení dělení se jednotlivé složky fixují a barví. Pak se fólie odbarví, příp. zprůsvitní a vysuší. Při práci s agarem (směs polysacharidů agarózy a agaropektinu) anebo s purifikovanou agarózou se postupuje podobně. Použití agaru má relativní nevýhodu v tom, že jeho vlákna obsahují řadu fixních disociovatelných skupin, které za alkalického pH nesou negatívní náboj. To se projevuje elektroendoosmózou, tedy tokem pufru směrem ke katodě, tj. proti směru dělení např. většiny sérových bílkovin. To může při elektroforéze dokonce vyvolat zpětný pohyb některých frakcí, takže místo k anodě se "pohybují" ke katodě.
Při elektroforéze na polyakrylamidovém gelu (PAGE) se látky dělí nejen na základě elektrického náboje, ale i podle velikosti molekul. Efekt molekulového síta se zesílí v polyakrylamidovém gelu s gradientem hustoty. V tomto uspořádání se ve směru pohybu dělených látek zvyšuje koncentrace akrylamidu, a tím se zmenšuje při polymeraci velikost ok sítě. V místech zastavení pohybufrakce se vytvoří linie, aprotose tento typ elektroforézy nazývá disková. Rozlišovací schopnost tohoto typu elektroforézy je mnohem vyšší než u předchozích nosičů. Jestliže se k polyakrylamidovému gelu přidá laurylsíran sodný (dodecylsulfát sodný, SDS), mají všechny molekuly téměř stejný elektrický náboj a dělí se jen podle velikosti svých molekul.
Vyhodnocení obarvených elektroforeogramů se provádí na densitometru tak, že se elektroforeogram automaticky posunuje nad štěrbinou, kterou prochází světlo zvolené vlnové délky (z žárovky s halogenovou atmosférou, světlo emitující diody nebo výjimečně i laseru). V místě frakcí dochází k částečné absorpci záření. To se projeví při jeho dopadu na čidlo (fotonku, fotonásobič) a převodu signálu na analogový záznam elektroforeogramu. Po zpracování integrátorem získáme číselné výsledky jednotlivých elektroforetických frakcí. Tento způsob je častý při rutinních elektroforézách sérových bílkovin, kdy na jedné podložce může být současně i několik desítek elektroforeogramů. Po ukončení snímání prvního elektroforeogramu se měřená deska automaticky posune a může se vyhodnocovat další dráha.
3.2 Izoelektrická fokusace
Při izoelektrické fokusaci je nosičem agarózový nebo polyakrylamidový gel. Metoda se používá zejména pro dělení izoenzymů. Předností je vysoká ostrost dělení (rozlišovací schopnost), nevýhodou je pak vyšší cena amfolytových pufrů a zdlouhavost metody.
3.3 Izotachoforéza
Předností izotachoforézy je rychlost provedení (někdy postačují 4 minuty) a ostrost dělení. Tímto způsobem lze stanovit několik aniontů (nebo kationtů) současně. V klinické biochemii se tímto způsobem stanovují hlavně anionty (laktát, pyruvát, ketokyseliny aj.)
3.4 Kapilární elektroforéza
Kapilární elektroforéza je rychlá, má vysokou rozlišovací schopnost a nízkou spotřebu vzorku. Stupeň automatizace je značný, součástí zařízení může být automatické dávkování, několikanásobný nástřik, výměna nebo doplnění pufru, změna polarity, program napětí a tlaku a sběr frakcí. V klinické biochemii se kapilární elektroforéza používá dosud omezeně, hlavně při diagnostice metabolických poruch a subfrakcí imunoglobulinů.
4. Fyzikální metody
4.1 Osmometrie
V laboratorní práci se používá nepřímé měření osmotického tlaku. Vychází se z měření těch vlastností roztoků, které se mění v závislosti na změně osmolality. V klinické biochemii se používají dva typy osmometrů. První typ využívá snížení teploty tuhnutí roztoku v závislosti na koncentraci částic v roztoku (kryoskopie). Osmometry musí být vybaveny velmi citlivým teploměrem (s rozlišitelností tisíciny °C), protože snížení teploty tuhnutí je velmi malé (přibližně o 0,5 °C v séru). Druhý typ sleduje snížení tenze par rozpouštědla nad roztokem (zvýšení teploty varu, ebulioskopie), resp. snížení rosného bodu par nad roztokem v závislosti na koncentraci částic v roztoku pomocí termoelektrického hygrometru. Osmometry mohou být vybaveny podavačem vzorků a automatizovány.
Rozhodující pro osmolalitu biologického vzorku je koncentrace sodných iontů, močoviny a glukózy. V případě, že není k dispozici osmometr, lze osmolalitu orientačně vypočítat takto (viz též kapitola 2).
Jde o nejrozšířenější elektroforetickou metodu. Využívá jako nosiče acetylcelulózu, nebo různé gely (agarový, agarózový nebo polyakrylamidový). Pro kvalitu separace jsou rozhodující:
- homogenita a velikost elektrického pole
- homogenita a velikost pórů nosiče a jeho fyzikálně-chemické vlastnosti,
- pH pufru, jeho iontová síla a případné interakce se vzorkem.
Od předchozích technik se izoelektrická fokusace liší tím, že dělení probíhá v gradientu pH, který se mění rovnoměrně od kyselé do alkalické oblasti (u anody je pH nejnižší a směrem ke katodě roste). Gradientu se dosahuje pomocí amfolytů, tj. elektrolytů, obsahujících směsi organických látek se skupinami -NH2 a -COOH), které se ve stejnosměrném elektrickém poli seřadí podle velikosti svého izoelektrického bodu (pI) a vytvoří tak gradient pH. Izoelektrický bod je hodnota pH, při níž je pro danou látku vyvážen počet kladných a záporných nábojů, takže se molekula jeví navenek jako elektroneutrální.
Je to analytická metoda pro dělení kationtů a aniontů ve stejnosměrném elektrickém poli podle jejich rozdílných pohyblivostí. U izotachoforézy je vzorek umístěn mezi dva různé elektrolyty s odlišnou pohyblivostí iontů. Na čele se pohybuje vedoucí elektrolyt, který musí mít větší pohyblivost než kterýkoliv z kationtů resp. aniontů (podle typu izotachoforézy) obsažených ve vzorku. Na konci kapiláry je koncový elektrolyt, který má menší pohyblivost než kterýkoliv z kationtů resp. aniontů (podle typu izotachoforézy) obsažených ve vzorku. Všechny ionty se pak kapilárou pohybují stejnou rychlostí k opačně nabitým elektrodám, avšak budou seřazeny podle svých pohyblivostí. Po určité době jednotlivé složky vytvářejí ostře oddělené zóny seřazené těsně za sebou. To, že se pomalejší ionty pohybují stejně rychle jako ionty pohyblivější je možné díky tomu, že v každé zóně je jiný gradient potenciálu, který je nepřímo úměrný vodivosti roztoku v zóně. Na konci kapiláry je umístěné čidlo detektoru, které měří vodivost nebo absorpci UV světla dané vrstvy. Naměřený signál se pak převede na analogový zapisovač a může být vyjádřen také v číselné formě. Při izotachoforéze pracujeme s vysokým napětím (až 35 kV).
Provádí se v tenkých skleněných kapilárách (světlost 0,1 mm) dlouhých až 1 m, které mohou být plněny polyakrylamidovým gelem (PAA) nebo analytickým pufrem. Při práci s PAA je princip dělení stejný jako u zónové elektroforézy. V případě použití analytického pufru se obvykle používá fosfátový pufr a vyšší napětí. Detekce frakce se na rozdíl od zónové elektroforézy provádí UV absorpčním detektorem nebo detektorem diodového pole.
Tlak rozpuštěných, zejména nízkomolekulárních látek a iontů v roztoku odděleném polopropustnou membránou od samotného rozpouštědla se nazývá osmotický tlak. Osmotický tlak je přímo úměrný celkovému počtu rozpuštěných nebo disociovaných částic. Pokud látka disociuje, je každá její disociovaná část osmoticky aktivní částicí. Nedisociovaná látka představuje jen jednu osmoticky aktivní částici. Látková koncentrace osmoticky aktivních částic v 1 kg rozpouštědla se označuje jako osmolalita (mmol/kg). Měření osmolality se nazývá osmometrie.
Údaje v hranatých závorkách jsou látkové koncentrace v mmol/l.
4.2 Onkometrie
Koloidně osmotický tlak plazmatických bílkovin se nazývá onkotický tlak. K měření se používá polopropustná membrána, která odděluje tekutiny o různé koncentraci vysokomolekulárních látek. Principem měření onkotického tlaku onkometrem je sledování rozdílu tlaku mezi referenční komůrkou a komůrkou s měřeným vzorkem, které jsou oddělené polopropustnou membránou, pomocí indikátoru tlaku. Výstupní signál z indikátoru tlaku je zesílen a převeden na základě kalibrace přímo na jednotky tlaku [kPa]. Onkometry se v klinické biochemii používají vzácně a většinou bývají součástí přístrojové výbavy jednotek intenzívní péče a ARO.
5. Izotopové metody
5.1 Scintilační systémy
5.2 Využití gama-záření
Citlivost obou metod závisí na:
Pro měření gama-záření se používají vícekanálové gama-měřiče (gama-počítače), schopné analyzovat současně více vzorků. Radioaktivita se měří jako počet impulzů za minutu. Detekční systém je založen na bázi krystalů NaI, které jsou kompaktně spojené s fotonásobičem a celý detektor je umístěný v olověném stínítku. Pipetování vzorků, imunochemická reakce, promývání (separace imunokomplexu a volných reaktantů) a měření radioaktivity mohou být plně automatizovány.
6. Chromatografické metody
6.1. Chromatografie na tenkých vrstvách (TLC)
Detekce může být destruktivní (reakce s
H2SO4, KMnO4, K2Cr2O7) nebo nedestruktivní (UV světlo, přechodná absorpce par jódu). V současné době se také používá výraz "vysoce účinná chromatografie na tenkých vrstvách" (HPTLC) pro komerční desky s velmi tenkou vrstvou silikagelu s malou velikostí částic (do 10 µm), které umožňují podstatně účinnější dělení. V klinické biochemii se chromatografie na tenkých vrstvách používá méně než v minulosti a spíše se dává přednost exaktnějším chromatografickým metodám.
6.2 Vysokoúčinná kapalinová chromatografie
Při dávkování vzorku do kapalinového chromatografu lze v případě nízkotlaké verze použít přímý nástřik na kolonu přes elastickou membránu. Vysokotlaká HPLC vyžaduje použít speciální ventil s dávkovací smyčkou. Vícecestný ventil umožňuje nástřik do smyčky a současně jinou cestou prochází mobilní fáze ze zásobníku do kolony. Po přepnutí ventilu se vytlačí vzorek mobilní fází ze smyčky na kolonu.
Na koloně se látky rozdělují zpravidla eluční metodou. Kolony mohou být také mírně vyhřívány, ale zpravidla se ohřev nepoužívá. Na výstupu z kolony je připojen detektor UV-VIS, fluorimetrický, detektor diodového pole, popřípadě elektrochemický, kde se sleduje coulometricky oxidoredukční reakce stanovovaných látek na pracovní elektrodě. Získaný signál jde na analogový zapisovač a je číselně vyhodnocen integrátorem. Jako detektor lze také použít hmotnostní spektometr, což je analyticky vynikající, ale technicky i finančně velmi náročné řešení, protože je nutné propojit vysokotlakou HPLC část s hmotnostním spektrometrem, kde je naopak vysoké vakuum.
6.3 Plynová chromatografie
Dělení probíhá v plynovém chromatografu. Vzorky se nastřikují do vyhřívaného dávkovače přes plynotěsnou elastickou membránu velmi přesnou stříkačkou. Pak dochází ke zplynění vzorku a jeho páry jsou nosným plynem, jímž je zpravidla dusík nebo argon, unášeny do vyhřívané kolony. Používají se kolony náplňové nebo kapilární. Při průchodu kolonou se jednotlivé látky dělí na principu adsorpční nebo rozdělovací chromatografie. Po rozdělení procházejí separované sloučeniny detektorem. Detektor pracuje na principu plamenoionizačním, kde se rozdělené složky zavádějí do plamene vodík-vzduch a sleduje se jejich ionizace, nebo se jedná o detektor elektronového záchytu, kde dochází k záchytu elektronů z beta-zářiče eletronegativními atomy stanovované látky a tím ke snížení měřeného ionizačního proudu. Signál jde na analogový zapisovač a integrátorem je zpracován na číselný výstup.
Pro stanovení jednotlivých složek separovaných plynovou chromatografií lze použít také hmotnostního spektrometru. Tento způsob detekce nabízejí špičkové plynové chromatografy. V iontovém zdroji hmotnostního spektrometru při vysokém vakuu dostávají molekuly pozitivní náboj. Pak procházejí elektrickým polem, kde se jednotlivé fragmenty i molekulový kation urychlují podle velikosti náboje a kolmo působícím magnetickým polem, kde se vychylují podle své hmotnosti a dopadají na detektor (počítač částic). Tak vzniká hmotnostní spektrum, které charakterizuje nejen kvantitativní zastoupení látek, ale také velmi spolehlivě vypovídá o jejich kvalitě (tj. o jakou sloučeninu se jedná).
V klinické biochemii se plynová chromatografie používá zejména při stanovení léčiv a jejich metabolitů, a dále pro stanovení alkoholu, organických kyselin, hormonů a steroidů.
7. Automatické analyzátory
7.1. Univerzální automatické analyzátory
Analyzátory jsou selektivní a vykonávají z každého vzorku pouze požadované testy. Reagencie jsou v jednom nebo ve dvou zásobnících, které jsou kruhové otočné, ale mohou být i obdélníkové nebo jiného tvaru. U analyzátorů střední a vyšší cenové kategorie je alespoň část prostoru s reagenciemi chlazena a chlazen může být také zásobník vzorků.
Běžná spotřeba vzorku (sérum, plazma, moč, likvor) obvykle nepřesahuje 5 µl (obvyklý rozsah je 1 až 30 µl) a celková spotřeba reagencií nepřesahuje 250 µl (obvyklý rozsah je 100 až 500 µl). Zpravidla je možné přidávat k napipetovanému vzorku dvě reagencie (1 až 4 reagencie). Moderní analyzátory používají identifikaci vzorků a činidel pomocí čárového kódu (bar code). Vložit urgentní vzorek (STATIM) nebo změnit prioritu již objednaného vzorku umožňují moderní analyzátory v kterémkoliv okamžiku provozu.
Univerzální automatický analyzátor je vždy vybaven pipetovací stanicí, kde je jeden nebo více pipetorů. Pipetování je jedním z rozhodujících kroků přesné a správné analýzy. Proto se zpravidla vzorek a činidlo z pipety vypláchne deionizovanou vodou. Pipety jsou oplachovány také zevně a jejich povrch bývá nesmáčivý. Po napipetování každého činidla se reakční směs zamíchá vnější rotací, vibrací, ultrazvukem nebo zevnitř míchadlem. Provede se inkubace reakční směsi při 37 °C (výjimečně při jiné teplotě) a následuje měření ve fotometrické části.
Zdrojem světla je nejčastěji wolframová žárovka s halogenovou atmosférou, případně xenonová nebo rtuťová výbojka. Světlo zvolené vlnové délky získané interferenčním filtrem dopadá na zkumavku (kyvetu) a část je absorbována měřeným roztokem. Zbytek dopadá na fotonku a získaný signál je upraven a vyhodnocen. Jinou možností je nepoužít filtr, ale prošlé světlo rozložit mřížkou a nechat dopadnout na zjednodušený detektor diodového pole, který má 16 diod (standardní HPLC detektor diodového pole má více než 200 diod).
Univerzální analyzátory mohou být stolní přístroje, ale také mohou sestávat z několika rozměrných modulů. Rychlost analýzy se pohybuje od několika desítek analýz/h do několika tisíc analýz/h (tyto vysoce kapacitní přístroje v ČR nejsou).
Jestliže jsou výsledky mimo zadané rozmezí, mohou být automaticky opakovány v odlišném poměru vzorku a činidla tak, aby naměřená absorbance odpovídala hodnotám kalibrační křivky. Součástí univerzálního analyzátoru může být ISE modul pro stanovení aktivity sodných, draselných a popřípadě chloridových iontů. Ionselektivní elektrody a pomocné roztoky pro tento modul mohou být používány jen od výrobce analyzátoru.
Software analyzátoru bývá vybaven diagnostikou chyb a v případě závažné poruchy se provoz automaticky zastaví a ohlásí se závada nebo se spustí zvukový alarm. Analyzátory mají také zpravidla obousměrné rozhraní (interace) pro připojení analyzátoru na nadřazený počítač, na laboratorní řídicí a informační systém nebo na nemocniční informační síť.
7.2 Speciální automatické analyzátory
Imunochemické analyzátory se liší od standardních univerzálních analyzátorů tím, že jsou zpravidla určeny k automatizaci heterogenní imunoanalýzy. Jsou totiž schopné provést separační krok (jeden nebo více) a oddělit tím navázaný imunokomplex na stěně zkumavky, mikrotitrační destičky, frity, na kuličkách, na
mikrokuličkách nebo na magnetickýcch zrnech od volných reaktantů. Separace se děje tak, že se pevná fáze s navázaným imunokomplexem propláchne a volné reaktanty se odsají nebo odfiltrují. Pak se provádí detekce enzymového markeru fotometru, fluorimetricky nebo chemiluminometricky. Analyzátory provádějící fluorescenční a chemiluminiscenční detekci používají citlivější detektor než ostatní analyzátory, tj. fotonásobič (viz výše část
1.5 a
1.6).
U imunochemických analyzátorů je pro úspěch analýzy důležitější kvalita reagencií a technologie provedení imunochemické reakce než důmyslnost automatického analyzátoru. Existují i univerzální imunochemické analyzátory, ale možnosti pro ně nejsou tak široké. Většina výrobců nabízí reagencie použitelné pouze pro své přístroje a obvykle s nimi dosahuje lepších výsledků, než se dosahuje s volně použitelnými imunoreagenciemi na univerzálních imunochemických analyzátorech.
Závěrem je třeba připomenout, že do kategorie imunochemických analyzátorů se také počítají nefelometrické analyzátory, které nepotřebují provádět (a ani neumí) separační krok.
8.Doporučená literatura:
I. BILYK, R. NEMEC: Vybrané laboratorní metody. Avicenum,zdrav.nakladatelství Praha 1988
Autoři elektronického zpracování a hypertextové koncepce: MUDr.Petr Kocna CSc. a Mgr.Lukáš Loub, Ústav klinické biochemie VFN a 1.LF UK Praha
Elektronická verze publikace "Vybrané kapitoly z klinické biochemie" je upravena pro hypertextovou vazbu mezi podrobně rozvedeným obsahem (v horním okně) a vlastním textem (v okně spodním). Hypertextové odkazy na jiné části textu jsou uvedeny výhradně tam, kde uvádí tyto odkazy autor příslušné kapitoly v tištěné verzi skript.
Pro zobrazení Vybraných kapitol z klinické biochemie nabízíme 2 varianty hypertextu. Uživatelům, kteří mají dostatečně výkonný hardware (Pentium, 32MB operační paměti, prostředí Windows 95/98/NT a prohlížeč Internet Explorer 4.0 doporučujeme optimální verzi, verzi s vyššími HW nároky, která obsahuje celý text v jediném HTML souboru a umožňuje prohledávat fultextovým nástrojem v rozsahu celé publikace. Pro uživatele s méně výkonným hardware a především pro uživatele Windows 3.11 s Internet Explorerem 3.0 nabízíme variantu - verzi s menšími HW nároky, ve které jsou jednotlivé kapitoly rozděleny do samostatných HTML souborů. Hypertextové vazby jsou plně zachovány, jako ve verzi optimální, nelze však prohledávát hypertextově celý text, ale pouze po jednotlivých kapitolách.
Lišta mezi obsahem a vlastním textem je nastavitelná do libovolné polohy tak, aby bylo možno zobrazit např. pouze obsah, nebo naopak jen vlastní text. Posun lišty proveďte uchopením lišty kurzorem a tahem myši nastavte do požadované pozice.
Celý text (nebo jednotlivé kapitoly - podle zvolené verze hypertextu) je možno tzv. fulltextově prohledávat pomocí interní funkce Vašeho prohlížeče, který používáte k zobrazení tohoto HTML textu. V případě Internet Exploreru je tato funkce spustitelná z nabídky programu nebo pomocí tzv. horké klávesy CTRL + F. Vyhledávaný termín je nutno zapsat to okénka této funkce a po potvrzení klávesou ENTER je nalistován první výskyt daného termínu, který je barevně označen. Pro vyhledání dalšího výskytu je možno použít tlačítka "Další vyhledávání, resp. další výskyt".
Obrázky jsou zobrazeny zmenšenou ikonou obrázku přímo v textu. Celý, zvětšený obrázek je možno zobrazit kliknutím na hypertextový odkaz (většinou označení čísla obrázku) nebo přímo na zmenšenou ikonu obrázku. V poslední kapitole 12 je uveden přehled všech obrázků a tabulek, rovněž s přímými hypertextovými odkazy.
Tab.2.1 Koncentrace iontů a objemy ztrát tělesných tekutin (upraveno podle Nejedlého, 1980)
Obr.2.1 Schéma tří prostorů tělesných tekutin a pohybu komponent, které určují osmolalitu séra
Při některých imunochemických technikách se používá značení reaktantů atomy tricia (3H). Výhodou tohoto značení je skutečnost, že se jen velmi málo změní hmotnost molekuly a její vlastnosti. Nevýhodou je nutnost používání speciálních scintilačních počítačů. Tricium totiž vyzařuje pouze měkké beta-záření, které neprochází stěnou zkumavky a proto je nutné tyto analytické reakce provádět s příměsí organických látek obsahujících 3 až 4 aromatické kruhy, tzv. scintilátorů. Působením beta záření (tj. elektronů) tyto látky vyzařují fotony a mohou být již detegovány fotonásobičem. Scintilační počítače se používají v klinické biochemii zcela výjimečně.
Při těchto metodách se používá značení 125I, což je gama-zářič, tedy zdroj tvrdého záření. Radioimunoanalýza a imunoradiometrie byly první moderní imunochemické metody, které využily tohoto radionuklidu a jsou dosud v klinické biochemii velmi rozšířeny. Při radioimunoanalýze (RIA) se značí antigen, který se přidává do reakce a soutěží se stanovovaným antigenem o omezený počet míst na protilátce. Při metodě imunoradiometrické (IRMA) je značená protilátka. Jde o nekompetitivní metodu, kdy se na kotvící protilátku (na pevné fázi) naváže stanovovaný antigen a pak se přidává druhá protilátka (značená 125I) v nadbytku. Tento typ metod se označuje jako sendvičové.
a) afinitě protilátky k měřenému antigenu
b) molekulové hmotnosti značkovadla a protilátky
c) objemu inkubačního média
d) přesnosti analýzy.
Při těchto postupech se využívá principu rozdělovací, adsorpční, ionexové (výměna iontů) i afinitní (specifická vazba látek na ligand, navázaný na nosič) chromatografie. Před plotnami připravovanými v laboratoři se dnes dává přednost průmyslově vyráběným hliníkovým fóliím s litým silikagelem nebo oxidem hlinitým. Vzorky se nanášejí pipetou a vyvíjejí se v chromatografické vaně (komoře) v soustavě rozpouštědel. Je možné použít i dvourozměrné tenkovrstevné techniky, kdy se chromatogram po doběhnutí čela rozpouštědla na konec desky vysuší, deska se otočí o 90° a provede se chromatografie v kolmém směru s jinou soustavou rozpouštědel.
Při kapalinové chromatografii se látky dělí ve dvoufázovém dělicím systému na základě adsorpce, výměny iontů, fyzikální distribuce látek mezi kapalnou mobilní a s ní nemísitelnou kapalnou stacionární fází, nebo na principu pronikání molekul z mobilní fáze do pórů tuhých částic, které mají funkci molekulového síta. Celý děj se odehrává ve speciálně konstruovaných trubicích, nazývaných kolony. Účinnost všech typů chromatografických kolon se hodnotí podle počtu teoretických pater, které odpovídají výkonem zhruba patrům destilační kolony. Čím je větší počet pater, tím je kolona účinnější. Účinnost chromatografických kolon je obrovská, dosahuje i několika set tisíc teoretických pater. Vysokoúčinná kapalinová chromatografie (HPLC) pracuje s úzkými ocelovými, skleněnými nebo křemennými kolonami, které obsahují nosné částice (<10 µm) se stacionární fází. Průtok mobilní fáze neprobíhá účinkem gravitace jako u klasické kapalinové chromatografie, ale obvykle pod určitým tlakem. Někdy postačuje 1 MPa, skleněné kolony vydrží až 30 MPa, ale čerpadla mohou vyvinout tlak kolem 100 MPa. Častěji se používá nízkotlaká HPLC (několik MPa) než vysokotlaká HPLC (desítky MPa).
Významnou částí kapalinového chromatografu jsou čerpadla. Moderní přístroje využívají obvykle dvě pulzní pístová čerpadla, jejichž činnost je fázově posunuta a pohybují se tak, aby došlo k maximálnímu potlačení pulzace toku mobilní fáze.
Mobilní fáze může mít konstantní polaritu, kdy čerpadlo pumpuje do kolony jediné rozpouštědlo (např. metanol). Tento režim, který se nazývá izokratický, se používá nejčastěji. Je také možné měnit eluční sílu mobilní fáze tak, že se postupně mění zastoupení dvou nebo více rozpouštědel. Tuto gradientovou eluci lze provést jak v nízkotlaké, tak ve vysokotlaké variantě. Stacionární fáze je nepolární a mobilní fáze jue polární. Nejrychleji se tedy eluují nejvíce polární sloučeniny.Toto uspořádání se nazývá reverzní (obrácené) fáze. Název reverzní má historickou podstatu: v začátcích HPLC byla stacionární fáze polárnější než mobilní, dnes je to obráceně - proto reverzní (obrácené) fáze.
HPLC má v klinické biochemii podobné využití jako plynová chromatografie, ale navíc lze tuto metodu aplikovat i při stanovení termolabilních látek, např. enzymů. Existují plně automatizované HPLC systémy schopné nepřetržitého provozu, kde lze udělat i několik set analýz za 24 hodin.
Je to fyzikálně chemická metoda, při které dochází k dělení směsi látek na základě distribuce mezi mobilní (pohyblivou) a stacionární (zakotvenou) fází. Mobilní fází je plyn, stacionární fází může být pevná látka a metoda se označuje jako adsorpční plynová chromatografie, nebo kapalina, a pak se jedná o rozdělovací plynovou chromatografii. Těmito technikami můžeme dělit všechny látky, které lze po zahřátí kolony na pracovní teplotu (až 400 °C) převést bez rozkladu na plynnou fázi. U látek s vysokou teplotou varu se provede derivatizace, tj. reakce, jejímž výsledkem jsou deriváty původní sloučeniny s nižší teplotou varu. Pevné vzorky se předem rozpustí v těkavých kapalinách.
Rozhodující část rutinních analýz v klinicko-biochemických laboratořích (asi 80 %) provádějí automatické analyzátory. Jedná se o zařízení, která umožňují automatické zpracování vzorku, měření signálu a zpracování získaných dat. Automatický analyzátor je nejvýkonnější analytický přístroj v laboratoři. Univerzální analyzátory umožňují pracovat se standardně používanými reagenciemi různých firem. V současné době se používají zejména diskrétní analyzátory, kde jsou analytické reakce pro každý typ vyšetření prováděny v separátní zkumavce. Jen výjimečně se měří dvě různé reakce současně při dvou rozdílných vlnových délkách. Reakční zkumavka může být zároveň použita jako měřicí kyveta. Separátní měřicí kyveta, do které se postupně čerpají předem připravené reakční směsi, se vyskytuje jen u nejmenších analyzátorů většinou staršího typu, protože toto uspořádání zpomaluje analytický proces, zejména při kinetických měřeních. Vzorky jsou umístěny ve zkumavkách nebo "kepech", malých kónických zkumavkách (z anglického "cup" = šálek, kalíšek) umístěných na otočných talířích, v posuvných stojanech nebo v řetězových unašečích. Kepy a přesné nastavení pipetorů umožňují, aby mrtvý tj. nepoužitelný objem vzorku byl malý (10 až 50 µl).
Jsou to automatické analytické systémy schopné pracovat pouze s reagenčními soupravami výrobce analyzátoru. Do této kategorie patří elektrochemické analyzátory používající ionselektivní, enzymové, polarografické a impendanční elektrody, analyzátory na principu reflexní fotometrie (měření na analytických filmech) a především imunochemické analyzátory.
H. KELLER: Klinisch-chemische Labordiagnostik für die Praxis. Analyse, Befund, Interpretation. G. Thieme Verlag Stuttgart, New York 1991
O. SONNTAG: Dry chemistry. Analysis with carrier-bound reagents. Elsevier Amsterdam, London, N. York, Tokyo 1993
D.P. STITES, A.I. TERR: Základní a klinická imunologie. Victoria Publishing a.s. Praha 1994
S.C. ANDERSON, S. COCKAYNE: Clinical chemistry. Concepts and Applications. W.B. Saunders Co., Harcourt Brace Jovanovich Inc. Philadelphia 1993
M. KODÍČEK, V. KARPENKO: Biofyzikální chemie. Učební text Fakulty potravinářské a biochemické technologie VŠCHT Praha. Vydavatelství VŠCHT Praha 1997
Informace k elektronickému textu, ovládání programu
Tab.2.2 Koncentrace iontů v tělesných tekutinách
Tab.4.1 Laboratorní nálezy u renální tubulární acidózy (RTA)
Tab.5.1 Jaterní soubor biochemických vyšetření
Tab.5.2 Dělení biochemických vyšetření jater
Tab.5.3 Rozdělení hyperbilirubinémií podle příčin
Tab.7.1 Přehled lipoproteinů
Tab.7.2 Přehled apoproteinů
Tab.7.3 Sekundární hyperlipoproteinémie
Tab.7.4a Referenční intervaly cholesterolu
Tab.7.4b Referenční intervaly HDL a LDL cholesterolu
Tab.7.5 Typizace hyperlipoproteinémií podle WHO
Tab.8.1 Přehled dědičných metabolických poruch purinů a pyrimidinů
Tab.8.2 Rozpustnost purinových metabolitů při různém pH moče
Tab.8.3 Přehled diagnosticky významných metabolitů v moči u jednotlivých defektů
Tab.8.4 Klinické a laboratorní nálezy indikující vyšetření purinového metabolismu
Tab.10.1. Normální hodnoty hormonálních vyšetření-ranní odběr
Obr.2.2A Normohydratace s hyponatrémií
Obr.2.2B Normohydratace s hypernatrémií
Obr.2.3A Dehydratace s normonatrémií
Obr.2.3B Dehydratace s hyponatrémií
Obr.2.4AObr. 2.4.A. Dehydratace s hypernatrémií
Obr.2.4B Korekce dehydratace s hypernatrémií, 1.krok
Obr.2.4C Korekce dehydratace s hypernatrémií, 2.krok
Obr.2.5 Hyperhydratace s normonatrémií
Obr.2.6 Hyperhydratace s hyponatrémií
Obr.2.7 Hyperhydratace s hypernatrémií
Obr.2.8 Závislost kalémie a pH
Obr. 3.1 Znázornění velikosti změn pH
Obr. 3.2 Schéma poměru kationtů a aniontů v krvi
Obr.3.3 Starší představa acidobázické regulace
Obr. 3.4 Schéma acidobázické rovnováhy s použitím SID a Atot
Obr. 3.5 Graf acidobázické regulace
Obr.4.1 Patologické nálezy při elektroforéze bílkovin moči v agarózovém gelu
Obr.5.1 Časový profil ALP, AST a GGT u akutní alkoholické hepatitidy
Obr.5.2 Průkaz p-Glutathion-S-transferázy v jaterní tkáni
Obr.5.3 Elektroforéza izoenzymů alkalické fosfatázy
Obr.6.2 Kategorizace laboratorních vyšetření v gastroenterologii
Obr.6.3 Nepřímé funkční testy
Obr.6.4 Vyšetření funkce tenkého střeva
Obr.6.5 Vitamin A
Obr.6.6 Dechové testy
Obr.6.7 Glutenová enteropatie
Obr. 9.1. Centrální řízení sekreční aktivity štítné žlázy
Obr. 10.1 Schéma biosyntézy steroidních hormonů v kůře nadledvin
Obr. 10.2 Schéma biosyntézy sexagenů v gonádách a v periferních tkáních
Obr. 10.3 Hypotalamo-hypofyzární-testikulární osa
Obr. 10.4 Hypotalamo-hypofyzární-ovariální osa