Biochemická vyšetření u chorob štítné žlázy
Autor kapitoly: doc.MUDr.Petr Schneiderka CSc., Ústav klinické biochemie VFN a 1.LF UK Praha
Diagnostika chorob štítné žlázy a sledování jejich léčby patří k ukázkovým příkladům vzájemného prolínání klinických a laboratorních činností. Obě vycházejí z fyziologických a patobiochemických znalostí, obě však vyžadují syntetický přehled o celé šíři aktuálně dostupných vyšetřovacích metod, terapeutických postupů a možností monitorování jejich efektu.
Již od poloviny 80.let můžeme zaznamenat snahy o algoritmizaci tyroidálních laboratorních vyšetření s úmyslem vhodně vybrat z jejich široké palety. Vznikaly i stručné přehledy a jednoduché tabelární pomůcky, jejichž zjevným nedostatkem bývá skutečnost, že s ohledem na rozdílnou prevalenci postihují vesměs jen nejčastější tyreopatie a dále to, že se zabývají převážně jen stanovením hormonů.
Starší návrhy i z tohoto pohledu už překonal současný prudký rozvoj neizotopových imunochemických metod. Tato kapitola respektuje dnešní vyšší úroveň poznání a spolu s ní rozšiřující se nabídku dostupných laboratorních vyšetření.
1. Biochemie tyreoidálních hormonů a dalších látek
V buňkách folikulů štítné žlázy se tvoří tyroxin (3,3',5,5'-tetrajódtyronin, T4) a trijódtyronin (3,3',5-trijódtyronin, T3). Strukturálně jde o jódované deriváty aromatické aminokyseliny tyroninu, složené ze dvou zbytků tyrosinu. Mnohostranné biochemické účinky těchto hormonů lze charakterizovat jako zvýšení metabolické aktivity spojené s vyšší spotřebou kyslíku a s produkcí tepelné energie. Jejich základní význam pro růst a vývoj organizmu souvisí patrně s všeobecnou stimulací syntézy RNA a proteosyntézy. Parafolikulární neboli C-buňky štítné žlázy kromě toho syntézují hormon kalcitonin (tyreokalcitonin, TC), zapojený do soustavy hospodaření organizmu s vápníkem.
Výchozím bodem tvorby hormonů štítné žlázy je proteosyntéza tyreoglobulinu (TG), glykoproteinu, jehož tyrosylové skupiny se za katalýzy jódtransferázou jódují molekulárním jódem J2 v poloze 3 resp. 3 a 5. Monojódfenylová nebo dijódfenylová část (donor) se váže éterovou vazbou na další jódovanou tyrosylovou skupinu (akceptor) za vzniku příslušné jódtyroninové struktury stále ještě vázané jako součást peptidového řetězce tyreoglobulinu. Ten přestupuje v této podobě z buňky do lumina folikulu, do tzv. koloidu, kde se skladuje. Jodidové anionty jsou buňkami štítné žlázy z cirkulace aktivně vychytávány, patrně kotransportem s Na+, a koncentrovány v cytoplazmě asi 25násobně. Klíčovým enzymem katalyzujícím oxidaci jodidových aniontů přinášených cirkulací na molekulární jód, je peroxidáza (jodidperoxidáza, tyreoperoxidáza, TPO). Působením hypofyzárního hormonu tyreotropinu (TSH) se zvyšuje akumulace jódu v buňce štítné žlázy a na podnět TSH se také tyreoglobulin vrací z lumina folikulu zpět do tyreocytu, kde se štěpí lysosomálními proteázami a uvolněný jódovaný tyronin přestupuje do cirkulace. Tyreoidální hormony se tedy tvoří kontinuálně, skladují se ve formě prohormonu, tj. jódovaného tyreoglobulinu, a na podnět centrálních regulačních mechanismů se pouze rychleji nebo pomaleji uvolňují. Za fyziologických okolností štítná žláza produkuje převážně T4 (až 100x více než T3). T3 je však podstatně účinnější než T4, takže tyroxin se někdy také označuje za prohormon. V periferních tkáních se T4 přibližně z jedné třetiny dejóduje 5'-dejodázou na směs neaktivního 3,3',5'-T3 (tzv. reverzní T3, rT3) a aktivního 3,3',5-T3.
V krevním oběhu se T3 i T4 transportují ve vazbě na transportní bílkoviny: na tyroxin vázající globulin (thyroxin binding globulin, TBG, ze 60 až 70 %), na prealbumin (transthyretin, thyroxin binding prealbumin, ze 30 %) a na albumin (nepatrný zbytek). Číselné údaje o relativních podílech vazby T3 a T4 na jednotlivé transportní bílkoviny se v literatuře velmi liší. Vazba T3 na transportní bílkoviny je o něco slabší než T4. Proto kromě vázané formy T3 cirkulují ještě asi 0,3 % volného T3 (free T3, FT3) a kromě vázané formy T4 cirkulují jen asi 0,03 % volného T4 (free T4, FT4). Pouze volné formy mohou vstupovat do cílových buněk a být hormonálně aktivní. Mezi vázanými a volnými formami obou hormonů však existuje dynamická rovnováha. Rozdílnost biologických poločasů obou hormonů v plazmě se vysvětluje také existencí jejich volných forem, protože jen ty mohou být odbourávány v játrech, ledvinách a svalech: pro T4 je to 7 dní, zatímco pro T3 zhruba jeden den. Pod názvem celkový T3 (total T3, TT3) a celkový T4 (total T4, TT4) se rozumí součet koncentrací vázané a volné formy příslušného hormonu.
2. Regulace sekrece hormonů štítné žlázy
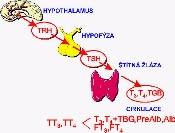 Centrální řízení sekreční aktivity štítné žlázy začíná u hypotalamu
(obr. 9.1.).
Zde se uvolňuje spouštěcí faktor ze skupiny neurosekrečních hormonů, tyreoliberin (thyreotropin releasing hormon, TRH). Ten podněcuje sekreci tyreotropního hormonu (thyroid stimulating hormon, TSH) v adenohypofýze. Somatostatin naopak sekreci TSH inhibuje. TSH dopravený krevní cestou ke štítné žláze urychluje po vazbě na své specifické receptory na membráně tyreocytu vstup jódovaného tyreoglobulinu z koloidu folikulu do buňky, jeho proteolytické štěpení, a tím i uvolnění tyroidálních hormonů do cirkulace. Mezi koncentrací tyroidálních hormonů v krvi a sekrecí TSH existuje negativní zpětná vazba. T3 a T4 pronikají do cílové buňky bez specifického receptoru (podobně jako steroidní hormony) a mechanismus jejich účinku je zprostředkován cyklickým AMP.
Centrální řízení sekreční aktivity štítné žlázy začíná u hypotalamu
(obr. 9.1.).
Zde se uvolňuje spouštěcí faktor ze skupiny neurosekrečních hormonů, tyreoliberin (thyreotropin releasing hormon, TRH). Ten podněcuje sekreci tyreotropního hormonu (thyroid stimulating hormon, TSH) v adenohypofýze. Somatostatin naopak sekreci TSH inhibuje. TSH dopravený krevní cestou ke štítné žláze urychluje po vazbě na své specifické receptory na membráně tyreocytu vstup jódovaného tyreoglobulinu z koloidu folikulu do buňky, jeho proteolytické štěpení, a tím i uvolnění tyroidálních hormonů do cirkulace. Mezi koncentrací tyroidálních hormonů v krvi a sekrecí TSH existuje negativní zpětná vazba. T3 a T4 pronikají do cílové buňky bez specifického receptoru (podobně jako steroidní hormony) a mechanismus jejich účinku je zprostředkován cyklickým AMP.
Nabídka hormonů štítné žlázy cílovým tkáním je tedy závislá na stavech a regulačních mechanismech několika úrovní:
- nitrobuněčná proteosyntéza tyreoglobulinu + nabídka jódu a jódace,
- centrální hypotalamo-hypofyzární řízení sekreční aktivity (uvolňování hormonů z depo v koloidu),
- koncentrace a funkční stav transportních bílkovin pro transport krví a pro rovnováhu volné a vázané formy,
- a konečně degradace hormonů v játrech, ledvinách a ve svalech.
Vliv všech těchto faktorů je třeba brát v úvahu zejména při etiopatogenetických rozvahách u chorob štítné žlázy.
3. Patobiochemie některých poruch
Syndrom vyvolaný nízkými hladinami volných hormonů štítné žlázy se nazývá hypotyreóza. Primární hypotyreózy lze rozdělit podle etiologie na kongenitální, endemické (z nedostatku jódu), autoimunní, z fyzikálních a chemických vlivů (chirurgický zásah, ionizující záření, strumigeny, tj. zčásti i iatrogenní) a jako součást nebo následek jiných zánětlivých nebo infiltračních onemocnění. Sekundární hypotyreózy (někdy též "centrální") vznikají při postižení hypotalamu nebo adenohypofýzy, a to vrozenou poruchou tvorby nebo sekrece příslušných hormonů, nebo v důsledku úrazu, chirurgického zásahu, ozáření, nádoru nebo poruchy krevního zásobení.
Kongenitální hypotyreóza patří mezi vývojové poruchy s relativně vysokou incidencí. U novorozence se neprojevuje žádnými výraznými symptomy a přitom její včasná diagnostika a léčba je životně důležitá. Pro detekci poruchy byly proto vyvinuty screeningové programy zahrnující stanovení TSH a někdy též T4 v krvi odebrané z patičky pátého až sedmého dne po narození. Novorozenecký screening kongenitální hypotyreózy využívá tzv. supersenzitívní stanovení TSH (viz dále) v eluátu z vysušené kapky krve na filtračním papíře.
Zvýšená sekreční aktivita štítné žlázy a/nebo nadměrná nabídka volných forem tyreoidálních hormonů vede k hypertyreóze. Nejčastěji se jedná o primární postižení štítné žlázy, které může mít celou řadu forem, jako je např. Gravesova-Basedowova nemoc (difúzní, toxická struma), toxický adenom, T3 tyreotoxikóza. Sekundární hypertyreózy mohou vznikat např. při Hashimotově autoimunní tyreoiditidě, při subakutní tyreoiditidě, u folikulárních karcinomů štítné žlázy nebo i ektopických karcinomů, u adenomů hypofýzy, apod.
Zánětlivá onemocnění štítné žlázy se dělí na autoimunní Hashimotovu (chronickou lymfocytární) tyreoiditidu a na neautoimunní, virovou (subakutní) thyreoiditidu.
Podrobnosti o etiopatogenezi, klinickém obrazu a léčbě dysfunkcí, nádorů a zánětů štítné žlázy je možno najít téměř v každé učebnici vnitřního lékařství nebo endokrinologie (viz též seznam doporučené literatury v závěru této kapitoly). Poměrně velký počet těchto patologických stavů lze dnes s vysokou spolehlivostí diagnostikovat. Je také možné identifikovat, charakterizovat a průběžně sledovat změny, k nimž dochází při konzervativní nebo po radikální léčbě. Slouží k tomu, mimo jiné, funkční vyšetření a laboratorní stanovení jednotlivých analytů v krevním séru, nejlépe opakovaná v časové ose. K jejich racionálnímu výběru může přispět i následující přehled.
4. Laboratorní diagnostické metody
4.1. Ukazatelé tyreoidální dysfunkce
4.1.1. TYREOTROPIN, TSH v séru
Jeho koncentrace v séru je nepřímo úměrná koncentraci T4. Klinický význam vyšetření spočívá v tom, že za předpokladu normální funkce hypotalamo-hypofyzární osy odráží hladina TSH dostupnost T4 pro tkáně. Výrazně zvýšené hodnoty TSH jsou signifikantní pro primární hypotyreózu. U hypotalamických příčin hypotyreózy mohou být koncentrace TSH nízké, normální i mírně zvýšené. Hypotalamicky podmíněná hypotyreóza s nedostatkem tyreoliberinu může být spjata se sekrecí imunochemicky aktivního, ale biologicky neúčinného TSH. Běžnými imunochemickými metodami tedy stanovíme dokonce vysoké koncentrace tohoto modifikovaného TSH, protože se v cirkulaci pomaleji odbourává, výsledek však neodpovídá stimulaci sekrece tyroidálních hormonů.
V indikaci vyšetření platí, že jde o metodu první volby při podezření na primární hypotyreózu nebo na hypertyreózu. Tímto vyšetřením lze sledovat substituční terapii pomocí T4 nebo supresivní terapii. Je doplňkovým vyšetřením ke stanovení TT4 nebo FT4 u sekundární hypotyreózy a ke stanovení FT4 (TT4) a FT3 (TT3) při podezření na rezistenci na tyreoidální hormony. Vyšetřuje se také u hypercholesterolémie a u hyperprolaktinémie. Vysoce citlivé metody stanovení TSH ( tzv. metody "třetí generace", tj. s mezí detekce pod 0,01 mU/L) se používají pro screening kongenitální hypotyreózy ze suché kapky krve novorozence.
4.1.2. FUNKČNÍ TEST S TRH
Jde o tzv. TRH loading test, jehož klinický význam spočívá v tom, že odráží sekreci TSH z hypofýzy po p.o., i.v. nebo intranasální stimulaci hormonem tyreoliberinem (TRH). Vyšetření se indikuje u "centrální" hypotyreózy, dále při podezření na sekundární hypertyreózu při selektivní hypofyzární rezistenci na tyreoidální hormony, u nádorů produkujících TSH, nebo u generalizované rezistence na tyreoidální hormony. Tímto testem lze též vyjasnit podezření na interference při samotném stanovení TSH, které vzniká např. při nálezu normálních hodnot TSH u hypertyreózy.
4.1.3. TYROXIN celkový (TT4) a volný (FT4) v séru
Jeho koncentrace jsou ukazatelem aktuální sekrece hormonu štítnou žlázou. Vysoké koncentrace T4 u Gravesovy-Basedowovy choroby naznačují nebezpečí re-lapsu po ukončení konzervativní léčby. Hladiny FT4 (TT4) slouží k monitorování léčby tyroxinem, protože vypovídají o dostupnosti hormonu tkáním. Je třeba mít na paměti, že koncentrace tyroidálních hormonů může být ovlivněna řadou faktorů (viz výše v odstavci Biochemie), především rovnováhou mezi jejich sekrecí a odbouráváním a rovnováhou mezi volnými a vázanými formami v cirkulaci, resp. stavem příslušných transportních proteinů. Výhodou FT4 je z tohoto hlediska menší zá-vislost na patologicky a farmakologicky indukovaných změnách TBG. Někdy se do-poručuje z hodnoty T4 a z T3-Uptake (v procentech, viz dále) kalkulovat index volného tyroxinu, free thyroxin index, FTI, a to podle vzorce:
| FTI = | koncentrace T4 x % T3 Uptake |
| --------------------------------------------- |
| 100 |
Indikací je opět několik. Při podezření na primární hypotyreózu nebo na hypertyreózu jde o doplňující vyšetření vedle TSH. Jde o prioritní vyšetření při léčbě hypertyreózy, neboť sekrece TSH může být ještě dlouhodobě potlačena. Je to také výhodný nástroj k monitorování léčby tyroxinem, k její jemné modifikaci a ke sledování compliance. Volný T4 lze použít i pro screening kongenitální hypotyreózy.
4.1.4. 3,3',5-TRIJÓDTYRONIN celkový (TT3) a volný (FT3) v séru
Při hypertyreóze odráží hladina TT3 nebo FT3 v séru sekreční aktivitu štítné žlázy. Podle některých autorů je informační hodnota stanovení TT3 a FT3 totožná. Také zde vysoká koncentrace hormonu u Gravesovy-Basedowovy choroby naznačuje možnost relapsu po ukončení léčby. Vysoké hladiny T3 při léčbě tyroxinem poukazují na autonomní hyperaktivitu štítné žlázy. Koncentrace T3 v cirkulaci odpovídá dejódaci T4 zejména v periferních tkáních.
Indikační oblastí jsou vyšetření hypertyreózy, vyšetření závažnosti primární hypotyreózy, diferenciální diagnostika nízkých koncentrací TSH a podezření na autonomní sekreci během léčby tyroxinem.
4.1.5. REVERZNÍ T3 (3,3',5'-T3, rT3) v séru
Klinický význam spočívá v tom, že jde o nepřímý ukazatel přeměny T4 na T3 a o ukazatel další dejódace, tj. vzniku dijódtyroninu. Z toho vyplývá i indikace, tj. vyšetření neznámých příčin nízké koncentrace TT3 a/nebo TT4 (FT4).
4.1.6. TYREOGLOBULIN, TG v séru
Stanovení tyreoglobulinu v séru je ukazatelem uvolňování TG z aktivní, zánětlivé, nebo nádorově pozměněné tkáně štítné žlázy. U nádorů produkujících TG hraje patrně rozhodující roli poškozená mezibuněčná integrita. Hlavními indikacemi jsou tedy monitorování pacientů po totální tyreoidektomii pro diferencovaný karcinom, detekce adenokarcinomů neznámého původu, diagnostika hypertyreózy neznámé etiologie.
4.1.7. ALFA PODJEDNOTKA HCG (alfa-HCG) v séru
Vyšetření ilustruje obecně sekreci alfa podjednotek hypofyzárních glykoproteinových hormonů, tedy i TSH. Indikováno je k ověření jakosti sekrece TSH při diferenciální diagnostice rezistence na tyreoidální hormony a při podezření na nádor produkující TSH.
4.1.8. KALCITONIN, tyreokalcitonin v séru
Kalcitonin v séru je ukazatelem sekreční aktivity parafolikulárních C-buněk štítné žlázy. Vyšetření je indikováno při diagnostice a sledování medulárních nádorů štítné žlázy, mnohočetné endokrinní neoplasie a neuroendokrinních nádorů. Vyšetřuje se bazální koncentrace a koncentrace po podání pentagastrinu nebo vápenatých solí.
4.2 Poruchy transportu tyreoidálních hormonů
4.2.1. TYROXIN VÁZAJÍCÍ GLOBULIN, TBG v séru
Klinický význam vychází ze skutečnosti, že se jedná o kvantitativně nejvýznamnější přenašeč tyreoidálních hormonů v krvi. Vysoké koncentrace TBG v séru mohou být podmíněny geneticky, ale nalézají se i u žen v průběhu těhotenství a při hormonální antikoncepci s použitím estrogenových kontraceptiv, a dále jsou běžné u novorozenců. Nízká koncentrace TBG může být také vrozeným jevem, existuje však celá řada dalších příčin jeho nedostatku: malnutrice, malabsorpce, stavy se ztrátami nebo vysokým katabolismem bílkovin, poruchy jaterní syntézy, působení androgenů a vysokých dávek kortikoidů. Malá přenosová funkce TBG pro tyreoidální hormony se může projevit nejen při jeho nízké koncentraci, ale (snad i častěji) při obsazení jeho transportní kapacity léčivy.
Koncentrace TBG v séru se vyšetřuje při nálezu neočekávaných hodnot T3 a T4 ve srovnání s klinickým stavem a s koncentrací TSH, nebo při diskrepancích mezi koncentrací volného a vázaného T4. Podobně i při podezření na nízkou afinitu TBG (geneticky podmíněné varianty, vazba léčiv a pod.).
4.2.2. PREALBUMIN, transthyretin v séru
Jedná se o druhý nejvýznamnější přenašeč tyreoidálních hormonů v krvi. Klinický význam vyšetření je analogický významu vyšetření TBG.
Koncentrace prealbuminu se stanovuje při zkoumání příčin nevysvětlitelně vysoké hladiny T4 a odhalování původu rozporu mezi koncentracemi volného a vázaného podílu T4. Mimo oblast tyreoidální diagnostiky je třeba připomenout, že se jedná o citlivý ukazatel jaterní proteosyntézy
(viz kapitola 5, část 5.2).
4.2.3. VAZEBNÁ KAPACITA TRANSPORTNÍCH BÍLKOVIN, T-UPTAKE
Klinický význam a indikace tohoto vyšetření jsou stejné jako u TBG a TBPA, informace se však týká sumy všech vazebných bílkovin. V současnosti se provádí nejčastěji tak, že vzorek séra se nasytí známým množství T3 a v dalším kroku se stanoví nenavázaný podíl T3 (heterogenní kompetitivní imunoanalýza s dvojí protilátkou, např. systém TU ACS:180 Ciba-Corning Diagnostics, využívající chemiluminiscenční imunoanalýzy). Výsledek se vyjadřuje obvykle zlomkem nebo v %.
4.3 Ukazatelé autoimunních chorob štítné žlázy
4.3.1. PROTILÁTKY PROTI PEROXIDÁZE, TPOAb v séru
Tyto protilátky byly dříve označovány jako antimikrosomální protilátky, TMAb. Odhalují přítomnost autoimunního onemocnění a tím i možné riziko pro vznik dysfunkce štítné žlázy. Pro tento účel mají TPOAb vyšší informační hodnotu, než TGAb (viz dále).
Vyšetření je indikováno u strumy neznámé etiologie, k diferenciální diagnostice hypertyreózy neznámé etiologie, dále při vzestupu TSH bez zjevných příčin, u polyglandulárních autoimunních chorob a jiných nemocí často spojených s tyreoidální dysfunkcí a preventívně u příslušníků rodin s prokázaným výskytem autoimunních zánětů štítné žlázy. Vyšetření je vhodné také pro screening rizika zánětů štítné žlázy u těhotných a matek po porodu a doporučuje se i po terapii léky, které mohou nepříznivě ovlivnit štítnou žlázu nebo celý imunitní systém. Naše vlastní dlouholeté zkušenosti s vyšetřováním TPOAb (TMAb) a TGAb tyto indikace potvrzují zvláště u mladistvých s chronickou lymfocytární tyreoiditidou.
4.3.2. PROTILÁTKY PROTI TYREOGLOBULINU, TGAb v séru
Také tyto protilátky odhalují přítomnost autoimunního onemocnění. Současně mohou vysvětlit nesprávné výsledky (interference) při stanovení samotného TG. Rostoucí hodnoty TGAb po totální tyreoidektomii pro diferencovaný karcinom ukazují na možné metastázy.
Indikuje se jako doplňkové vyšetření ke stanovení tyreoglobulinu, ke sledování diferencovaných karcinomů štítné žlázy a stavu po totální tyreoidektomii.
4.3.3. PROTILÁTKY PROTI TSH-RECEPTORŮM, TRAb v séru
Cirkulující TRAb jsou známkou přítomnosti imunoglobulinů, které se váží na TSH receptory tyreocytů, a které mohou jak stimulovat, tak inhibovat (blokovat) aktivitu štítné žlázy. Poukazují na riziko vzniku tyreoidální dysfunkce, riziko opakovaného rozvoje Gravesovy-Basedowovy choroby a na vysoké riziko endokrinní oftalmopatie.
Jejich stanovení se indikuje při diferenciální diagnostice hypertyreózy (autoimunního a neautoimunního původu a vzniklé na podkladě rezistence vůči tyreoidálním hormonům) a sledování jejich léčby. Je to také vhodné vyšetření při podezření na endokrinní oftalmopatii, při diferenciální diagnostice hypotyreózy a při všech abnormálních klinických nálezech s podezřením na přítomnost blokujících nebo stimulujících protilátek.
4.4 Metodické poznámky
Převážná většina popsaných stanovení patří do široké skupiny imunochemických kvantitativních metod (viz též kapitola 11, části
1.7, 1.8 a 7.2). Stanovení celkových koncentrací T3 a T4 předpokládá uvolnění jejich vázaných, kvantitativně významnějších forem z vazby na bílkoviny (např. roztokem NaOH). Výsledek tedy ovlivňují m.j. i koncentrace vazebných bílkovin a účinnost uvolňovacího kroku.
Stanovení volných forem, tedy FT3 a FT4, je komplikováno tím, že se měří koncentrace přibližně o tři řády nižší, než u celkových. To vše v biologickém materiálu, kde, jak bylo výše uvedeno, existuje dynamická rovnováha mezi volnou a vázanou formou hormonů. Existují metody oddělující volnou frakci a metody pracující s plným sérem. Převažují ty druhé, protože způsoby separace (dialýza, ultrafiltrace, gelová chromatografie) jsou technicky, materiálově i časově náročné.
Spolu s interindividuální variabilitou to má za následek relativně široké rozmezí fyziologických hodnot (referenčních intervalů) tyreoidálních hormonů. Přesto, že pro stanovení těchto hormonů existují referenční metody (plynová chromatografie s hmotností spektrometrií), jimiž jsou testována kontrolní séra, různé imunochemické reakční systémy mohou poskytovat poněkud odlišné výsledky.
5. Závěr
Tento přehled naznačuje dosti širokou paletu laboratorních vyšetřovacích metod a ve srovnání s nedávnou minulostí současně svědčí o dynamickém vývoji na tomto poli a v endokrinologii vůbec. Jejich aktuální nabídka a dostupnost bude jistě regionálně různá v závislosti na materiálním, technickém a personálním vybavení laboratoří. Za mnohem důležitější však považujeme zajištění jejich jakosti a mezilaboratorní srovnatelnosti, stanovení referenčních (a dále i rozhodovacích) mezí a z interpretačního hlediska potom znalost analytických a biologických interferencí
(kapitola 1). Jsme přesvědčeni o tom, že ke splnění zvláště posledně jmenovaných požadavků lze dospět jedině průběžným a intenzívním dialogem mezi lékařem v laboratoři a ošetřujícím lékařem.
6. Doporučená literatura:
Límanová Z., Němec J., Zamrazil V.: Nemoci štítné žlázy. Galén Praha, 1995
Butler J., Pope R.: Thyroid dysfunction. V knize: Clinical Biochemistry. W.J.Marshall, S.K.Bangert (editoři), Churchill Livingstone Ltd. New York, Edinburgh, London 1995, str.331 - 354
Surks M.I., Chopra I.J., Mariash C.N. et al.: American Thyroid Association guidelines for use of laboratory tests in thyroid disorders. JAMA, 263, 1990, 1529 - 1532
Rational in vitro thyroid diagnosis. A publication of the Diagnostics Division, Scientific Department, Boehringer Mannheim GmbH, BRD 1989
Weetman A.P.: The laboratory diagnosis of thyroid disease. Thyroid Information Service, Amerlite Diagnostics Ltd. 1991
Thyroid quick reference guide. Abbott Diagnostics Educational Services. Abbott Laboratories 1993
Lindstedt G., Berg G., Jansson S. et al.: Clinical use of laboratory thyroid tests and investigations. Journal IFCC Vol.6 (4), 1994, 136 - 141
Beckett G.J.: The investigation of thyroid function. Journal IFCC, Vol.6 (5), 1994, 186 - 190
 Centrální řízení sekreční aktivity štítné žlázy začíná u hypotalamu
(obr. 9.1.).
Zde se uvolňuje spouštěcí faktor ze skupiny neurosekrečních hormonů, tyreoliberin (thyreotropin releasing hormon, TRH). Ten podněcuje sekreci tyreotropního hormonu (thyroid stimulating hormon, TSH) v adenohypofýze. Somatostatin naopak sekreci TSH inhibuje. TSH dopravený krevní cestou ke štítné žláze urychluje po vazbě na své specifické receptory na membráně tyreocytu vstup jódovaného tyreoglobulinu z koloidu folikulu do buňky, jeho proteolytické štěpení, a tím i uvolnění tyroidálních hormonů do cirkulace. Mezi koncentrací tyroidálních hormonů v krvi a sekrecí TSH existuje negativní zpětná vazba. T3 a T4 pronikají do cílové buňky bez specifického receptoru (podobně jako steroidní hormony) a mechanismus jejich účinku je zprostředkován cyklickým AMP.
Centrální řízení sekreční aktivity štítné žlázy začíná u hypotalamu
(obr. 9.1.).
Zde se uvolňuje spouštěcí faktor ze skupiny neurosekrečních hormonů, tyreoliberin (thyreotropin releasing hormon, TRH). Ten podněcuje sekreci tyreotropního hormonu (thyroid stimulating hormon, TSH) v adenohypofýze. Somatostatin naopak sekreci TSH inhibuje. TSH dopravený krevní cestou ke štítné žláze urychluje po vazbě na své specifické receptory na membráně tyreocytu vstup jódovaného tyreoglobulinu z koloidu folikulu do buňky, jeho proteolytické štěpení, a tím i uvolnění tyroidálních hormonů do cirkulace. Mezi koncentrací tyroidálních hormonů v krvi a sekrecí TSH existuje negativní zpětná vazba. T3 a T4 pronikají do cílové buňky bez specifického receptoru (podobně jako steroidní hormony) a mechanismus jejich účinku je zprostředkován cyklickým AMP.