PDF verze textu
PDF verze obrázků
Za cenné poznámky a připomínky děkuji prof. MUDr. Jindřichu Martínkovi, DrSc (Ústav pro histologii a embryologii 1LF UK), MUDr. Zorce Mělkové, PhD (Ústav imunologie a mikrobiologie 1 LF UK) a kolegům v pracoviště (RNDr. Marii Kalbáčové, PhD, MUDr. Zdeňkovi Kostrouchovi, CSc a MUDr. Martě Kostrouchové, CSc )
V dnešním pohledu jsou dva základní typy mechanismů buněčné smrti. Jedním z nich je tzv. nekrosa, realisovaná zásahy, které vedou k buněčné smrti neprogramovaně a ve kterých hraje buňka sama pasivní roli. Druhým je buněčná smrt programovaná, uskutečněná kaskádou vývojově konservovaných procesů, které cíleně vedou k zničení vitálních struktur buňky.
Usmrcená buňka je afunkční z hlediska patofysiologie, stává se uzavřeným systémem se ztrátou kompartmentalisace, se zaniklým paměťovým, membránovým a cytoskeletálním principem, je charakterisována vysokým stupněm entropie a podléhá degradaci autolytickými a heterolytickými procesy. Reakce organismu se liší podle mechanismu jejího zániku.
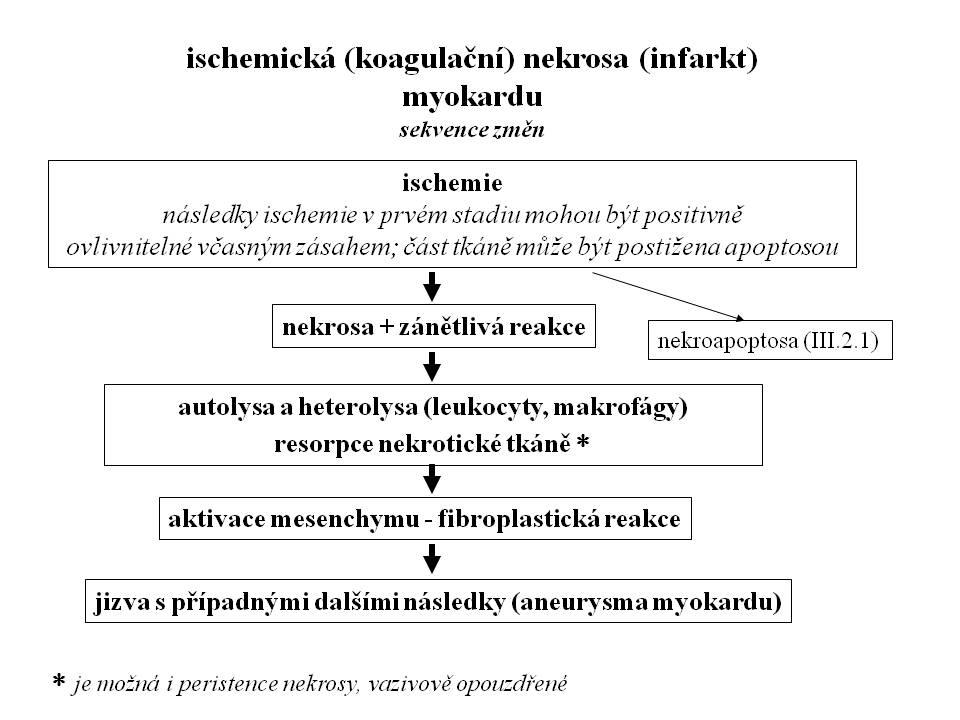
Jde o zánik živé buňky daný působením nekrogenního faktoru, který naruší vitální cytoplasmatické struktury buňky, což vede ke komplexnímu rozvratu její biologické integrity. Buňku lze při nekrose pokládat za pasivní objekt.Vzhledem k významnému intracelulárnímu edému, přítomnému od počátku ireversibilního stadia, kontrastuje s kondensací cytoplasmy a celé buňky u apoptosy (viz níže). Termín nekrosa je vymezen pouze pro buňky. Extracelulární buněčné produkty podléhají rozpadu. Ve vývoji nekrosy je možné rozlišovat několik stádií, jejichž délka bude silně odvislá od charakteru nekrogenního podnětu a situace, z které došlo k působení nekrogenního podnětu. Následně uváděný scénář představuje situaci u ischemické nekrosy, kde mohl být nejlépe studován, zejména v myokardu (II.6 a III.2.1), ale víceméně platí pro všechny situace.

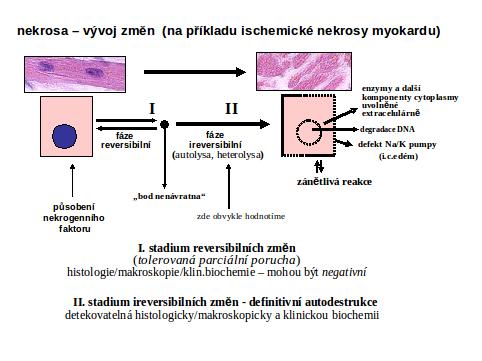
II.1.Stadium reversibilních změn je identická s akutním poškozením buňky. Již v této etapě může nastat těžká porucha funkce buňky. Je-li okrsek postižené tkáně rozsáhlý a jde-li o vitálně orgán důležitý (mozek, srdce), může nastat smrt tak rychle, že nedojde k vývinu dalších změn intra vitam, ale až post mortem. V tomto případě jde o „funkční selhání“ na molekulární úrovni bez rozvoje „organických“, t.j. mikroskopicky patrných změn. Podle situace a charakteru nekrogenního podnětu může být tato fáze reversibilní nebo může dojít k rozvoji subletálních změn postižených buněk, persistujících po dobu trvání příčiny.
Pokud jde o silný nekrogenní podnět, postihující pouze část orgánu, jehož celková funkce nevede k selhání vitální funkce orgánu, rozvíjí se v postiženém okrsku tkáně od určitého okamžiku ("bod nenávratna") proces následných, tzv. „organických změn“, postřehnutelných již mikroskopicky případně až makroskopicky. Nastává etapa ireversibilní neregulované destrukce buňky a tkáně.
Praktický význam má znalost této fáze zejména, ne-li výlučně, u ischemické nekrosy, během které je možný v některých případech účinný terapeutický zásah, nebo alespoň možnost časově posunout tento bod úpravou zevních podmínek, např. ochlazení akutně ischemisované končetiny (viz níže ischemická nekrosa).
Jde o totální rozvrat vnitřního prostředí buňky zahrnující pokles pH, inaktivaci řady vitálně důležitých enzymů, destrukce buněčných kompartmentů, vedoucí k všeobecné autodestrukci cytoplasmatických a jaderných struktur. Za důležitý mechanismus ireversibilního poškození se pokládá zvýšení koncentrace Ca++ v cytosolu postižené buňky (influx z extracelulární tekutiny poškozenou buněčnou membránou a uvolnění z intracelulárních depo). To vede k celé řadě negativních jevů, především k nekontrolované aktivaci neutrálních proteas (kalpainy - kalciem aktivované neutrální proteasy), fosfolipas (atakujících membrány), endonukleas, ke konversi xanthin dehydrogenasy (NAD dependentní) na xanthin oxidasu (vedoucí ke vzniku volných radikálů) a k aktivaci NO syntasy. Zvýšeně produkovaný NO reaguje se superoxidem za vzniku peroxynitritu, který se rozkládá na nejreaktivnější hydroxylový radikál. Konečným stadiem je rozpad podstatné části biologicky důležitých komponent buňky, Fáze akutních ireversibilních změn přechází plynule do fáze změn, které se označují jako autolysa (autodegradace) a heterolysa Další osud je pak určen efektivitou autolytických a heterolytických procesů, které jsou ovlivněny řadou faktorů.
Rychle progredující destrukce zabraňuje aktivaci apoptotické kaskády (viz apoptosa III.2.1). Vzhledem k významnému fenoménu intracelulárního edému, přítomnému od počátku ireversibilního stadia a kontrastujícího s kondensací cytoplasmy od apoptosy, je často používán náhradní termín "onkosa".
Autolysou (autodegradací, samonatrávením) se rozumí rozklad nekrotické tkáně enzymovým hydrolytickým potenciálem tkáně podléhající nekrose (komplex lysosomálních a mimolysosomálních hydrolas), probíhající v tkáni zbavené kompartmentů. Existuje řada faktorů ovlivňující efektivitu autolysy nekrotické tkáně*.
Heterolysou (natrávení enzymy pocházejícími z okolní tkáně) se rozumí působení reaktivních zánětlivých elementů atrahovaných k nekrotickému ložisku rámci indukované zánětlivé reakce. Jde hlavně o granulocyty a histiocyty. Jde o kombinaci fagocytosy a tedy intracelulární digesce s extracelulární digescí, podmíněnou sekrecí hydrolytických enzymů nebo jejich uvolněním z granul rozpadlých granulocytů. V řadě případů je významným faktorem právě fagocytární a degradační potenciál makrofágů. Podle současných znalostí jsou to makrofágy (profesionální fagocyty), které odstraňují nekrotické buňky, což by mělo odlišovat nekrosu od apoptosy, kde se na odstranění apoptotické buňky mohou podílet i buňky okolní nezávisle na buněčném typu (viz apoptosa). Pokud jde o mikroskopické nekrosy, existují rutinně zavedené termíny jako neuronofagie (fagocytosa nekrotických neuronů) nebo resorpční uzlíky v játrech (fagocytosa nekrotických hepatocytů). Efektivní resorpce nekrosy fagocyty je zárukou rychlého hojení.
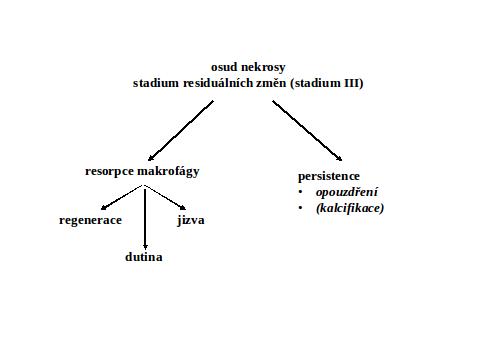
II.3 Stadium hojení a residuálních změn. Další osud nekrotické tkáně je různý (viz schéma). Nejsou vzácné stavy, kdy nekrotická tkáň persistuje, klasicky u kaseosní nekrosy (inhibice makrofágů) nebo pouhou kvantitou nekrosy.
Existují stavy, za kterých představuje nekrotisující tkáň zátěž pro lysosomální systém*
Celý proces ireversibilních změn od „bodu nenávratna“ může být blokován fixačním procesem. Jde o situace, kdy je po odběru živá tkáň (biopsie) usmrcena fixativem (např. form- nebo glutaraldehydem), čímž jsou zároveň totálně inaktivovány veškeré degradační procesy (Obr. 1.)
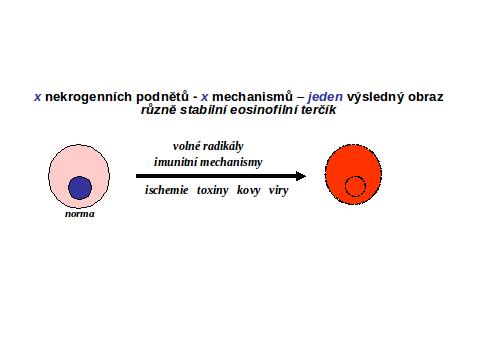
II.4 Jak pozná nekrosu patolog. Okamžik buněčné smrti (analogický biologické smrti organismu) nelze doposud spolehlivě definovat a identifikovat. Podle obecné definice jde o "bod nenávratna," po kterém následuje ireversibilní desintegrace buňky. Ireversibilně postižená buňka není na počátku definovatelná morfologicky (stadium II, viz výše). V případě nekros svalové tkáně, zejména chemického myokardu, lze prokázat lokální aktivaci komplementu (viz ischemickou nekrosu). V následném rozvoji je společným jmenovatelem u všech typů nekros ztráta barvitelnosti buněk basickými barvivy a hematoxylinem, způsobená rozpadem nukleoproteinů jako výraz totální degradace buňky, zejména nukleoproteinů. Rozpad jaderné hmoty lze sledovat v následujícím ideálním sledu: pyknosa (masivní densifikace veškerého chromatinu za zmenšení jádra), karyorhexe a karyolysa (rozpad chromatinu na malé fragmenty účinkem exo- a endonukleas). Buňky nebo jejich zbytky se tak stávají pouhými eosinofilními strukturami, (viz schéma a obr 2; obr. 3; obr.4), v nichž probíhají destruktivní změny v závislosti na intensitě autolytických a heterolytických procesů (viz výše). Tato všeobecná destrukce je nejlépe pozorovatelná v elektronovém mikroskopu, kde je mimo jiné patrno významné zduření mitochondrií s tvorbou densních intramitochondriálních granul a distense endoplasmatického retikula (obr.4).
Mitochondriální granula lze vzhledem k citlivosti na proteolytické enzymy pokládat za protein.
Makroskopicky mají nekrosy známý vzhled, daný typem postižené tkáně, situací, které k nekrose vedla a některými dalšími faktory (viz dále).
Nekrotická tkáň je zdrojem biologicky aktivních látek (viz schéma)
Jde o heat shock proteiny (HSP) působící jako chaperony pro uvolňované antigenní peptidy. HSP jsou vychytáváni antigen presentujícími buňkami a urychlují zpracování antigenních peptidů. Jsou prozánětlivé (indukují sekreci TNF a IL-1β).
Tzv. sérové markery nekrosy. Z desintegrující se buňky se uvolňují solubilní komponenty z buněčných organel nebo z cytosolu, které lze prokázat biochemicky v séru. Klasickým příkladem jsou uvolněné z hepatocytů (transaminasy), ze svalové tkáně (isoenzym kreatinfosfokinasy, myoglobin), z kardiomyocytů (kardiální isoenzymy laktát dehydrogenasy, kreatin fosfokinasy, myoglobinu, zejména však kardiální varianty troponinu, prokazatelné v séru. K jejich uvolňování je nutná ztráta barierové funkce buněčné membrány. Pro monitorování traumatu mozkové tkáně bylo zavedeno sledování sérové hladiny GFAP (intermediárního filamenta astrocytů) a S100 proteinu, též exprimovaného masivně v astrocytech. Jejich zvýšené sérové hladiny jsou výrazem poškození mozkové tkáně (ischemického, ale i jiného původu, např. traumatického) a zároveň výrazem poškození hematoencefalické bariery. V případě hemorhagických infarktů jsou prokazatelné známky hemolysy.
Makroskopicky je často používána k detekci nekrotických úseků tkáně (typicky, ne-li výlučně v myokardu) tzv. tetrazoliová reakce, jejíž positivita je dána uvolněnými dehydrogenasami a jejich substráty z nekrotické tkáně. Ty pak zcela standardně startují reakci, která je omezena na nekrotický fokus.
Nekrotická tkáň/buňka jako bezbariérový akceptor látek
Na ztrátě této bariérové funkce je zároveň založen časný průkaz nekrosy, např. v tkáňové kultuře, průkazem abnormálního průniku některých barviv do takto poškozené buňky (normální buňka má buněčnou membránu impermeabilní). Lze předpokládat, že do nekrotické buňky in situ mohou nekontrolovaně pronikat látky z extracelulárního prostoru.
Celá situace je znázorněna v následujícím schématu:
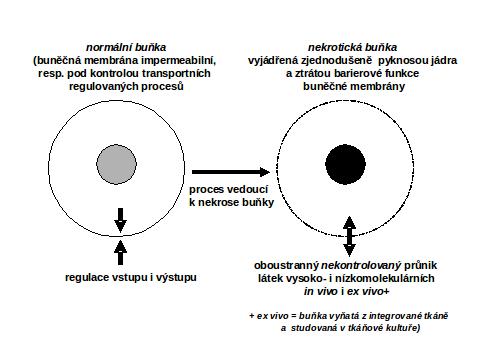
II.6 Nekrosy – klasický obecně patogenetický pohled včetně makroskopie
Nekrosy dosahující makroskopických rozměrů
Nekrosa ischemická (infarkt). Ischémie patří mezi nejdůležitější nekrogenní mechanismy. Totální nedostatek kyslíku a energetických metabolitů vede k zástavě Krebsova cyklu a po určité době (dané množstvím endogenních substrátových reserv, zejména glykogenu) i cytoplasmatické anaerobní glykolysy, a tím k totální depleci ATP a energetickému kolapsu buňky. To má za následek ztrátu funkce iontové pumpy na buněčné membráně vedoucí k úniku kalia extracelulárně (u rozsáhlejších nekros může být i hyperkalemie) a vniknutí sodíku a vody do buňky (intracelulární edém), provázené masivním influxem kalcia do cytosolu buňky, se všemi shora zmíněnými negativními důsledky. Výrazně jsou poškozeny mitochondrie, do kterých vniká voda z cytosolu. Ischémie vede podle situace, za které vzniká, k různým makroskopickým formám nekrosy, které si udržují svoje historické názvy.
Na poškození ischemické tkáně se podílí zřejmě významnou měrou lokální aktivace komplementu, na které se podle řady studií podílí i C reaktivní protein. Výsledkem je vznik membránu atakujícího komplexu, který je specificky vázán na ischemické buňky a podílí se zřejmě na jejich destrukci. Proces lokální aktivace komplementu není zřejmě omezen pouze na ischemii, i když maximum informací pochází ze studia ischémie myokardu. Lokální aktivace komplementu byla prokázána v nekrotických úsecích kosterního svalu za nejrůznějších okolností.
Varianty ischemické nekrosy
Nekrosa koagulační. Tento typ nekrosy je nejčastější. Její název se odvozuje od makroskopického vzhledu postižené tkáně, který je přirovnáván k povařenému (koagulovanému) masu. Struktura tkáně je v postiženém úseku smazána, je však, na rozdíl od kaseosní nekrosy (viz níže), homogenní. Barva je kalně žlutá (jílová). Volum tkáně je zvětšen, což je dáno jednak intracelulárním edémem, jednak různým stupněm překrvení (viz dále). Nejčastějším patogenetickým momentem, ne-li výlučným, je ischemie.
Nekrosa hemorhagická je většinou zvláštní, velmi častou subvariantou předchozí nekrosy, která je spojená s prokrvácením. Příčinou prokrvácení je buď masivní žilní trombosa s následným ireversibilním kapilárním přetlakem, který vede k disrupci kapilár a zástavě oběhu. Jiným běžným mechanismem hemorhagické složky jde naopak o podtlak v tkáňovém okrsku, jehož přívodná konečná arterie byla uzavřena a do okrsku nastává reflux z kapilárně venosních (nízkotlakových oblastí) okolní tkáně, jestliže tomu tkáňový protitlak dovolí (další viz u infarktu). Vzácnějším mechanismem je masivní toxická nekrosa kapilár vyskytující se v rámci těžkých alterativních zánětů (hemorhagicko nekrotické záněty vyvolané např. klostridiemi nebo v rámci moru ap.).
Histologicky je koagulační nekrosa charakterisována dlouhodobou persistencí základní struktury tkáně a uchováním buněčných stínových struktur, na rozdíl od následujících typů nekros.
Nekrosa kolikvační je charakterisována čistě popisně totálním enzymatickým rozkladem tkáně – tedy degradační fází, což se projevuje jejím postupným zkapalněním (kolikvací). Podmínkou vzniku je, na rozdíl od všech ostatních nekros, masivní autolytická a zejména heterolytická enzymová aktivita. V řadě případů tomu napomáhá i chemické složení tkáně, jejíž komponenty jsou snadno degradovatelné. Konečným stadiem je tedy patologická dutina (pseudocysta - dutina bez vlastní výstelky), která prakticky nikdy nemá tendenci ke spontánnímu kolapsu.
Klasickými příklady kolikvační nekrosy je ischemická nekrosa mozkové tkáně - encefalomalacie, která po likvidaci tkáňového detritu zejména aktivovanou mikroglií dává vznik postencefalomalatické pseudocystě (obr.5).
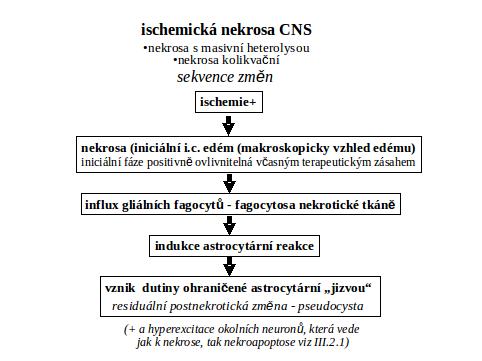
Kolikvační nekrosa však vzniká velmi často v rámci zánětlivých procesů, kdy mechanismu rozpuštění velmi výrazně napomáhá přítomnost granulocytů, známých svým vysokým obsahem proteas. Takto vzniká absces, neboli patologická dutina vzniklá hnisavou kolikvací tkáně.
Kolikvací kaseosní nekrosy (viz shora) vzniká pseudocystická dutina nazývaná kaverna. Kolikvační nekrosa se vyskytuje poměrně často i v nádorové tkáni.
Imunologicky podmíněná nekrosa. Nekrosu může vyvolat ataka buněčné membrány perforinem cytotoxických T lymfocytů nebo komplementem (membrány atakující komplex) s následnými změnami permeability buněčné membrány. V případě ataky buňky T lymfocyty následuje indukci apoptotického procesu (viz apoptosa a regulovaná exocytosa).
Pokud jde o klasickou historickou kaseosní nekrosu, není dodnes znám přesný vyvolávající mechanismus. Zdá se však, že k ní dochází v důsledku imunosuprese.
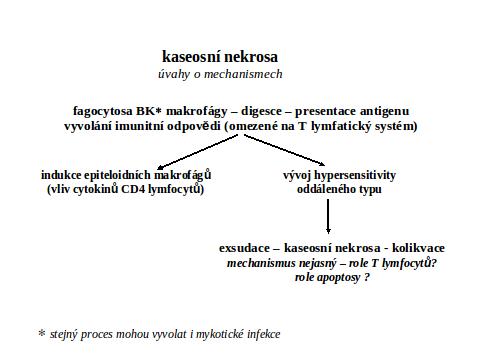
Název je odvozen od makroskopického vzhledu, ve kterém dominuje zrnitost a žlutavá barva nekrotické tkáně, připomínající sýr. Molekulárně-biologickými metodami však lze v makroskopicky definované kaseosní nekrose detekovat apoptotické buňky (aktivovanou kaspasu 3 a zlomy DNA) (viz metody průkazu 3.1.2). Patogeneticky je prakticky výhradně vázána na zánětlivé chronické procesy, ve kterých dominuje buněčný typ hypersensitivity. Klasickým příkladem je infekce Mycobacterium tuberculosis, kde se zdá, že při tvorbě granulomu a kontrole imunopatologie, t.j. při kaseifikaci, hraje rozhodující roli TNF-alfa (viz ale též např. některé infekce mykotické a lues).
Kaseosní nekrosa má dvojí osud. V případě likvidace infekce persistuje a charakteristicky sekundárně kalcifikuje (viz kalcifikace), čímž se stává výtečně viditelná při rentgenovém vyšetření. Persistence se vysvětluje inhibičním účinkem lipidních komponent mykobakterií. Pokud dojde k masivní aktivaci infekce v ložisku, dojde k totálnímu rozkladu tkáně zkapalněním (kolikvací), způsobenému heterolyticky masivní imigrací polynukleárních leukocytů do ložiska (viz tuberkulosní zánět).
Histologicky je příznačný totální granulární rozpad tkáně a buněk, jejichž individualita zcela zaniká. Dále je to persistující chromatinový poprašek z rozpadlých jader, který dal kaseosní nekrose další eponym "poprašková". Poprašek se barví hematoxylinem typicky modře, což kontrastuje s celkovou eosinofilií nekrotické tkáně. (Obr.6 kaseosní nekrosa)
Tzv. Leighova nekrosa – nekrosa mozkové tkáně u mitochondriálních poruch
Jde nekrosu vyskytující se nejčastěji jako symetrické nekrosy mozku, typicky v basálních gangliích, ale i nižších etážích CNS, včetně mozečku. Nekrosa je vázána na mitochondriální poruchy, typicky na hluboké deficity aktivity cytochoromoxidasy (komplex IV) nebo ATP syntasy (komplex V). Jde o nekrosu, která postihuje šedou hmotu a vede k její degradaci a rozpadu. Pozoruhodné je, že velmi dlouho persistují neurony. Pro další vývoj změn je charakteristická astrogliosa a neovaskularisace. Výsledkem nebývá pseudomalatická pseudocysta, tak, jak je tomu běžně u ischemických nekros. Nekrogenní faktor není znám, předpokládá se velký význam volných radikálů, a to i mimo Leighovu nekrosu. Je nutno zdůraznit, že analogická nekrosa nebyla doposud popsána mimo mozek. Obr.7 Leighova nekrosa
Další příčiny nekrosy, jako volné radikály, zejména kyslíkové, bakteriální toxiny, virová infekce a další jsou k disposici v příslušných oborových textech
Zvláštní varianty nekrosy a nekrosy mikroskopických rozměrů*
Autolysa probíhající v tkáních post mortem má v mnohém nepochybně podobný charakter jako autolysa, probíhající v nekrose. Autolysa se od nekrosy liší menší intensitou změn, což je dáno absencí tkáňové reakce (heterolysy) a nepřítomností primární destrukce buňky nekrogenním podnětem. Posmrtná autolysa je katalysována fysikálně (teplem) a jakýmkoliv premortálním poškozením tkání. Celkově je úměrná enzymatickému vybavení tkáně. Jde zejména o hydrolytické enzymy (proteasy, lipasy). Extremním příkladem jsou žlázy typu pankreatu, sliznice žaludku a gastrointestinálního traktu. S tím kontrastuje např. lymfatická tkáň, ve které probíhají autodegradační procesy nesrovnatelně pomaleji. Za zmínku stojí, že z kůže lze vykultivovat fibroblasty i 2-3 dny po smrti, jestliže bylo možno minimalisovat autolysu.
III.1 Dnešní definice. Jde o zánik buňky, realizovaný vlastním vývojově konservovaným programem, který se skládá z etap. Je proto nazývána programovanou buněčnou smrtí (PCD programmed cell death). Jde o aktivaci kaskády procesů, které jsou za normální situace v neaktivním stavu. Aktivace PCD je integrální součástí biologie tkání. Je aktivovaná a v plné formě realisovaná v průběhu embryogenese a organogenese a postnatálně k udržení homeostasy organismu Může být nastartována za řady patologických stavů např. jako obranný preventivní mechanismus, kterým se organismus zbavuje nadbytečných, poškozených nebo mutovaných buněk. Stále více dokladů naznačuje, že může být aktivována v rámci nekrosy (viz níže).V nejobecnějším slova smyslu lze tedy nazírat na PCD jako na zánik buňky, zprostředkovaný kaskádou procesů vývojově konservovaných, ale pravděpodobně i z procesů ad hoc aktivovaných, např. v rámci pomaleji probíhajícího procesu nekrotického, pokud není znemožněna zničením potenciálních kaskád. Na konci plně realisované PCD je destrukce vitálního centra buňky – jaderného kompartmentu a/nebo řady cytoplasmatických struktur (viz níže). Proces je závislý na energii. PCD je přirovnávána k buněčné sebevraždě nebo k exekuci buňky ustálenými mechanismy. V modifikované formě hrají některé etapy PCD zásadní roli v diferenciaci některých buněčných typů (III.5-6).
V současné době se rozlišují tři druhy PCD
PCD I zprostředkovaná aktivací kaskády kaspas a končící typickou degradací DNA řady cytoplasmatických struktur. Tomuto typu PCD je věnováno maximum následného textu. Termín apoptosa je reservován pro tento typ PCD.
Dále jsou uznávány PCD nezávislé na kaspasách. Jednou z nich je PCD zprostředkovaná indukcí masivní autofagie s likvidací cytoplasmatických struktur. Je pro ní zaveden termín PCD II.
Dále je zmiňována PCD charakterisovaná distensí endoplasmatického retikula a mitochondrií; je pro nipoužíván termín paraptosa (apoptose podobná PCD).
III.2 PCD I Apoptosa (buněčná smrt zprostředkovaná aktivací kaskády kaspas).
Jde o buněčnou smrt realisovanou aktivací kaskády proteolytických enzymů – kaspas, existujících ve formě neaktivních proenzymů (prokaspas) na jejich aktivní formu. Likvidace buňky usmrcené apoptosou je součástí programované smrti (viz níže) a je pro organismus „ekologická,“ což kontrastuje s „neekologickou“ nekrosou (viz shora).
Mechanismus apoptosy. Při apoptose hrají důležitou úlohu cysteinové proteasy zvané kaspasy, štěpící protein ve specifické sekvenci minimálně čtyř aminokyselin, a to za invariantním aspartátem v pozici 1 (cystein aspartate protease). V savčím genomu je 14 genů kódujících kaspasy. Změna prokaspasy na aktivní kaspasu je dána částečnou proteolysou. V kaskádě kaspas se rozlišují iniciační kaspasy, které svojí proteolytickou aktivitou aktivují další kaspasy, a tím amplifikují apoptotický signál, který skončí smrtí buňky. Mezi iniciační (apikální) kaspasy patří kaspasa-2,-8,-9 a -10 (aktivované zevní cestou – DISC komplexem, nebo vnitřní – mitochondriální cestou v apoptosomu, viz níže). Mezi exekuční (efektorové) patří kaspasa-3,-6 a -7.
Dále existuje skupina kaspas, které se podílejí na diferenciaci buněk (III.5) a na regulaci zánětlivé odpovědi (viz III.6), aniž by aktivovaly apoptotickou kaskádu.
Kaspasy jsou lokalisované v cytosolu. Pouze výjimečně byly detekovány také v cytoplasmatických granulích nejasné povahy.
Aktivované exekuční kaspasy degradují přímo proteolyticky své substráty, kterými je řada cytoplasmatických proteinů: vimentin, cytokeratin, aktin, amyloid prekursorový protein, fodrin, gelsolin, jaderných proteinů: lamin B, acinus (viz níže), PARP a dalších doposud ne zcela přesně definovaných, což má za následek rozpad jaderného kompartmentu a známé vesikulální výchlipky buněčné membrány (blebbing), které neobsahují organely. Jsou způsobeny štěpením ROCK I kinasy aktivovanou kaspasou. To vede k deregulaci kinasové aktivity a nadměrné fosforylaci lehkého řetězce myosinu a hyperkontrakci aktomyosinu, a tím k odtržení cytoplasmy od plasmatické membrány.
Zesíťování proteinů je způsobeno expresí a aktivací tkáňové transglutaminasy, cytosolového kalcium-dependentního enzymu, sřetězujícího proteiny buněčné membrány a cytoskeletu molekulou glutaminu, proces vyjádřený zejména při procesu rohovění v epidermis, kde se tímto sřetězením zpevňuje rohový lem keratinocytu.
Degradace DNA. Aktivované exekuční kaspasy aktivují CAD (caspase activated DNAse) tím, že degradují její inhibitor. Aktivovaná CAD pak degraduje internukleosomálně DNA na charakteristický „DNA žebřík“ (fragmenty velikosti 180-200 bází). V poslední době je věnována pozornost nedávno objevenému proteinu acinus (apoptotic chromatin condensation induced in the nucleus), lokalisovanému normálně v jádře (ve třech isoformách L, S, S´), který je v průběhu apoptotické kaskády štěpen kaspasami na C i N koncích. Vzniklý fragment (p17) má schopnost kondensovat chromatin i v experimentálních podmínkách bez apoptosy. Mechanismus spočívá v aktivaci proteinkinasy D a následné fosforylace histonu H2B. Zmíněné isoformy acinu byly prokázány jako součást spliceosomu. Acinus je také součástí tzv. ASAP komplexu (apoptosis- and splicing-associatd protein), který má schopnost inhibovat procesování RNA. Přisuzuje se mu i přímá role v akceleraci zániku buňky postižené apoptosou.
Apoptotické dráhy (viz schéma níže)
Do dnešních dnů byly identifikovány jako hlavní iniciační apoptotické dráhy (i) dráha zevní (extrinsic) neboli dráha zprostředkovaná aktivací receptorů situovaných na buněčné membráně a (ii) několik vnitřních (intrinsic) drah, iniciovaných z mitochondrií, endoplasmatického retikula nebo lysosomů. Jsou v různé míře propojeny a molekuly z jedné dráhy mohou ovlivňovat dráhu druhou.
Vnější iniciační apoptotická dráha
Tato dráha má začátek v aktivaci transmembránových receptorů po jejich interakci s příslušnými ligandy. Nejznámější „death“ receptory jsou členové rodiny TNF (tumor necrosis factor), které jsou tvořeny na cystein bohatou extracelulární doménou a cytoplasmatickou 80-aminokyselinovou doménou nazývanou „death domain“. Tato doména přenáší smrtící signál z buněčného povrchu na intracelulární signální dráhu. Po navázání ligandu nastane trimerisace receptoru a následná asociace s adaptorovými molekulami a prokaspasou 8 (případně s prokaspasou 10) za vzniku DISC komplexu (death inducing signalling komplex), což vede k autokatalytické aktivaci kaspasy 8 a dále kaspasy 3, která pak aktivuje CAD (caspase activated DNAse). Mezi nejznámější ligand-receptor páry patří FasL-FasR (CD 95), TNFalfa-TNFR1, a další. Tato dráha podléhá složité regulaci. Jednak závisí na lokalizaci komplexu receptor-ligand do tzv. lipidových raftů a volně v cytoplasmatické membráně. Tato distribuce se liší u různých typů buněk a reguluje jejich odpověď na TNF-α. Dále je odpověď závislá na tom, zda dojde k internalizaci komplexu ligand-receptor (clathrin-zprostředkovaná endocytosa) a formaci DISC komplexu (cytotoxická, proapoptotická signalizace), nebo zda z důvodu nízkého množství ligandu nebo přítomnosti různých inhibitorů (buněčných nebo např. virových) k internalizaci nedojde a je spuštěna signalizace vedoucí k aktivaci NF-B, ev. MAPK (mitogenní a proinflamatorní signalizace). Exprese příslušných receptorů podléhá regulaci. Vazba ligand – receptor aktivuje neutrální sfingomyelinasu, která štěpí sfingomyelin za vzniku ceramidu, který se dále významně podílí na aktivaci apoptosy.
Aktivace FAS dependentní cesty vede v některých buněčných typech přímo do jaderného kompartmentu, v jiných buňkách má mezistanici v mitochondriích (viz níže). Závisí to na přítomnosti Bid proteinu. Bid protein (cytoplasmatický) je štěpen specificky kaspasou 8 (exekuční kaspasa vnější dráhy) a jeho fragmenty vnikají do mitochondrií, kde indukují translokaci cytochromu c a tím mitochodndriální vnitřní dráhu. Experimentálním vyřazením Bid proteinu vedla aktivace FAS dependentní cesty k apoptose pouze v buňkách, které tento protein normálně neexprimují.
U cytotoxických T lymfocytů (CTL) kromě vnější dráhy přes FasL-FasR byla pro účely usmrcení nádorových buněk a buněk infikovaných virem vytvořena ještě jedna dráha, který zahrnuje sekreci transmembránové molekuly (perforin), která vytvoří v membráně cílové buňky pór, kterým dojde k přenosu cytoplazmatických granul obsahujících granzym A a granzym B. Tyto dva enzymy jsou proteasy. Granzym B štěpením aktivuje prokaspasu-10 a tím nastartuje na kaspasách závislý apoptotický proces. Granzym A kaspasy neaktivuje. Štěpí inhibitor nukleas a vede tak k masivní jednovláknové DNA fragmentaci.
Aktivace FAS signální cesty může vést i k proliferativní buněčné reakci. V případě myokardu je popsána i účast aktivace FAS v indukci hypertrofie kardiomyocytů.
Vnitřní iniciační apoptotická dráha
Iniciace apoptosy z mitochondrií. Jde o řadu procesů procesů, programovaných nebo neprogramovaných, které způsobí otevření mitochondriálního póru (MPT mitochondrial permeability transition pore). Proteiny některých virů, které jsou cíleny do mitochondrií, mohou ovlivnit MPT. Značný význam má ovlivnění poměru anti- a proapototických proteinů lokalizovaných v mitochondriích (viz níže).Všechny tyto procesy způsobují v různé míře a v různém poměru translokaci dvou hlavních skupin intermembránových proteinů. Do první skupiny patří, mimo jiné, cytochrom c, čímž dochází k aktivaci exekučních kaspas. Cytochrom c indukuje asemblaci apoptosomu, tj. komplexu cytochromu c, Apaf 1 (apoptotic protease activating factor 1) a prokaspasy 9, s následnou aktivací kaspasy 9 a dále exekuční kaspasy 3. Do druhé skupiny pro-apoptotických proteinů patří AIF (apoptosis inducing factor) a endonukleasa G, které jsou některými považovány za nezávislé na aktivaci kaspasové kaskády. AIF je uvolněn z mitochondrie vlivem PAR (poly ADP-ribosy) vytvořenou a uvolněnou z jádra vlivem PARP (PAR polymerasy). V literatuře je pro tuto druhou cestu používán název parthanatos (thanatos – smrt, inicovaná PAR).
Mitochondrie jsou stále více považovány za jeden z hlavních fokusů iniciace apoptosy, ať již přímo za různých patologických procesů, nebo jako mezistanice při jiných apoptotických drahách (ER, lysosomy, jádro).
Iniciace apoptosy z endoplasmatického retikula při nadměrném stresu v rámci UPR (unfolded protein response) aktivuje kaspasu 12, specifickou pro ER, která dále aktivuje exekuční kaspasu 3. Avšak kaspasa 12 je exprimována jen u myší, u lidí existuje převážně jako pseudogen. Jeho funkci zde podle některých zastupuje kaspasa-4. Vedle toho dochází k aktivaci mitochondriální kaspasové cesty přes řadu mechanismů, včetně uvolnění kalcia z ER.
Iniciace apoptosy z jádra je aktivována při poškození DNA. Dochází jednak k aktivaci p53, následně k aktivaci proapoptotických genů ze skupiny Bcl 2 proteinů (Bax, NOXA, PUMA), které jsou translokovány do mitochondrií, jednak k zástavě buněčného cyklu (p21). Tato cesta je považována za jeden z ochranných mechanismů proti nádorové transformaci buňky. Nově se sem řadí i apoptosa indukovaná poruchou mitosy. Apoptoticky změněné jádro může být zdrojem proteinů translokovaných do mitochondrií, což představuje eskalaci apoptotického procesu (např. TR3 jaderný receptor).
Iniciace apoptosy z lysosomů je diskutována, zejména jako následek ztráty integrity membrán lysosomálního kompartmentu s následnou aktivací mitochondriální cesty apoptosy. Velký význam se přikládá působení endoproteasové aktivity katepsinu D, která může vést i k aktivaci kaspas.
Další podrobnosti jsou v uvedené literatuře
Nagata S.: Biddable death. Nat Cell Biol 1: E143-E146, 1999
Kroemer G.: Mitochondrial control of apoptosis: an introduction. BBRC 304:433-435, 2003
Green D.R. a Kroemer G.: The pathophysiology of mitochondrial cell death. Science 305: 626-9, 2004
Martinou J-C a Green D.R.: Breaking the mitochondrial barrrier. Nature reviewes. Molecular cell biology.2: 63-67, 2001
Green D.R. Kroemer G.“ The pathophysiology of mitochondrial cell dotah. Science 304: 626- 629, 2004
Raheva V.I. a Domingos P.M.: Cellular response to endoplasmic reticulum stress and apoptosis. Apoptosis 14: 996-1007, 2009
Szegezdi E. a spol. : Mediators of endoplasmic reticulum stress-indiuced apoptosis. Review. EMBO reports 7:
Castedo M. a spol.:Cell death by mitotic catastrophe: a molecular definition. Oncogene 23: 2825-2837, 2004
Boya P a spol.: Lysosomal membrane permeabilization induces cell death in a mitochondrion-dependent fashion. J. Exp.Med. 197: 1323-1334, 2003
Ohniska apoptosy a propojení mezi jednotlivými cestami jsou shrnuty na následném schématu.
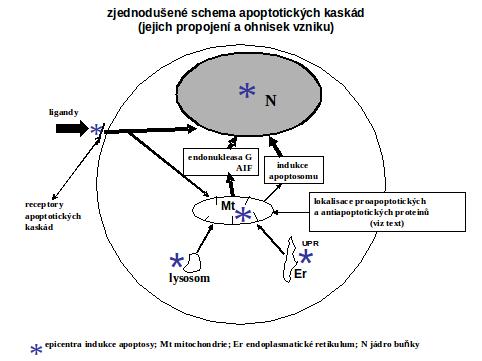
Faktory ovlivňující proces apoptosy. Aktivace prvých kroků apoptické kaskády ať již zevní nebo vnitřní cesty neznamená realisaci celé cesty. Další etapy mohou být pod kontrolou faktorů, které nejsou zcela známy, s výjimkou rodiny Bcl 2 proteinů, které se nacházejí v membráně mitochondrií, ale i v endoplasmatickém retikulu a v perinukleární cisterně. Její členy můžeme rozdělit na anti-apoptotické proteiny (Bcl-2, Bcl-XL, a další) a na pro-apoptotické proteiny (Bax, Bak, Bid, Bad a další). Vedle toho je známa skupina proteinů inhibujících kaspasy (AIP apoptosu inhibující proteiny). Tyto proteiny a jejich poměrové zastoupení v buňce hrají důležitou roli v rozhodování, zda buňka vstoupí do apoptosy, nebo jestli tento proces zvrátí, nebo se aktivace kaspas použije pro účely diferenciace (viz III.5).
Má se za to, že hlavním mechanismem účinku je regulace permeability mitochondriální membrány. Zvýšená exprese Bcl 2 proteinu inhibuje apoptosu. Z experimentů vyplývá, že alespoň v oblasti mitochodrií by mohl signifikantně tlumit destrukční vliv volných radikálů, které právě v těchto oddílech buňky vznikají. Existují doklady pro to, že v oblasti endoplasmatického retikula a v perinukleární cisterně by mohl ovlivňovat uvolňování Ca++, jehož zvýšená i.c. koncentrace se považuje za významný faktor v indukci apoptosy. Aktivací genu bcl-2 se významně inhibuje apoptosa a prodlužuje životnost buněk, ve kterých je tato aktivace vyjádřena. Jako klasický příklad se uvádí aktivace bcl-2 genu ve skupině folikulárních lymfomů, kde se tento gen mechanismem translokace (14,18) (q32,q21) dostává do oblasti transkripce genu pro těžké řetězce a je zvýšeně přepisován. Tento mechanismus se pokládá za významný v patogenese některých maligních (folikulárních) lymfomů.
Vzhled apoptotické buňky. Z cytologického hlediska je pro tuto variantu apoptosy charakteristické progresivní zmenšování buňky (shrinkage necrosis) a časná pyknotisace jádra, mnohem více vyjádřená než u nekrosy. Chromatin se velmi často kondensuje na periferii jádra, typicky ve formě půlměsíce. Jadérko se kondensuje, fibrilární centra persistují, periferní části jadérka se dispergují v nukleoplasmě. Jádro se rozpadá na fragmenty. Buněčná membrána vykazuje četné „puchýřovité“ výběžky, prosté organel. Součástí apoptotického procesu může být, zejména v tkáňové kultuře, fragmentace buňky na isolované části, což je dáno masivní atakou cytoplasmatických (zejména cytoskeletálních) proteinů exekučními kaspasami (viz výše). Apoptosa se projevuje pouze na úrovni mikroskopické. Není známa tak masivní apoptosa, aby měnila tkáň makroskopicky (snad s výjimkou kaseosní nekrosy, viz výše).
Obr. 8 apoptosa leukocytu periferní krve
Obr. 9 apoptosa v choriovém klku
Osud buňky postižené apoptosou. Povrch apoptotické buňky je modifikován, což vysvětluje snadnost fagocytosy okolními buňkami (nezávisle na jejich typu). Fagocytující buňkou mohou být sousední buňky (epitelie, fibroblasty, endotelie, hladké svalové buňky), tedy neprofesionální fagocyty (obr.10, obr. 11). Současně jsou atrahovány i fagocyty profesionální (makrofágy) spolu s nezralými dendritickými buňkami. Jde o indukci nových domén na buněčné membráně apoptotické buňky. Jednak jde o přesmyk fosfatidylserinu z vnitřní vrstvy buněčné membrány do vrstvy zevní ztrátou aktivity příslušné flipasy (ATP-dependentní enzym), dále ztrátou sialové kyseliny z povrchových glykoproteinů postižené buňky, což vede k expresi hexos a hexosaminů. Popisuje se ektopická exprese kalretikulinu (protein endoplasmatického retikula) a jeho kolokalisace s fosfatidylserinem. Velký význam se přisuzuje peroxidaci lipidů na buněčné membráně. Předpokládá se i kontakt s ER-Golgiho komplexem, který by vysvětlil přítomnost meziproduktů syntesy oligosacharidů na povrchu zacházející buňky. To vše modifikuje povrch apoptotické buňky a zajišťuje kontakt s okolními buňkami. Za fagocytosu apoptotických buněk jsou zodpovědné receptory, např. receptor pro fosfatidylserin, ale i vazba komplementu (C1q).
Z toho vyplývá, že apoptotické buňky
Odstranění apoptotických buněk je nezbytné, protože přispívá k udržení imunologické tolerance. Ukazuje se, že je-li proces fagocytosy narušen, může to vést k rozvoji autoimunního onemocnění (předpokládá se u SLE). Pokud nedojde k fagocytose apoptotické buňky, podléhá rozpadu (autolyse ?), což je nazývané sekundární nekrosou.
Přehled o této problematice je podán v řadě prací, z nichž uvádíme následující:
Paidassi H. et al.: How phagocytes track down and respond to apopgtotic cells. Critical Reviewes in Immunology29,111, 2009
Savill J. et al. A blast from the past: clearance of apoptotic cells regulates immune response. Nature reviews. Imunology. 2, 966, 2002
Albert M.L. : Death-defying immunity: do apoptotic cells influence antigen processing and presentation? Nature reviews. Imunology 4: 223, 2004
Apoptosa v akci. Apoptosa je v řadě případů spontánním, naprosto esenciálním fysiologickým procesem, který je cíleně aktivován zejména v embryonálním období jako součást embryo- a organogenese. Programovaný zánik buněk je tak integrální součást embryonálního vývoje. Zahrnuje i numerickou úpravu počtu buněk. Např. velké procento neuronů programově zaniká během vývoje mozku. Dalším příkladem je plánovitá destrukce primární kůry nadledvin na konci fetálního období a její náhrada definitivní kůrou. Zanikající primární kůra podléhá resorpci makrofágy. Celá oblast resorpce má historický název „tříštivá zóna“. Apoptosou zaniká syncyciotrofoblast (obr.12). Apoptotická tělíska syncyciotrofoblastu, pokud nejsou odstraněna makrofágy, uvolňují po spontánním rozpadu fragmentovanou DNA, která cirkuluje v oběhu matky. Je využívána pro testování stavu placenty.
Sharp AN et al.: Placental Apoptosis in Health and Disease. American Journal of Reproductive Immunology 64 (2010) 159-169
Postnatálně. Odhaduje se, že postnatálně denně zaniká apoptosou (a dalšími formami PCD ?) 1011 buněk v konstitucionálních postnatálních klonech obměňujících se tkání, které mají programově omezenou životnost. Příkladem jsou enterocyty, keratinocyty, většina krevních elementů, a další (viz kapitolu Fysiologie a patologie klonů).
Sekvence změn programované buněčné smrti u C. elegans. Efektorovými (exekučními) molekulami jsou CED 4 (savčím homologem je mitochondriální Apaf 1, viz výše) a CED 3 (homologem u savců jsou exekuční kaspasy 3/9). Oba jsou inhibovány CED-9 (lidským homologem je skupina antiapoptických členů rodiny Bcl-2 proteinů). CED-9 je inhibován EGL-1, který sám je inhibován TRA-1 a CES-1 proteiny, transkripčními faktory, inhibujícími jeho syntesu. Jde tedy o aktivaci mitochondriální vnitřní cesty (u nematodů není vytvořená zevní dráha !). Její nastartování je dáno snížením transkripce TRA-1 a CES-1 → zvýšení EGL-1→ inhibice CED-9 → aktivace exekučních CED 3 a CED 4 → nastartování mitochondriální cesty (vytvoření apoptosomu).
Obr. 13 nekrosa a apoptosa u C.elegans
Proces apoptosy je pro udržení homeostasy organismu cíleně aktivován v rámci nejrůznějších patologických stavů. Příkladem je: odstraňování funkčně nevhodných B lymfocytů ve foliklech uzlin, výsledek známý jako Flemingova (apoptotická) tělíska v centrofolikulárních makrofázích lymfatické tkáně (obr.14); odstraňování autoimunně orientovaných T lymfocytů v thymu; redukce numericky nadbytečné populace buněk v hyperplastických tkáních (návrat k normě po hormonální stimulaci, nebo redukce buněk při patologicky snížené hormonální stimulaci), následek deprivace růstových faktorů a řada dalších.
Ukazuje se, že apoptosa může být výrazem dysregulace buněčného cyklu. V buňce, stimulované k vstupu do S fáze, jejíž další postup je ale blokován, dochází k apoptose. Apoptosou usmrcuje cytotoxický T lymfocyt a Natural killer (NK) cílové buňky, obsahující virus. Při vytvoření imunologické synapse mezi lymfocytem a cílovou buňkou je aktivována regulovaná exocytosa cytotoxických granul lymfocytu, která jsou soustředěna do synapse, dojde k perforaci cílové buňky (perforinem) a následnému vylití obsahu granul do cílové buňky a aktivaci apoptosy (viz výše). Blíže o kaseosní nekrose viz výše nekrosa.
Apoptosa může být neúplná (apoptosis interruptus). Např.cytochemicky prokazatelná aktivace kaspasy 3 může existovat isolovaně bez prokazatelné ataky DNA a dalších vitálních center buňky. S tím je v souhlase i role kaspas mimo apoptosu (III.6) a v procesech atenuované apoptosy (III.5). Podle některých může být apoptosa, konkrétně v myokardu, potenciálně reversibilní, meta-stabilní stav
Masri C and Chanrdrasekhar Y. : Apoptosis: a potentially reversíble, meta-stable state of the heart Heart Fail Rev 13: 175-179,2008)
Apoptosa může být indukovaná terapeuticky. Klasickým příkladem je destrukce lymfocytů po podání kortikosteroidů. Jde o využití fysiologického procesu destrukce T lymfocytů v thymu (viz shora) . Glukokortikoidy (GC) mají celou řadu imunomodulačních aktivit, mezi než patří schopnost indukovat apoptosu T lymfocytů. GC se vážou na glukokortikoidní receptor na povrchu T lymfocytů, a ačkoliv nevyvolávají jejich apoptosu přes klasické cesty aktivace apoptosy, proteiny jako je Bcl-2 a i kaspasy se v GC indukované apoptose lymfocytů nepochybně uplatňují. GC hrají roli při vývoji T lymfocytů v thymu, a to při jejich negativní i pozitivní selekci, dále omezují aktivací indukovanou buněčnou smrt a aktivují apoptosu thymocytů po polyklonální aktivaci. Vzhledem k jejich schopnosti aktivovat lymfocytární apoptosu jsou využívány v léčbě celé řady chorob, v jejichž patogenezi hrají lymfocyty zásadní roli: jde především o některé autoimunitní choroby (včetně roztroušené sklerosy a autoimunitní thyroiditidy), a dále o hematologické malignity a solidní tumory z imunitních buněk. GC se rovněž využívají v transplantační medicíně, kdy patří k základním léčivům podávaným při závažných reakcích hostitele proti štěpu.
Je kombinací nekrosy a projevů apoptosy. Uznávají se obě varianty termínu – jak nekroapoptosa, tak aponekrosa. Převládá názor, že nekrosa i apoptosa (nebo obecně PCD) mohou na sebe navazovat a že nejde o striktně oddělené procesy. Velmi blízká realitě je představa, že při působení nekrogenního faktoru záleží na jeho intensitě a rychlosti působení, zda bude kompletována nekrosa, tedy kompletní zánik buňky, která se chová pasivně, nebo zda bude poškození částečné a naváže na něj apoptosa. Rozhodující není pouze intensita nekrogenního faktoru, ale i energetický stav napadené buňky. Aktivace apoptosy je závislá na energii. Při deplecí ATP se rozvíjí nekrosa, při dostatku ATP (spontánně nebo při recirkulaci v ischemické ložisku) se proces změní na apoptosu.
Vazba apoptotických kaskád na nekrosu naznačuje, že jejich aktivace je součástí patologického procesu a že lze na jejich aktivaci pohlížet jako na „vnucenou, neplánovanou“, přispívající k poškození tkáně. S tím je v souhlase i positivní ovlivnění patologického procesu inhibitory apoptosy a celková snaha apoptotickou kaskádu terapeuticky utlumit pro positivní ovlivnění procesu (např. ischémie). Tím se tyto stavy odlišují od PCD mimo patologické stavy, kde plní nezbytnou funkci ve prospěch homeostasy.
Další informace lze nalézt v následných publikacích:
Formihli L. et al.: aponecrosis: morphological and biochemical exploration of a syncretic process of cell death sharing apoptosis and necrosis. J. Cell. Physiol. 182: 41-49. 2000
Bredersen D.E.: Key note leciurte: toward a mechanistic taxonomy for cell death programs. Stroke 38:652-660, 2007
Lemasters J.J. Dying a thousand deaths: redundant pathways from different organelles to apoptosis and necrosis. Gastroenterology 129: 351-360, 2005
Příklady nekroapoptosy
Apoptosa jako součást ischemické nekrosy mozku
Zde je známa jako excitotoxická nekrosa. Je vyvolána masivním drážděním Nmethyl-D-aspartátových (NMDA) receptorů excesem glutamátu a aspartátu uvolněných z ischemické tkáně. Tyto receptory, ovládají kalciové kanály a další iontové kanály neuronu. Jejich nadměrné dráždění vede k enormnímu influxu Ca++ (současně i Na+, Cl-,vody) do neuronu a k neregulovatelnému zvýšení aktivit proteinas, fosfolipas a dalších enzymů (včetně neuronální NO syntasy). K této nekrose dochází v hraničních zónách mozkových infarktů, a její příčinou jsou mediátory masivně uvolněné z nekrotických neuronů. Vhodnou aplikací antagonistů glutamátu lze tedy zmenšit následky ischemie. Ukazuje se, že ischemie zvyšuje citlivost těchto receptorů k uvedeným mediátorům, které se tímto stávají neurotoxiny. Excitotoxická nekrosa je klasifikována jako apoptosa, provázející ischemickou nekrosu (viz níže).
Další podobnosti jsou v publikaci Broughton B.R.S. et al.: Apoptotic mechanisms after cerebral ischemia. Stroke 40:331-339, 2009
Apoptosa jako součást ischemické nekrosy myokardu
Její účast v ischemické nekrose je všeobecně uznávaná, opakovaně prokázaná a kvantifikovaná ve vztahu k ischemicky podmíněné nekrose. Apoptosa je popisovaná jako druhá vlna zániku kardiomyocytů v okolí ischemické nekrosy, nasedající na předpokládané částečné poškození kardiomyocytů mimo ischemické epicentrum (Dorn W II and Diwan A:The rationale for cardiomyocyte resuscitation in myocardial salvage.J.Mol.Med. 86:1085-1095, 2008)
Aktivace apoptosy v kardiomyocytech je popisovaná u řady kardiovaskulárních poruch
Lee Y and Gustafsson A.B.: Role of apoptosis in cardiovascular disease. Apoptosis: 14: 536- 548, 2009
Dorn G.W. II: Apoptotic and nonapoptotic progranmmmed caediuomyocyte death in ventricular remodelling. Cardiovacular Res. 81: 465-473, 2009
III.2.2 metody průkazu apoptosy
Morfologický průkaz apoptosy. Jde o svrchu zmíněné změny ve smyslu pyknotisace jader, svraštění buňky, její případná fragmentace a následná fagocytosa.V elektronové mikroskopií je zejména densifikace mitochondrií proti mitochondriálnímu edému, který je běžný u nekros a u autolysy.
Průkaz degradace DNA K průkazu zlomů nukleární DNA se používá:histochemická technika
(i) TUNEL (TDT - terminální deoxynukleatidyl transferasa – mediated dUTP-biotin nick end labelling), která prodlužuje přerušené řetězce templát-nezávislou cestou (na rozdíl od DNA polymerasy). V reakční směsi jsou nukleotidy konjugované s biotinem nebo jiným antigenním epitopem, který je pak imunofluorescenčně detekován. Řetězec navázaných nukleotidů je pak příčinou positivního zbarvení apoptotických jader (obr. 15). Reakci však nelze považovat za zcela specifickou, neboť znázorňuje i jednovláknová přerušení, která mohou vznikat i zcela nezávisle jak in vivo, tak při zpracování tkáně. Apoptosu definuje přerušení obou vláken.
(ii) na rozdíl od této templát nezávislé techniky (TUNEL) lze použít techniku ISNT (in situ nick translation), detekující jednovláknová přerušení templát-závislou cestou pomocí DNA polymerasy I (nerozštěpené vlákno slouží jako templát). V reakční směsi jsou označené nukleotidy
(iii) detekce translokovaného fosfatidylserinu na zevní list buněčné membrány annexinem lze provést pouze na intaktních buňkách (v řezech jsou detekci přístupné oba listy membrány). Translokace lipidu však není považována za zcela specifickou pro apoptosu.
(iv) další doporučené techniky, použitelné pro in situ detekci apoptosy v řezech, jako detekce aktivované (procesované) kaspásy 3, detekce degradovaných cytoplasmatických proteinů (v epiteliích např. fragmenty cytokeratinu 18) a další, jsou shrnuté v publikaci: Stadelmannn C a Lassmann H: Cell Tiss.Res. 301: 19-31, 2000)
Biochemicky je možno prokázat charakteristický typ degradace (internukleosomální degradace) na fragmenty, které jsou zhruba násobky 180-200 bp a které dávají charakteristický žebříčkový vzhled při elektroforese.
Kometový esej (elektroforesa jednotlivých buněk) se považuje za rychlou a spolehlivou metodu detekce poškozené DNA v jednotlivých buňkách. Spočívá v zalití buněk do agarosy, odstranění buněčných komponent vysokou koncentrací solí nebo detergenty a v relaxaci DNA. V elektrickém poli se pak rozdělí DNA ve tvaru komety, což lze vizualizovat pomocí fluorescenčního indikátoru vážícího se na DNA a fluorescenční mikroskopie. Podle toho, zda se esej provádí za alkalického či neutrálního pH, lze podle některých reportů rozlišit jednořetězcové a dvouřetězcové zlomy (dvouřetězcové zlomy jsou typické pro apoptosu).
III.3 Další uznávané varianty PCD
PCD II. Jedna ze stále více uznávaných forem programované buněčné smrti je definovaná jako programově vystupňovaná autofagocytosa, progresivně destruující vitální struktury cytoplasmy. Razí se pro ni název programovaná buněčná smrt typu II. Proces končí cytologickým obrazem velmi podobným kaspasové apoptose, včetně urychleného odstranění fagocytosou. Dominantní cytologickou změnou je však excesivní vakuolisace cytoplasmy. Zřetelnost autofagických vakuol může být narušena obsahem, tvořeným cytoplasmatickými organelami v různém stadiu degradace. Proces je pokládán za fylogeneticky velmi starý. PCD II je též aktivována během vývoje.
Nově se popisuje velmi úzký vztah mezi apoptosou a autofagií (tedy mezi PCD I a II) vzhledem k tomu, že byl prokázán vztah mezi proteiny Bcl-2 a Beclinem 1 (humánní analog Atg5)
Paraptosa, programovaná buněčná smrt nezávislá na kaspasách, s výjimkou kaspasy 9, je charakterisována pouze zduřením mitochondrií a endoplasmatického retikula. Cytologicky je dominantou cytoplasmatické vakuolisace. Autofagie není aktivována. Tato forma PCD je popsána za vývoje a při některých neurodegenerativních poruchách. Je otázkou, zda se ujme termín PCD III, ( viz oddíl IV., práci Galluzzi et al., 2007)
Bursch W.The autophagosomal lysosomal kompartment in programmed cell death. Cell Death and Differentiation 8.569, 2000
Gozuacik D a Kimchi A: Autophagy and cell dotah. Curr Top Dev Biolo. 78:217-245, 2007
Shinmizu S a spol:. Role of Bcl-2 family proteins in a non-apoptotic programmmed cell death dependent on autophagy genes. Nat Cell Biol. 6: 1221-1228, 2004
Maiuri M.C. a spol:Self-eating a nd self-killing:crosstalk between autophagy and apoptosis. Nat Rev Cell Biol 8:741-752 2007
Luo S a Rubinsztein D.C.: Atg5 and Bcl-2 provide novel insights into the interplay between apoptosis and autophagy. Cell Death and Differentiation 14: 1247-1250, 2007
Sperandio S et al. : An alternative, nonapoptotic for of programmed cell death. PNAS 37: 14376-81, 2000.
III.4 Modifikovaná – atenuovaná (regulačně usměrněná) apoptosa
Sem patří proces vzniku bezjaderného, ale životaschopného derivátu původní buňky, omezeného na cytoplasmu. Klasickým příkladem jsou erytrocyty a buňky oční čočky. Zmíněny jsou i krevní destičky a keratinocyty epidermis
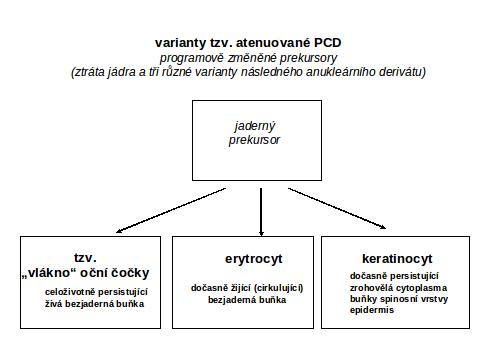
(i) Erytrocyty – deriváty erytroblastů, které procesem expulse ztrácejí pyknotické jádro. Na odpojeném jádře se na zbytcích perinukleární cytoplasmy mění symetrie fosfatidylserinu, která podmiňuje jeho rychlou fagocytosu. Pyknosa jádra není prokazatelně způsobena aktivací tzv. exekučních kaspas (chybí oligonukleosomální typ degradace), ale je štěpen lamin B a protein acinus. Z cytoplasmy mizí veškeré organely procesem autofagie a expulsí autofagosomů (v erytroblastu byl dominantní bohatý proteosyntetický aparát - ribosomy a mitochondrie). Za autofagii mitochondrií je zodpovědná zvýšená exprese Nix proteinu (z Bcl 2 rodiny). Pyknotický vzhled jádra erytroblastů slouží pro snadnou identifikaci hnízd červené řady v erytroblastických hnízdech krvetvorby. Je všeobecně známo, že zralý erytrocyt má omezenou dobu života. Nutno dodat, že lze experimentálně vyvolat klasickou PCD I ve stadiu erytroblastů (deprivací erytropoetinu nebo stimulací interferonem gama).
Zermatti Y. a spol.: Caspase activation is required for terminal erythroid differentiation, J.exp.Med.193: 247-254, 2001
Carlile GW a spol.: Caspase 3 has a nonapoptotic punction in erythroid maturation. Blood 103: 4310-4316, 2004
(ii) Buňky (vlákna) oční čočky se odlišují od erytrocytů tím, že po ztrátě jádra a po maximální redukci cytoplasmatických kompartmentů přežívají po celý život organismu. Vznikají procesem zániku všech cytoplasmatických organel a ztrátou jádra procesem, který má mnohé rysy vnitřní mitochondriálně iniciované PCD I (zvýšení proapoptotických proteinů BAX, BclxL, aktivace kaspasy 3, uvolnění cytochromu c), ale je zároveň pod striktní kontrolou antiapoptotických proteinů ze skupiny Bcl-2 (viz shora), včetně survivinu. Dochází k selektivnímu štěpení alfa a beta spektrinů, ale není atakován aktin. Není přesun fosfatidylserinu na zevní membránu buňky (vlákna). Mechanismus degradace jádra není přesně definován.Pro tento striktně regulovaný proces s rysy apoptosy je ražen termín ABC (apoptosis-related Bcl-2- and caspase-dependent) diferenciace
Weber GF a Menko AS: The canonical intrincic mitochondrial death pathwasy has a non-apoptotoic role in signalling lens cell differentiation. J.Biol.Chem.280:22135-22145, 2005
Situace v epidermis (rohovějící dlaždicový epitel). Konec životního cyklu keratinocytu je charakterisován (mimo jiné) zánikem jádra, vymizením organel a paralelně akumulací cytokeratinu a filagrinu, vše provázené výrazným zřetězením glutaminem (aktivita transglutminasy). Proces rohovění keratinocytu nemá charakter apoptosy (PCD I), degradace jader nemá interoligosomální charakter, povaha endonukleasy je neznámá. Exekuční kaspasy nejsou prokazatelné. Výrazně a specificky pro rohovějící epidermis je exprimována aktivovaná kaspasa 14, která nehraje roli v známých procesech apoptosy. Proces je charakterisován pouze obecně jako programovaná smrt keratinocytu, některými jako terminální diferenciace keratinocytu, odlišná od apoptosy. Apoptosu lze indukovat v kultivovaných liniích dlaždicového epitelu, výjimečně in vivo UV ozářením.
V tomto smyslu je situace v epidermis diametrálně odlišná od situace ve vlasovém foliklu, kde je apoptosa výrazně vyjádřená ve fázi katagenu.
Wehrli P. a spol.: Death receptors in cutaneous biology and disease. J. Incest. Dermatos. 115:141-148, 2000
Raj D. a spol.: Keratinocyte apoptosis in epidermal development and disease. J.Invest. Dmatol.126: -243-257, 2006
Houben E a spol.: A keratinocyte´s course of life. Skin Pharmacol.Physiol. 20:122-132, 2007
Botchareva N.V. a spol.: Apoptosis in the hair follicle. J. Incest. Dermatos.126: 258-264, 2006)
Pokud jde o krevní destičky, je situace poněkud odlišná. Destičky jsou deriváty cytoplasmy zralého megakaryocytu, vysoce polyploidního elementu. Jsou uvolňovány ve formě cytoplasmatických výběžků, které obsahují organela destiček (LRO- viz kapitola lysosomální systém, mitochondrie, densní granula). Tyto jsou odděleny jako protrombocyty a následně ještě děleny na výsledné trombocyty. Tento proces má určitou obdobu snad pouze v tvorbě tzv. endoteliálních mikropartikulí. Po vyčerpání cytoplasmatického „poolu“ je celé jádro se zbytkem perinukleární cytoplasmy odstraněno fagocytosou okolními makrofágy procesem, který má řadu znaků apoptosy. Tento finální proces s rysy apoptosy je předcházen aktivací exekuční kaspasy 3 s prokazatelnými produkty degradace jejich substrátů. Tento proces je omezen na cytoplasmu a hraje roli v diferenciaci cytoplasmatického „poolu“ prekursorů destiček Další podrobnosti v následných publikacích
Zauli G a spol.: In vitro senescence and apoptotic cell dotah of human megakaryocytes. Blood 9%: 2234-2243, 1997
Radley J.M. and Scurfiel G.: The mechanism of platelet release. Blood 56:996-999,1980
Cryamer E.M. a spol.: Ultrastructure of platelet formation by human megakaryocytes cultured with the Mpl ligandu. Blood 89: 2336.-2343, 1997
De Botton S a spol.: Platelet formation is the consequence of caspase activation within megakaryocytes. Blood 100: 1310-1317, 2002
III.5 Aktivace kaspas v diferenciaci buněk je dnes všeobecně uznávaná. Jde o kaspasy, známé jako exekuční v procesu PCD I. Jejich indukce byla popsána v diferenciaci monocytu na makrofág při stimulaci cytokinem M-CSF, dále při diferenciaci osteoblastu a kosterního svalu.Všechny tyto procesy jsou prosté projevů apoptosy.
Fernando P a spol. Caspase 3 activity is required for skeletal muscle differentiation. PNAS 99: 11025-11030, 2002
Mogi M , Tovaru A: Activation of caspase is required for osteoblastic differentiation. J.Biol.Chem. 48:47477-47482, 2003
Sorbet O. a spol.: Specific involvement of caspase in the differentiation of monocytes into macrophages. Blood 100: 4446-4453, 2002
III.6 Zánětlivé (inflamatorní) kaspasy
Tyto kaspasy se podílejí na regulaci zánětlivé odpovědi především regulací maturace zánětlivých cytokinů, jejich aktivace však nevyvolává apoptosu.: U člověka to je kaspasa-1, -4 a -5, u myši kaspasa-1, -11 a -12. Kaspasa-1 byla identifikována jako vůbec první kaspasa (interleukin-1β-converting enzyme či ICE protease) a je zodpovědná za proteolytickou maturaci zánětlivých cytokinů IL-1, IL-18, ev. IL-33. Kaspasa-1, ev. i další kaspasy této rodiny, je aktivována v tzv. inflamasomech (viz texty mikrobiologie), Kromě kaspasy-1 není pro většinu členů této rodiny znám žádný specifický substrát. Předpokládá se, že kaspasa-12 může blokovat aktivaci kaspasy-1, a tak zvyšovat susceptibilitu k bakteriálním infekcím. Funkční gen je exprimován jen u myší, u většiny lidské populace se vyskytuje jako pseudogen; celý gen je exprimován u části černošské populace, kde způsobuje sníženou odpověď na LPS-indukovanou expresi cytokinů (zejm. IL-1β) a je spojován s horším, často fatálním průběhem septického šoku.
IV. Některé poznámky
Ze stále rostoucího množství publikací pojednávajících o problematice nekrosy a apoptosy lze vytušit, že reálné definování molekulárních mechanismů je stále neuspokojivé. Tento text má vyjadřovat pouze obecný pohled na tyto procesy a neklade si nárok na detaily na úrovni čistě molekulární. Pro tyto odkazujeme na souhrnné práce
Klener P.Jr a spol.: Cell death signalling pathways in the pathogenesis and therapy of hematologic malignancies: overview of apoptotic pathways. Folia Biologova (Praha) 52: 34-44, 2006
Další pohled na mechanismy buněčné smrti a funkce kaspas jsou podány v řadě publikací, u nichž zmiňujeme následující:
Galluzzi L.a spol.: Cell dotah modalities: classification and pathophysiological implications.Cell Death and Differentiation 14:1237-1266, 2007
Lockshin R.A., Zajeti Z: Caspase-independent cell death. Oncogene 23:2766-2773, 2004
Einstein-Rotkopf Y, Arama E.: Can´t live without them, can live with them: role of caspase durnig vital cellular processes. Apoptosis 14: 980-995, 2009
Objevuje se i termín programovaná buněčná smrt, a to v případech, kdy k zániku buňky nedochází aktivací kaspas a kdy není výraznější kondensace chromatinu (není pyknosa).
Jäättelä M a Tschopp J.: Caspase-indeůpendent cell dotah in T lymphocytes.. Nature imunology 4:416.-423, 2003
Poznámky k aponekrose. Na rozdíl od předchozích zmíněných stavů, u nichž byla aktivace PCD nastartována regulačním mechanismem, u nekroapoptosy může jít o neprogramovanou aktivaci kaskády PCD, jejíž součásti mohou být i karikaturou normálního procesu. Z dosavadních studií plyne, že při patologických procesech dochází k selhání buněčných organel připomínající do značné míry selhání orgánů v makroorganismu. Jejich poškozením se dostává řada komponent mimo svůj přirozený kompartment a stávají se tak východiskem kaskád, které jsou pro biologickou integritu buňky fatální. Je otázka, zda jsou vývojově předurčené nebo zda jde o řetězec komplikací, rozvinutý po selhání určité organely ad hoc.Může jich být tedy nepřeberné množství. Za patologických procesů mohou být tyto cesty aktivovány, pokud nedojde k masivnímu poškození buňky nekrogenním procesem.
V nejobecnějším slova smyslu lze vidět rozdíl mezi nekrosou a apoptosou jako mezi vraždou buňky, uskutečněnou nejrůznějšími způsoby (přičemž hraje buňka roli zcela pasivní) a mezi exekucí, uskutečněnou aktivací procesů, jejichž scénář je ustálen fylogeneticky. Scénář (scénáře) apoptosy lze s jistou nadsázkou přirovnat k maximálnímu trestu, jehož exekuční varianty se mohou lišit. Jako varianta je zmiňována sebevražda buňky. Rozhodnutí k exekuci může být dosaženo na úrovni individuální buňky nebo na úrovni tkáně.